Remeron 15mg, 30mg Mirtazapine Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Remeron i jak się go stosuje?
Remeron to lek na receptę stosowany w leczeniu objawów depresji. Remeron 30mg może być stosowany samodzielnie lub z innymi lekami.
Remeron należy do klasy leków zwanych antydepresantami, antagonistami alfa-2; Leki przeciwdepresyjne, Inne.
Nie wiadomo, czy Remeron 30 mg jest bezpieczny i skuteczny u dzieci.
Jakie są możliwe skutki uboczne Remeron 30mg?
Remeron może powodować poważne skutki uboczne, w tym:
- uczucie niepokoju,
- goniące myśli,
- zmniejszone zapotrzebowanie na sen,
- nietypowe zachowanie ryzykowne,
- uczucia skrajnego szczęścia lub smutku,
- bycie bardziej rozmownym niż zwykle,
- rozmazany obraz,
- widzenie tunelowe,
- ból lub obrzęk oka,
- widząc aureole wokół świateł,
- zawroty,
- gorączka,
- dreszcze,
- ból gardła,
- owrzodzenia jamy ustnej,
- zmiany wagi lub apetytu,
- ciężka wysypka, pęcherze lub obrzęk dłoni lub podeszew stóp,
- drgawki (drgawki),
- ból głowy,
- dezorientacja,
- bełkotliwa wymowa,
- silne osłabienie,
- wymioty,
- utrata koordynacji oraz
- czuć się niepewnie
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Remeronu to:
- senność,
- zawroty głowy,
- dziwne sny,
- suchość w ustach,
- zaparcie,
- zwiększony apetyt oraz
- przybranie na wadze
Należy poinformować lekarza, jeśli wystąpią jakiekolwiek objawy niepożądane, które Cię niepokoją lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Remeronu. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Samobójstwa i leki przeciwdepresyjne
Leki przeciwdepresyjne zwiększały w porównaniu z placebo ryzyko myśli i zachowań samobójczych (samobójstwa) u dzieci, młodzieży i młodych dorosłych w krótkoterminowych badaniach nad ciężkimi zaburzeniami depresyjnymi (MDD) i innymi zaburzeniami psychicznymi. Każdy, kto rozważa stosowanie tabletek REMERON® (mirtazapiny) lub jakiegokolwiek innego leku przeciwdepresyjnego u dzieci, młodzieży lub młodych dorosłych, musi zrównoważyć to ryzyko z potrzebą kliniczną. Badania krótkoterminowe nie wykazały wzrostu ryzyka samobójstw w przypadku stosowania leków przeciwdepresyjnych w porównaniu z placebo u osób dorosłych w wieku powyżej 24 lat; wystąpiło zmniejszenie ryzyka w przypadku stosowania leków przeciwdepresyjnych w porównaniu z placebo u osób dorosłych w wieku 65 lat i starszych. Depresja i niektóre inne zaburzenia psychiczne same w sobie wiążą się ze wzrostem ryzyka samobójstwa. Pacjenci w każdym wieku, którzy rozpoczynają leczenie lekami przeciwdepresyjnymi, powinni być odpowiednio monitorowani i ściśle obserwowani pod kątem pogorszenia stanu klinicznego, skłonności samobójczych lub nietypowych zmian w zachowaniu. Rodziny i opiekunowie powinni być poinformowani o potrzebie ścisłej obserwacji i komunikacji z lekarzem. REMERON nie jest dopuszczony do stosowania u pacjentów pediatrycznych. (Patrz OSTRZEŻENIA: Pogorszenie stanu klinicznego i ryzyko samobójstwa, INFORMACJE DLA PACJENTA i ŚRODKI OSTROŻNOŚCI: Stosowanie u dzieci)
OPIS
Tabletki REMERON® (mirtazapina) są lekiem podawanym doustnie. Mirtazapina ma tetracykliczną budowę chemiczną i należy do grupy związków piperazyno-azepinowych. Jest oznaczony jako 1,2,3,4,10,14b-heksahydro-2-metylopirazyno[2,1-a]pirydo[2,3-c]benzazepina i ma wzór empiryczny C17H19N3. Jego masa cząsteczkowa wynosi 265,36. Wzór strukturalny jest następujący i jest to mieszanina racemiczna:
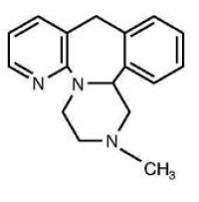
Mirtazapina jest krystalicznym proszkiem o barwie od białej do kremowobiałej, słabo rozpuszczalnym w wodzie.
REMERON jest dostarczany do podawania doustnego w postaci tabletek powlekanych z rowkiem dzielącym, zawierających 15 lub 30 mg mirtazapiny oraz tabletek powlekanych bez rowka dzielącego, zawierających 45 mg mirtazapiny. Każda tabletka zawiera również skrobię kukurydzianą, hydroksypropylocelulozę, stearynian magnezu, koloidalny dwutlenek krzemu, laktozę i inne składniki nieaktywne.
WSKAZANIA
REMERON (mirtazapina) Tabletki są wskazane w leczeniu dużych zaburzeń depresyjnych.
Skuteczność preparatu REMERON w leczeniu dużych zaburzeń depresyjnych została potwierdzona w 6-tygodniowych kontrolowanych badaniach pacjentów ambulatoryjnych, których rozpoznanie najbardziej odpowiadało kategorii dużych zaburzeń depresyjnych według Podręcznika Diagnostycznego i Statystycznego Zaburzeń Psychicznych – 3. edycja (DSM-III) (patrz FARMAKOLOGIA KLINICZNA ).
Epizod depresji dużej (DSM-IV) oznacza wyraźny i stosunkowo utrzymujący się (prawie codziennie przez co najmniej 2 tygodnie) nastrój depresyjny lub dysforyczny, który zwykle zakłóca codzienne funkcjonowanie i obejmuje co najmniej 5 z następujących 9 objawów: nastrój depresyjny, utrata zainteresowania zwykłymi czynnościami, znaczna zmiana masy ciała i (lub) apetytu, bezsenność lub nadmierna senność, pobudzenie psychoruchowe lub opóźnienie, zwiększone zmęczenie, poczucie winy lub bezwartościowości, spowolnienie myślenia lub zaburzenia koncentracji, próba samobójcza lub myśli samobójcze.
Skuteczność preparatu REMERON 15 mg u hospitalizowanych pacjentów z depresją nie została odpowiednio zbadana.
Skuteczność produktu REMERON 15 mg w utrzymaniu odpowiedzi u pacjentów z ciężkimi zaburzeniami depresyjnymi przez okres do 40 tygodni po 8 do 12 tygodniach początkowego leczenia metodą otwartej próby wykazano w badaniu kontrolowanym placebo. Niemniej jednak lekarz decydujący się na stosowanie leku REMERON 15 mg przez dłuższy czas powinien okresowo dokonywać ponownej oceny długoterminowej przydatności leku dla danego pacjenta (patrz FARMAKOLOGIA KLINICZNA ).
DAWKOWANIE I SPOSÓB PODAWANIA
Leczenie wstępne
Zalecana dawka początkowa leku REMERON (mirtazapina) w tabletkach to 15 mg/dobę, podawana w pojedynczej dawce, najlepiej wieczorem przed snem. W kontrolowanych badaniach klinicznych, w których ustalono skuteczność preparatu REMERON w leczeniu dużych zaburzeń depresyjnych, zakres skutecznej dawki wynosił na ogół od 15 do 45 mg/dobę. Chociaż związek między dawką a zadowalającą odpowiedzią w leczeniu dużych zaburzeń depresyjnych na produkt REMERON 15 mg nie został odpowiednio zbadany, pacjenci niereagujący na początkową dawkę 15 mg mogą odnieść korzyść ze zwiększenia dawki do maksymalnie 45 mg/dobę. REMERON ma okres półtrwania w fazie eliminacji wynoszący około 20 do 40 godzin; dlatego zmiany dawki nie powinny być dokonywane w odstępach krótszych niż 1 do 2 tygodni, aby zapewnić wystarczający czas na ocenę odpowiedzi terapeutycznej na daną dawkę.
Osoby w podeszłym wieku i pacjenci z niewydolnością nerek lub wątroby
Klirens mirtazapiny jest zmniejszony u pacjentów w podeszłym wieku oraz u pacjentów z umiarkowanymi do ciężkich zaburzeniami czynności nerek lub wątroby. W związku z tym lekarz przepisujący lek powinien mieć świadomość, że stężenia mirtazapiny w osoczu mogą być zwiększone w tych grupach pacjentów w porównaniu do poziomów obserwowanych u młodszych osób dorosłych bez zaburzeń czynności nerek lub wątroby (patrz ŚRODKI OSTROŻNOŚCI oraz FARMAKOLOGIA KLINICZNA ).
Konserwacja/przedłużone leczenie
Powszechnie uważa się, że ostre epizody depresji wymagają kilku miesięcy lub dłużej długotrwałego leczenia farmakologicznego, wykraczającego poza odpowiedź na ostry epizod. Systematyczna ocena preparatu REMERON (mirtazapina) w tabletkach wykazała, że jego skuteczność w leczeniu dużych zaburzeń depresyjnych utrzymuje się przez okres do 40 tygodni po 8 do 12 tygodniach początkowego leczenia w dawce 15 do 45 mg/dobę (patrz FARMAKOLOGIA KLINICZNA ). Na podstawie tych ograniczonych danych nie wiadomo, czy dawka preparatu REMERON 30 mg potrzebna do leczenia podtrzymującego jest identyczna z dawką potrzebną do uzyskania początkowej odpowiedzi. Pacjenci powinni być okresowo poddawani ponownej ocenie w celu określenia potrzeby leczenia podtrzymującego i odpowiedniej dawki do takiego leczenia.
Zmiana pacjenta na lub z inhibitora monoaminooksydazy (MAOI) przeznaczonego do leczenia zaburzeń psychicznych
Pomiędzy odstawieniem MAOI przeznaczonego do leczenia zaburzeń psychicznych a rozpoczęciem leczenia tabletkami REMERON (mirtazapina) powinno upłynąć co najmniej 14 dni. I odwrotnie, należy odczekać co najmniej 14 dni po odstawieniu preparatu REMERON 30 mg przed rozpoczęciem stosowania IMAO w celu leczenia zaburzeń psychicznych (patrz PRZECIWWSKAZANIA ).
Stosowanie leku REMERON 15 mg z innymi MAOI, takimi jak linezolid lub błękit metylenowy
Nie należy rozpoczynać leczenia preparatem REMERON 15 mg u pacjenta leczonego linezolidem lub dożylnie błękitem metylenowym, ponieważ istnieje zwiększone ryzyko wystąpienia zespołu serotoninowego. U pacjenta wymagającego pilniejszego leczenia schorzenia psychicznego należy rozważyć inne interwencje, w tym hospitalizację (patrz PRZECIWWSKAZANIA ).
niektórych przypadkach pacjent już otrzymujący lek REMERON 30 mg może wymagać pilnego leczenia linezolidem lub dożylnym błękitem metylenowym. Jeśli akceptowalne alternatywy dla linezolidu lub dożylnego leczenia błękitem metylenowym nie są dostępne, a potencjalne korzyści z leczenia linezolidem lub dożylnym błękitem metylenowym są oceniane jako przewyższające ryzyko wystąpienia zespołu serotoninowego u konkretnego pacjenta, należy natychmiast przerwać stosowanie produktu REMERON 30 mg, a linezolid lub dożylny błękit metylenowy niebieski można podawać. Pacjenta należy monitorować pod kątem objawów zespołu serotoninowego przez 2 tygodnie lub do 24 godzin po podaniu ostatniej dawki linezolidu lub dożylnego błękitu metylenowego, w zależności od tego, co nastąpi wcześniej. Leczenie preparatem REMERON 30 mg można wznowić 24 godziny po podaniu ostatniej dawki linezolidu lub dożylnie błękitu metylenowego (patrz OSTRZEŻENIA ).
Ryzyko podania błękitu metylenowego drogą nie dożylną (np. tabletki doustne lub miejscowe wstrzyknięcie) lub w dawkach dożylnych znacznie mniejszych niż 1 mg/kg z produktem REMERON jest niejasne. Klinicysta powinien jednak mieć świadomość, że przy takim stosowaniu mogą pojawić się objawy zespołu serotoninowego (patrz OSTRZEŻENIA ).
Przerwanie leczenia REMERON
Zgłaszano objawy związane z przerwaniem lub zmniejszeniem dawki leku REMERON 15 mg tabletki. Pacjenci powinni być monitorowani pod kątem tych i innych objawów podczas przerywania leczenia lub podczas zmniejszania dawki. W miarę możliwości zaleca się stopniowe zmniejszanie dawki w ciągu kilku tygodni, zamiast nagłego zaprzestania. Jeśli po zmniejszeniu dawki lub po przerwaniu leczenia wystąpią nietolerowane objawy, należy dostosować dawkę na podstawie odpowiedzi klinicznej pacjenta (patrz ŚRODKI OSTROŻNOŚCI oraz DZIAŁANIA NIEPOŻĄDANE ).
Informacje dla pacjentów
Należy poinformować pacjentów, że przyjmowanie leku REMERON może powodować łagodne rozszerzenie źrenic, które u osób podatnych może prowadzić do wystąpienia jaskry zamykającego się kąta. Wcześniej istniejąca jaskra jest prawie zawsze jaskrą otwartego kąta, ponieważ jaskra zamkniętego kąta, po zdiagnozowaniu, może być ostatecznie leczona za pomocą irydektomii. Jaskra otwartego kąta nie jest czynnikiem ryzyka jaskry zamykającego się kąta. Pacjenci mogą chcieć zostać przebadani w celu określenia, czy są podatni na zamknięcie kąta i przejść zabieg profilaktyczny (np. irydektomię), jeśli są podatni.
JAK DOSTARCZONE
REMERON (mirtazapina) Tabletki są dostarczane jako:
Tabletki 15 mg — owalny, rowkowany, żółty, powlekany, z „Organon” wytłoczonym po jednej stronie i „T3Z” po drugiej stronie.
Butelki 30 NDC 0052-0105-30
Tabletki 30 mg — owalny, nacinany, czerwonobrązowy, powlekany, z wytłoczonym napisem „Organon” po jednej stronie i „T5Z” po drugiej stronie.
Butelki 30 NDC 0052-0107-30
Tabletki 45 mg — owalne, białe, powlekane, z wytłoczonym napisem „Organon” po jednej stronie i „T7Z” po drugiej stronie.
Butelki 30 NDC 0052-0109-30
Magazynowanie
Przechowywać w temperaturze 20°C do 25°C (68°F do 77°F); dopuszczalne odchylenia od 15°C do 30°C (59°F do 86°F) [patrz Temperatura pokojowa kontrolowana przez USP ]. Chronić przed światłem i wilgocią.
Wyprodukowano dla: Merck Sharp & Dohme Corp., spółki zależnej Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Producent: NV Organon, Oss, Holandia, filia Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Aktualizacja: lipiec 2016 r.
SKUTKI UBOCZNE
Związane z przerwaniem leczenia
Około 16% z 453 pacjentów, którzy otrzymywali REMERON (mirtazapina) tabletki w 6-tygodniowych kontrolowanych badaniach klinicznych w USA, przerwało leczenie z powodu działań niepożądanych, w porównaniu z 7% z 361 pacjentów otrzymujących placebo w tych badaniach. Najczęstsze zdarzenia (≥ 1%) związane z przerwaniem leczenia i uważane za związane z lekiem (tj. zdarzenia związane z odstawieniem leku z częstością co najmniej dwukrotnie większą niż placebo) przedstawiono w Tabeli 2.
Zdarzenia niepożądane często obserwowane w kontrolowanych badaniach klinicznych w USA
Najczęściej obserwowane zdarzenia niepożądane związane ze stosowaniem tabletek REMERON (mirtazapina) (częstość występowania 5% lub większa) i nie obserwowane z równoważną częstością wśród pacjentów otrzymujących placebo (częstość występowania REMERON co najmniej dwukrotnie większa niż w przypadku placebo) wymieniono w tabeli. 3.
Zdarzenia niepożądane występujące przy częstości występowania 1% lub więcej wśród pacjentów leczonych preparatem REMERON
tabeli 4 wymieniono zdarzenia niepożądane, które wystąpiły z częstością 1% lub więcej i były częstsze niż w grupie placebo, wśród pacjentów leczonych preparatem REMERON (mirtazapina) w tabletkach, którzy uczestniczyli w krótkoterminowych badaniach kontrolowanych placebo w USA, w których pacjenci byli w zakresie od 5 do 60 mg/dobę. Ta tabela pokazuje odsetek pacjentów w każdej grupie, którzy mieli co najmniej 1 epizod zdarzenia w pewnym momencie leczenia. Zgłoszone zdarzenia niepożądane sklasyfikowano przy użyciu standardowej terminologii słownikowej opartej na COSTART.
Lekarz przepisujący lek powinien mieć świadomość, że dane te nie mogą być wykorzystywane do przewidywania częstości występowania działań niepożądanych w trakcie zwykłej praktyki medycznej, gdy charakterystyka pacjenta i inne czynniki różnią się od tych, które przeważały w badaniach klinicznych. Podobnie, cytowane częstotliwości nie mogą być porównywane z danymi uzyskanymi z innych badań obejmujących różne terapie, zastosowania i badaczy. Cytowane dane dostarczają jednak lekarzowi przepisującemu pewną podstawę do oszacowania względnego udziału czynników lekowych i nielekowych w częstości występowania działań niepożądanych w badanej populacji.
Zmiany EKG
Przeanalizowano elektrokardiogramy 338 pacjentów, którzy otrzymywali REMERON (mirtazapina) tabletki i 261 pacjentów, którzy otrzymywali placebo w 6-tygodniowych badaniach kontrolowanych placebo. U pacjentów leczonych mirtazapiną nie obserwowano wydłużenia odstępu QTc ≥ 500 ms; średnia zmiana w QTc wyniosła +1,6 ms dla mirtazapiny i - 3,1 ms dla placebo. Mirtazapina wiązała się ze średnim wzrostem częstości akcji serca o 3,4 uderzeń na minutę w porównaniu do 0,8 uderzeń na minutę w przypadku placebo. Kliniczne znaczenie tych zmian nie jest znane.
Wpływ preparatu REMERON (mirtazapiny) na odstęp QTc oceniano w randomizowanym badaniu klinicznym z grupą kontrolną placebo i dodatnią (moksyfloksacyna) z udziałem 54 zdrowych ochotników, stosując analizę reakcji na ekspozycję. Badanie to wykazało dodatni związek między stężeniami mirtazapiny a wydłużeniem odstępu QTc. Jednak stopień wydłużenia odstępu QT obserwowany zarówno przy dawkach 45 mg (leczniczych), jak i 75 mg (supraterapeutycznych) mirtazapiny nie był na poziomie ogólnie uważanym za klinicznie istotny.
Inne zdarzenia niepożądane obserwowane podczas oceny preparatu REMERON przed wprowadzeniem do obrotu
Podczas oceny przed wprowadzeniem do obrotu, wielokrotne dawki produktu REMERON (mirtazapina) w tabletkach podano 2796 pacjentom w badaniach klinicznych. Warunki i czas trwania ekspozycji na mirtazapinę były bardzo zróżnicowane i obejmowały (w nakładających się kategoriach) badania otwarte i badania z podwójnie ślepą próbą, badania niekontrolowane i kontrolowane, badania szpitalne i ambulatoryjne, badania z ustaloną dawką i miareczkowaniem. Zdarzenia niepożądane związane z tą ekspozycją były rejestrowane przez badaczy klinicznych przy użyciu wybranej przez siebie terminologii. W konsekwencji nie jest możliwe dostarczenie znaczącego oszacowania odsetka osób doświadczających zdarzeń niepożądanych bez wcześniejszego pogrupowania podobnych rodzajów zdarzeń niepożądanych w mniejszą liczbę standaryzowanych kategorii zdarzeń.
poniższych tabelach zgłoszone zdarzenia niepożądane zostały sklasyfikowane przy użyciu standardowej terminologii słownikowej opartej na COSTART. Przedstawione częstości odpowiadają zatem odsetkowi z 2796 pacjentów narażonych na wielokrotne dawki produktu REMERON, u których wystąpiło zdarzenie typu przytoczonego przynajmniej 1 raz podczas przyjmowania produktu REMERON. Uwzględniono wszystkie zgłoszone zdarzenia, z wyjątkiem tych, które zostały już wymienione w Tabeli 4, tych działań niepożądanych, które są albo nadmiernie ogólne, albo nadmiernie specyficzne, aby nie dostarczać informacji, oraz tych zdarzeń, których przyczyna leku była bardzo odległa.
Należy podkreślić, że chociaż zgłoszone zdarzenia wystąpiły podczas leczenia preparatem REMERON 30mg, to niekoniecznie były przez niego spowodowane.
Zdarzenia są dalej klasyfikowane według układu organizmu i wymienione w kolejności malejącej częstości, zgodnie z następującymi definicjami: częste zdarzenia niepożądane to te, które występują raz lub więcej razy u co najmniej 1/100 pacjentów; rzadkie zdarzenia niepożądane to te występujące u 1/100 do 1/1000 pacjentów; rzadkie zdarzenia to te, które występują u mniej niż 1/1000 pacjentów. W tym wykazie pojawiają się tylko te zdarzenia, które nie zostały jeszcze wymienione w tabeli 4. Zdarzenia o dużym znaczeniu klinicznym opisano również w rozdziałach OSTRZEŻENIA i ŚRODKI OSTROŻNOŚCI.
Ciało jako całość: częste: złe samopoczucie, ból brzucha, ostry zespół brzucha; rzadko: dreszcze, gorączka, obrzęk twarzy, owrzodzenie, nadwrażliwość na światło, sztywność karku, ból karku, powiększenie brzucha; rzadko: zapalenie tkanki łącznej, ból w klatce piersiowej pod mostkiem.
Układu sercowo-naczyniowego: często: nadciśnienie, rozszerzenie naczyń; rzadko: dusznica bolesna, zawał mięśnia sercowego, bradykardia, dodatkowe skurcze komorowe, omdlenia, migrena, niedociśnienie; rzadko: arytmia przedsionkowa, bigeminia, naczyniowy ból głowy, zator tętnicy płucnej, niedokrwienie mózgu, kardiomegalia, zapalenie żył, niewydolność lewego serca.
Układ trawienny: częste: wymioty, anoreksja; rzadko: odbijanie się, zapalenie języka, zapalenie pęcherzyka żółciowego, nudności i wymioty, krwotok dziąseł, zapalenie jamy ustnej, zapalenie okrężnicy, nieprawidłowe wyniki testów czynności wątroby; rzadko: przebarwienia języka, wrzodziejące zapalenie jamy ustnej, powiększenie gruczołów ślinowych, zwiększone wydzielanie śliny, niedrożność jelit, zapalenie trzustki, aftowe zapalenie jamy ustnej, marskość wątroby, zapalenie żołądka, zapalenie żołądka i jelit, kandydoza jamy ustnej, obrzęk języka.
Układ hormonalny: rzadko: wole, niedoczynność tarczycy.
Układ hemiczny i limfatyczny: rzadko: powiększenie węzłów chłonnych, leukopenia, wybroczyny, niedokrwistość, małopłytkowość, limfocytoza, pancytopenia.
Zaburzenia metabolizmu i odżywiania: częste: pragnienie; rzadko: odwodnienie, utrata masy ciała; rzadko: dna moczanowa, zwiększenie SGOT, nieprawidłowe gojenie, zwiększenie aktywności kwaśnej fosfatazy, zwiększenie SGPT, cukrzyca, hiponatremia.
Układ mięśniowo-szkieletowy: częste: miastenia, bóle stawów; rzadko: zapalenie stawów, zapalenie pochewek ścięgnistych; rzadko: złamanie patologiczne, złamanie osteoporozy, ból kości, zapalenie mięśni, zerwanie ścięgna, artroza, zapalenie kaletki.
System nerwowy: często: niedoczulica, apatia, depresja, hipokinezja, zawroty głowy, drżenie, pobudzenie, lęk, amnezja, hiperkinezja, parestezje; niezbyt często: ataksja, majaczenie, urojenia, depersonalizacja, dyskineza, zespół pozapiramidowy, zwiększone libido, zaburzenia koordynacji, dyzartria, omamy, reakcja maniakalna, nerwica, dystonia, wrogość, nasilenie odruchów, chwiejność emocjonalna, euforia, reakcja paranoidalna; rzadko: afazja, oczopląs, akatyzja (niepokój psychoruchowy), otępienie, otępienie, podwójne widzenie, uzależnienie od narkotyków, porażenie, drgawki typu grand mal, hipotonia, mioklonie, depresja psychotyczna, zespół odstawienia, zespół serotoninowy.
Układ oddechowy: częste: nasilony kaszel, zapalenie zatok; rzadko: krwawienie z nosa, zapalenie oskrzeli, astma, zapalenie płuc; rzadko: asfiksja, zapalenie krtani, odma opłucnowa, czkawka.
Skóra i przydatki: częste: świąd, wysypka; rzadko: trądzik, złuszczające zapalenie skóry, suchość skóry, opryszczka zwykła, łysienie; rzadko: pokrzywka, półpasiec, przerost skóry, łojotok, owrzodzenie skóry.
Zmysły specjalne: rzadko: ból oka, zaburzenia akomodacji, zapalenie spojówek, głuchota, zapalenie rogówki i spojówki, zaburzenia łzawienia, jaskra zamykającego się kąta, nadmierna słuch, ból ucha; rzadko: zapalenie powiek, częściowa przejściowa głuchota, zapalenie ucha środkowego, utrata smaku, węch.
Układ moczowo-płciowy: częste: infekcja dróg moczowych; rzadko: kamień nerkowy, zapalenie pęcherza moczowego, bolesne oddawanie moczu, nietrzymanie moczu, zatrzymanie moczu, zapalenie pochwy, krwiomocz, ból piersi, brak miesiączki, bolesne miesiączkowanie, leukorrhea, impotencja; rzadko: wielomocz, zapalenie cewki moczowej, krwotok maciczny, krwotok miesiączkowy, nieprawidłowy wytrysk, obrzęk piersi, powiększenie piersi, parcie na mocz.
Inne zdarzenia niepożądane zaobserwowane podczas oceny produktu REMERON po wprowadzeniu do obrotu
Zdarzenia niepożądane zgłaszane od wprowadzenia na rynek, które były czasowo (ale niekoniecznie przyczynowo) związane z terapią mirtazapiną, obejmują przypadki arytmii komorowej Torsades de Pointes. Jednak w większości tych przypadków w grę wchodziły leki towarzyszące. Zgłaszano również przypadki ciężkich reakcji skórnych, w tym zespołu Stevensa-Johnsona, pęcherzowego zapalenia skóry, rumienia wielopostaciowego i toksycznej martwicy naskórka. Zgłaszano również zwiększone poziomy kinazy kreatynowej we krwi i rabdomiolizę.
Nadużywanie i uzależnienie od narkotyków
Klasa substancji kontrolowanych
REMERON (mirtazapina) Tabletki nie są substancją kontrolowaną.
Uzależnienie fizyczne i psychologiczne
Lek REMERON (mirtazapina) w tabletkach nie był systematycznie badany u zwierząt i ludzi pod kątem możliwości nadużywania, tolerancji lub uzależnienia fizycznego. Chociaż badania kliniczne nie wykazały żadnej tendencji do jakichkolwiek zachowań związanych z poszukiwaniem leku, obserwacje te nie były systematyczne i na podstawie tego ograniczonego doświadczenia nie można przewidzieć zakresu, w jakim lek działający na OUN będzie niewłaściwie stosowany, przekierowywany i /lub nadużywane po wprowadzeniu do obrotu. W związku z tym pacjentów należy dokładnie zbadać pod kątem nadużywania leków w wywiadzie i uważnie obserwować ich pod kątem objawów niewłaściwego stosowania lub nadużywania produktu REMERON (np. rozwój tolerancji, zwiększanie dawki, poszukiwanie leku).
INTERAKCJE Z LEKAMI
Podobnie jak w przypadku innych leków, istnieje możliwość interakcji poprzez różne mechanizmy (np. hamowanie lub wzmacnianie farmakodynamiki, farmakokinetyki itp.) (patrz FARMAKOLOGIA KLINICZNA ).
Inhibitory monoaminooksydazy
(Widzieć PRZECIWWSKAZANIA , OSTRZEŻENIA , oraz DAWKOWANIE I SPOSÓB PODAWANIA .)
Leki serotoninergiczne
(Widzieć PRZECIWWSKAZANIA oraz OSTRZEŻENIA .)
Leki wpływające na metabolizm wątroby
Indukcja lub hamowanie enzymów metabolizujących leki może mieć wpływ na metabolizm i farmakokinetykę produktu REMERON (mirtazapina).
Leki metabolizowane przez i/lub hamujące enzymy cytochromu P450
Induktory enzymów CYP
(w badaniach tych stosowano oba leki w stanie stacjonarnym)
Fenytoina
U zdrowych mężczyzn (n=18) fenytoina (200 mg na dobę) zwiększała klirens mirtazapiny (30 mg na dobę) około 2-krotnie, powodując zmniejszenie średniego stężenia mirtazapiny w osoczu o 45%. Mirtazapina nie wpływała znacząco na farmakokinetykę fenytoiny.
Karbamazepina
U zdrowych mężczyzn (n=24) karbamazepina (400 mg dwa razy na dobę) zwiększała klirens mirtazapiny (15 mg dwa razy na dobę) około 2-krotnie, powodując zmniejszenie średniego stężenia mirtazapiny w osoczu o 60%.
przypadku dodania fenytoiny, karbamazepiny lub innego induktora metabolizmu wątrobowego (takiego jak ryfampicyna) do leczenia mirtazapiną może być konieczne zwiększenie dawki mirtazapiny. W przypadku przerwania leczenia takim produktem leczniczym może być konieczne zmniejszenie dawki mirtazapiny.
Inhibitory enzymów CYP
Cymetydyna
U zdrowych pacjentów płci męskiej (n=12), gdy cymetydyna, słaby inhibitor CYP1A2, CYP2D6 i CYP3A4, podawana w dawce 800 mg dwa razy na dobę w stanie stacjonarnym była podawana jednocześnie z mirtazapiną (30 mg na dobę) w stanie stacjonarnym, pole powierzchni pod krzywą (AUC) mirtazapiny wzrosła o ponad 50%. Mirtazapina nie powodowała istotnych zmian w farmakokinetyce cymetydyny. Może zaistnieć konieczność zmniejszenia dawki mirtazapiny w przypadku rozpoczęcia jednoczesnego leczenia cymetydyną lub zwiększenia jej w przypadku przerwania leczenia cymetydyną.
Ketokonazol
zdrowych mężczyzn rasy kaukaskiej (n=24) jednoczesne podawanie ketokonazolu, silnego inhibitora CYP3A4 (200 mg dwa razy na dobę przez 6,5 dnia) zwiększało maksymalne stężenia w osoczu i AUC pojedynczej dawki 30 mg mirtazapiny o około 40% i 50%, odpowiednio.
Należy zachować ostrożność podczas jednoczesnego podawania mirtazapiny z silnymi inhibitorami CYP3A4, inhibitorami proteazy wirusa HIV, lekami przeciwgrzybiczymi z grupy azoli, erytromycyną lub nefazodonem.
Paroksetyna
W badaniu interakcji in vivo u zdrowych pacjentów z intensywnym metabolizmem CYP2D6 (n=24), mirtazapina (30 mg/dobę) w stanie stacjonarnym nie powodowała istotnych zmian w farmakokinetyce paroksetyny w stanie stacjonarnym (40 mg/dobę). inhibitor CYP2D6.
Inne interakcje między lekami
Amitryptylina
zdrowych pacjentów z intensywnym metabolizmem CYP2D6 (n=32), amitryptylina (75 mg na dobę) w stanie stacjonarnym nie powodowała istotnych zmian w farmakokinetyce mirtazapiny w stanie stacjonarnym (30 mg na dobę); mirtazapina również nie powodowała istotnych zmian w farmakokinetyce amitryptyliny.
Warfaryna
U zdrowych mężczyzn (n=16) mirtazapina (30 mg na dobę) w stanie stacjonarnym powodowała niewielki (0,2), ale statystycznie istotny wzrost międzynarodowego współczynnika znormalizowanego (INR) u osób leczonych warfaryną. Ponieważ przy wyższych dawkach mirtazapiny nie można wykluczyć bardziej nasilonego działania, zaleca się monitorowanie INR w przypadku jednoczesnego leczenia warfaryną i mirtazapiną.
Lit
zdrowych ochotników płci męskiej podczas jednoczesnego leczenia subterapeutycznymi stężeniami litu (600 mg/dobę przez 10 dni) w stanie stacjonarnym i pojedynczej dawki 30 mg mirtazapiny nie obserwowano istotnych działań klinicznych ani znaczących zmian w farmakokinetyce. Wpływ większych dawek litu na farmakokinetykę mirtazapiny nie jest znany.
risperidon
W nierandomizowanym badaniu interakcji in vivo, osoby (n=6) wymagające leczenia lekiem przeciwpsychotycznym i przeciwdepresyjnym wykazały, że mirtazapina (30 mg na dobę) w stanie stacjonarnym nie wpływała na farmakokinetykę rysperydonu (do 3 mg). oferta).
Alkohol
Jednoczesne podawanie alkoholu (w ilości odpowiadającej 60 g) miało minimalny wpływ na stężenie mirtazapiny (15 mg) w osoczu u 6 zdrowych mężczyzn. Wykazano jednak, że upośledzenie zdolności poznawczych i motorycznych wywoływane przez REMERON sumuje się z upośledzeniem wywoływanym przez alkohol. W związku z tym pacjentom należy zalecić unikanie alkoholu podczas przyjmowania leku REMERON.
Diazepam
Jednoczesne podawanie diazepamu (15 mg) miało minimalny wpływ na stężenie mirtazapiny (15 mg) w osoczu u 12 zdrowych osób. Wykazano jednak, że upośledzenie zdolności motorycznych wywołane przez REMERON 30 mg sumuje się z zaburzeniami spowodowanymi przez diazepam. W związku z tym pacjentom należy zalecić unikanie diazepamu i innych podobnych leków podczas przyjmowania leku REMERON.
Leki wydłużające odstęp QTc
Ryzyko wydłużenia odstępu QT i (lub) arytmii komorowych (np. Torsades de Pointes) może być zwiększone podczas jednoczesnego stosowania leków wydłużających odstęp QTc (np. niektóre leki przeciwpsychotyczne i antybiotyki) oraz w przypadku przedawkowania mirtazapiny (patrz DZIAŁANIA NIEPOŻĄDANE oraz PRZEDAWKOWAĆ Sekcje).
OSTRZEŻENIA
Pogorszenie stanu klinicznego i ryzyko samobójstwa
Pacjenci z ciężkimi zaburzeniami depresyjnymi (MDD), zarówno dorośli, jak i pediatryczni, mogą doświadczać nasilenia depresji i/lub pojawienia się myśli i zachowań samobójczych (samobójstwa) lub nietypowych zmian w zachowaniu, niezależnie od tego, czy przyjmują leki przeciwdepresyjne, a to ryzyko może utrzymywać się aż do wystąpienia znacznej remisji. Samobójstwo jest znanym ryzykiem depresji i niektórych innych zaburzeń psychicznych, a same te zaburzenia są najsilniejszymi predyktorami samobójstwa. Od dawna istnieje jednak obawa, że leki przeciwdepresyjne mogą odgrywać rolę w wywoływaniu nasilenia depresji i pojawianiu się myśli samobójczych u niektórych pacjentów we wczesnych fazach leczenia. Zbiorcze analizy krótkoterminowych, kontrolowanych placebo badań leków przeciwdepresyjnych (SSRI i inne) wykazały, że leki te zwiększają ryzyko myśli i zachowań samobójczych (samobójstwa) u dzieci, młodzieży i młodych dorosłych (w wieku 18-24 lat) z ciężką depresją zaburzenia (MDD) i inne zaburzenia psychiczne. Badania krótkoterminowe nie wykazały wzrostu ryzyka samobójstw w przypadku stosowania leków przeciwdepresyjnych w porównaniu z placebo u osób dorosłych w wieku powyżej 24 lat; wystąpiło zmniejszenie ryzyka w przypadku stosowania leków przeciwdepresyjnych w porównaniu z placebo u osób dorosłych w wieku 65 lat i starszych.
Połączone analizy badań kontrolowanych placebo u dzieci i młodzieży z MDD, zaburzeniami obsesyjno-kompulsywnymi (OCD) lub innymi zaburzeniami psychicznymi obejmowały łącznie 24 krótkoterminowe badania 9 leków przeciwdepresyjnych z udziałem ponad 4400 pacjentów. Zbiorcze analizy badań kontrolowanych placebo u dorosłych z MDD lub innymi zaburzeniami psychicznymi obejmowały łącznie 295 krótkoterminowych badań (mediana czasu trwania wynosząca 2 miesiące) 11 leków przeciwdepresyjnych z udziałem ponad 77 000 pacjentów. Istniało znaczne zróżnicowanie ryzyka samobójstwa wśród leków, ale tendencja do wzrostu u młodszych pacjentów w przypadku prawie wszystkich badanych leków. Istniały różnice w bezwzględnym ryzyku samobójstwa w różnych wskazaniach, z największą częstością występowania MDD. Różnice ryzyka (lek vs placebo) były jednak stosunkowo stabilne w obrębie warstw wiekowych i we wskazaniach. Te różnice w ryzyku (różnica między lekami a placebo w liczbie przypadków samobójstw na 1000 leczonych pacjentów) przedstawiono w Tabeli 1.
żadnym z badań pediatrycznych nie doszło do samobójstw. W badaniach z udziałem dorosłych zdarzały się samobójstwa, ale liczba ta nie była wystarczająca, aby wyciągnąć jakiekolwiek wnioski na temat wpływu leku na samobójstwo.
Nie wiadomo, czy ryzyko samobójstwa rozciąga się na długotrwałe używanie, tj. dłużej niż kilka miesięcy. Jednak istnieją dowody z kontrolowanych placebo badań podtrzymujących u dorosłych z depresją, że stosowanie leków przeciwdepresyjnych może opóźnić nawrót depresji.
Wszyscy pacjenci leczeni lekami przeciwdepresyjnymi w jakimkolwiek wskazaniu powinni być odpowiednio monitorowani i obserwowani pod kątem pogorszenia stanu klinicznego, skłonności samobójczych i nietypowych zmian w zachowaniu, szczególnie w ciągu pierwszych kilku miesięcy terapii lekowej lub w czasie zmiany dawki, albo zwiększa się lub maleje.
Następujące objawy: lęk, pobudzenie, ataki paniki, bezsenność, drażliwość, wrogość, agresywność, impulsywność, akatyzję (niepokój psychoruchowy), hipomanię i manię zgłaszano również u dorosłych i dzieci leczonych lekami przeciwdepresyjnymi z powodu dużych zaburzeń depresyjnych. co do innych wskazań, zarówno psychiatrycznych, jak i niepsychiatrycznych. Chociaż nie ustalono związku przyczynowo-skutkowego między pojawieniem się takich objawów a nasileniem depresji i/lub pojawieniem się impulsów samobójczych, istnieje obawa, że takie objawy mogą być prekursorem pojawiania się samobójstw.
Należy rozważyć zmianę schematu leczenia, w tym ewentualnie odstawienie leku, u pacjentów, u których depresja jest stale nasilona lub u których pojawiają się myśli samobójcze lub objawy, które mogą być prekursorami nasilenia depresji lub myśli samobójczych, zwłaszcza jeśli objawy te są ciężkie, nagłe na początku lub nie były częścią objawów występujących u pacjenta.
Rodziny i opiekunowie pacjentów leczonych lekami przeciwdepresyjnymi z powodu dużych zaburzeń depresyjnych lub innych wskazań, zarówno psychiatrycznych, jak i niepsychiatrycznych, powinni być ostrzeżeni o konieczności monitorowania pacjentów pod kątem pojawienia się pobudzenia, drażliwości, nietypowych zmian w zachowaniu i innych objawów opisanych powyżej , a także pojawienia się samobójstw i natychmiastowego zgłaszania takich objawów świadczeniodawcom . Taki monitoring powinien obejmować codzienną obserwację rodzin i opiekunów. Receptę na tabletki REMERON (mirtazapinę) należy wypisać na najmniejszą ilość tabletek, zgodnie z dobrym postępowaniem z pacjentem, aby zmniejszyć ryzyko przedawkowania.
Badanie przesiewowe pacjentów pod kątem choroby afektywnej dwubiegunowej
Poważny epizod depresyjny może być początkowym objawem choroby afektywnej dwubiegunowej. Powszechnie uważa się (chociaż nie zostało to potwierdzone w badaniach kontrolowanych), że leczenie takiego epizodu samym lekiem przeciwdepresyjnym może zwiększyć prawdopodobieństwo wystąpienia epizodu mieszanego/maniakalnego u pacjentów z ryzykiem choroby afektywnej dwubiegunowej. Nie wiadomo, czy którykolwiek z objawów opisanych powyżej reprezentuje taką konwersję. Jednak przed rozpoczęciem leczenia lekiem przeciwdepresyjnym pacjenci z objawami depresji powinni zostać odpowiednio przebadani w celu ustalenia, czy są oni zagrożeni chorobą afektywną dwubiegunową; takie badania przesiewowe powinny obejmować szczegółowy wywiad psychiatryczny, w tym wywiad rodzinny dotyczący samobójstw, choroby afektywnej dwubiegunowej i depresji. Należy zauważyć, że tabletki REMERON (mirtazapina) nie są dopuszczone do stosowania w leczeniu depresji afektywnej dwubiegunowej.
Agranulocytoza
badaniach klinicznych przed wprowadzeniem do obrotu u 2 (1 z zespołem Sjögrena) z 2796 pacjentów leczonych preparatem REMERON (mirtazapina) w tabletkach wystąpiła agranulocytoza [bezwzględna liczba neutrofili (ANC)
Zespół serotoninowy
Zgłaszano rozwój potencjalnie zagrażającego życiu zespołu serotoninowego podczas stosowania samych leków SNRI i SSRI, w tym produktu REMERON 30 mg, ale w szczególności przy jednoczesnym stosowaniu innych leków serotoninergicznych (w tym tryptanów, trójpierścieniowych leków przeciwdepresyjnych, fentanylu, litu, tramadolu, tryptofanu, buspironu i ziele dziurawca) oraz z lekami zaburzającymi metabolizm serotoniny (w szczególności MAOI, zarówno te przeznaczone do leczenia zaburzeń psychicznych, jak i inne, jak linezolid i dożylny błękit metylenowy).
Objawy zespołu serotoninowego mogą obejmować zmiany stanu psychicznego (np. pobudzenie, halucynacje, majaczenie i śpiączka), niestabilność autonomiczną (np. tachykardia, niestabilne ciśnienie krwi, zawroty głowy, pocenie się, uderzenia gorąca, hipertermia), objawy nerwowo-mięśniowe (np. drżenie, sztywność, mioklonie, hiperrefleksja, brak koordynacji), drgawki i/lub objawy żołądkowo-jelitowe (np. nudności, wymioty, biegunka). Pacjenci powinni być monitorowani pod kątem wystąpienia zespołu serotoninowego.
Jednoczesne stosowanie preparatu REMERON 15 mg z inhibitorami MAO przeznaczonymi do leczenia zaburzeń psychicznych jest przeciwwskazane. Preparatu REMERON nie należy również rozpoczynać u pacjentów leczonych inhibitorami MAO, takimi jak linezolid lub dożylnie błękit metylenowy. Wszystkie raporty z błękitem metylenowym, które dostarczały informacji na temat drogi podania, dotyczyły podawania dożylnego w zakresie dawek od 1 mg/kg do 8 mg/kg. Żadne doniesienia nie dotyczyły podawania błękitu metylenowego innymi drogami (takimi jak tabletki doustne lub miejscowe wstrzyknięcie do tkanek) lub w niższych dawkach. Mogą zaistnieć okoliczności, w których konieczne jest rozpoczęcie leczenia inhibitorami MAO, takimi jak linezolid lub dożylny błękit metylenowy u pacjenta przyjmującego REMERON. Remeron 15 mg należy odstawić przed rozpoczęciem leczenia IMAO (patrz: PRZECIWWSKAZANIA oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
Jeśli jednoczesne stosowanie produktu REMERON 30 mg z innymi lekami serotoninergicznymi, w tym tryptanami, trójpierścieniowymi lekami przeciwdepresyjnymi, fentanylem, litem, tramadolem, buspironem, tryptofanem i zielem dziurawca, jest uzasadnione klinicznie, należy pamiętać o potencjalnym zwiększonym ryzyku wystąpienia zespołu serotoninowego, szczególnie podczas rozpoczęcie leczenia i zwiększenie dawki.
W przypadku wystąpienia powyższych zdarzeń należy natychmiast przerwać leczenie preparatem REMERON 30 mg i innymi jednocześnie stosowanymi środkami serotoninergicznymi i rozpocząć leczenie objawowe.
Jaskra zamykającego się kąta
Rozszerzenie źrenic, które występuje po zastosowaniu wielu leków przeciwdepresyjnych, w tym REMERON 15 mg, może wywołać atak zamykającego się kąta u pacjenta z anatomicznie wąskim kątem, który nie ma drożnej tęczówki.
Przedłużenie QT i Torsades de Pointes
Wpływ preparatu REMERON (mirtazapiny) na odstęp QTc oceniano w randomizowanym badaniu klinicznym z grupą kontrolną placebo i dodatnią (moksyfloksacyna) z udziałem 54 zdrowych ochotników, stosując analizę reakcji na ekspozycję. Badanie to wykazało dodatni związek między stężeniami mirtazapiny a wydłużeniem odstępu QTc. Jednak stopień wydłużenia odstępu QT obserwowany zarówno przy dawkach 45 mg (leczniczych), jak i 75 mg (supraterapeutycznych) mirtazapiny nie był na poziomie ogólnie uważanym za klinicznie istotny. Po wprowadzeniu mirtazapiny do obrotu zgłaszano przypadki wydłużenia odstępu QT, torsades de pointes, częstoskurczu komorowego i nagłego zgonu (patrz DZIAŁANIA NIEPOŻĄDANE ). Większość zgłoszeń dotyczyła przedawkowania lub dotyczyła pacjentów z innymi czynnikami ryzyka wydłużenia odstępu QT, w tym jednoczesnego stosowania leków wydłużających odstęp QT (patrz INTERAKCJE Z LEKAMI oraz PRZEDAWKOWAĆ Sekcje). Należy zachować ostrożność, gdy REMERON jest przepisywany pacjentom z rozpoznaną chorobą sercowo-naczyniową lub wydłużeniem odstępu QT w wywiadzie rodzinnym, a także w przypadku jednoczesnego stosowania z innymi produktami leczniczymi, o których sądzi się, że wydłużają odstęp QTc.
ŚRODKI OSTROŻNOŚCI
Ogólny
Objawy odstawienia
Istnieją doniesienia o działaniach niepożądanych po odstawieniu leku REMERON (mirtazapina) w tabletkach (zwłaszcza nagłych), w tym między innymi: zawroty głowy, nietypowe sny, zaburzenia czucia (w tym parestezje i uczucie wstrząsu elektrycznego), pobudzenie, lęk, zmęczenie, splątanie, ból głowy, drżenie, nudności, wymioty i pocenie się lub inne objawy, które mogą mieć znaczenie kliniczne. Większość zgłoszonych przypadków ma charakter łagodny i samoograniczający się. Mimo że zostały one zgłoszone jako działania niepożądane, należy zdawać sobie sprawę, że objawy te mogą być związane z chorobą podstawową.
Pacjenci przyjmujący obecnie REMERON NIE powinni nagle przerywać leczenia ze względu na ryzyko wystąpienia objawów odstawiennych. W momencie podjęcia przez lekarza decyzji o przerwaniu leczenia preparatem REMERON, zaleca się stopniowe zmniejszanie dawki, a nie nagłe odstawienie.
Akatyzja/Niepokój psychoruchowy
Stosowanie leków przeciwdepresyjnych wiąże się z rozwojem akatyzji, charakteryzującej się subiektywnie nieprzyjemnym lub niepokojącym niepokojem i potrzebą poruszania się, której często towarzyszy niemożność siedzenia lub stania w miejscu. Jest to najbardziej prawdopodobne w ciągu pierwszych kilku tygodni leczenia. U pacjentów, u których wystąpią te objawy, zwiększenie dawki może być szkodliwe.
Hiponatremia
Bardzo rzadko zgłaszano hiponatremię podczas stosowania mirtazapiny. Należy zachować ostrożność u pacjentów z grupy ryzyka, takich jak pacjenci w podeszłym wieku lub pacjenci jednocześnie leczeni lekami, o których wiadomo, że powodują hiponatremię.
Senność
kontrolowanych badaniach w USA senność zgłaszano u 54% pacjentów leczonych preparatem REMERON (mirtazapina) w porównaniu z 18% w przypadku placebo i 60% w przypadku amitryptyliny. W tych badaniach senność spowodowała przerwanie leczenia u 10,4% pacjentów leczonych produktem REMERON w porównaniu z 2,2% w przypadku placebo. Nie jest jasne, czy rozwija się tolerancja na senne działanie preparatu REMERON. Ze względu na potencjalnie istotny wpływ leku REMERON 30 mg na upośledzenie sprawności, pacjentów należy ostrzec przed wykonywaniem czynności wymagających czujności, dopóki nie będą w stanie ocenić wpływu leku na własną sprawność psychomotoryczną (patrz INFORMACJA O PACJENCIE ).
Zawroty głowy
W kontrolowanych badaniach w USA zawroty głowy zgłaszano u 7% pacjentów leczonych preparatem REMERON, w porównaniu z 3% w grupie placebo i 14% w grupie amitryptyliny. Nie jest jasne, czy rozwija się tolerancja na zawroty głowy obserwowane w związku ze stosowaniem leku REMERON.
Zwiększony apetyt/przyrost masy ciała
kontrolowanych badaniach w USA wzrost apetytu odnotowano u 17% pacjentów leczonych preparatem REMERON 30 mg, w porównaniu do 2% w przypadku placebo i 6% w przypadku amitryptyliny. W tych samych badaniach zwiększenie masy ciała o ≥ 7% masy ciała zgłoszono u 7,5% pacjentów leczonych mirtazapiną w porównaniu z 0% w przypadku placebo i 5,9% w przypadku amitryptyliny. W puli badań prowadzonych w Stanach Zjednoczonych przed wprowadzeniem do obrotu, obejmujących wielu pacjentów poddawanych długotrwałemu, otwartemu leczeniu, 8% pacjentów otrzymujących REMERON 30 mg przerwało leczenie z powodu przyrostu masy ciała. W trwającym 8 tygodni pediatrycznym badaniu klinicznym, w którym stosowano dawki od 15 do 45 mg/dobę, 49% pacjentów leczonych produktem REMERON odnotowało przyrost masy ciała o co najmniej 7% w porównaniu z 5,7% pacjentów otrzymujących placebo (patrz ŚRODKI OSTROŻNOŚCI : Zastosowanie pediatryczne ).
Cholesterol/trójglicerydy
kontrolowanych badaniach w USA, wzrost cholesterolu na czczo do ≥ 20% powyżej górnych granic normy zaobserwowano u 15% pacjentów leczonych preparatem REMERON 30 mg, w porównaniu z 7% w przypadku placebo i 8% w przypadku amitryptyliny. W tych samych badaniach zwiększenie stężenia triglicerydów nie na czczo do ≥ 500 mg/dl obserwowano u 6% pacjentów leczonych mirtazapiną w porównaniu z 3% w przypadku placebo i 3% w przypadku amitryptyliny.
Podwyższenie transaminaz
Klinicznie istotne zwiększenie aktywności AlAT (SGPT) (≥ 3-krotność górnej granicy normy) zaobserwowano u 2,0% (8/424) pacjentów otrzymujących produkt REMERON 30 mg w puli krótkoterminowych badań kontrolowanych w USA, w porównaniu z 0,3% (1/328) pacjentów otrzymujących placebo i 2,0% (3/181) pacjentów otrzymujących amitryptylinę. U większości tych pacjentów ze wzrostem AlAT nie wystąpiły oznaki lub objawy związane z upośledzoną czynnością wątroby. Podczas gdy niektórzy pacjenci zostali odstawieni z powodu wzrostu aktywności AlAT, w innych przypadkach poziomy enzymów powróciły do normy pomimo kontynuacji leczenia produktem REMERON. REMERON należy stosować ostrożnie u pacjentów z zaburzeniami czynności wątroby (patrz FARMAKOLOGIA KLINICZNA oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
Aktywacja manii/hipomanii
Mania/hipomania wystąpiły u około 0,2% (3/1299 pacjentów) pacjentów leczonych produktem REMERON w badaniach w USA. Chociaż częstość występowania manii/hipomanii była bardzo niska podczas leczenia mirtazapiną, należy ją stosować ostrożnie u pacjentów z manią/hipomanią w wywiadzie.
Konfiskata
badaniach klinicznych przed wprowadzeniem do obrotu zgłoszono tylko 1 drgawki spośród 2796 pacjentów w USA i poza USA leczonych produktem REMERON. Jednak nie przeprowadzono żadnych kontrolowanych badań u pacjentów z napadami drgawkowymi w wywiadzie. Dlatego należy zachować ostrożność podczas stosowania mirtazapiny u tych pacjentów.
Stosowanie u pacjentów ze współistniejącą chorobą
Doświadczenie kliniczne ze stosowaniem preparatu REMERON u pacjentów ze współistniejącą chorobą ogólnoustrojową jest ograniczone. W związku z tym zaleca się ostrożność przy przepisywaniu mirtazapiny pacjentom z chorobami lub stanami, które wpływają na metabolizm lub odpowiedzi hemodynamiczne.
REMERON nie był systematycznie oceniany ani stosowany w jakimkolwiek istotnym stopniu u pacjentów z niedawno przebytym zawałem mięśnia sercowego lub inną istotną chorobą serca. Remeron był związany ze znacznym niedociśnieniem ortostatycznym we wczesnych badaniach farmakologii klinicznej z udziałem zdrowych ochotników. W badaniach klinicznych z udziałem pacjentów z depresją rzadko obserwowano niedociśnienie ortostatyczne. REMERON 15 mg należy stosować ostrożnie u pacjentów z rozpoznaną chorobą sercowo-naczyniową lub mózgowo-naczyniową, którą może zaostrzyć niedociśnienie (przebyty zawał mięśnia sercowego, dusznica bolesna lub udar niedokrwienny) oraz stany predysponujące pacjentów do niedociśnienia (odwodnienie, hipowolemia i leczenie przeciwnadciśnieniowe). lek).
Klirens mirtazapiny jest zmniejszony u pacjentów z umiarkowanym [współczynnikiem przesączania kłębuszkowego (GFR)=11-39 ml/min/1,73 m²] i ciężkim [GFR FARMAKOLOGIA KLINICZNA oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
Informacje dla pacjentów
Lekarze przepisujący lek lub inni pracownicy służby zdrowia powinni informować pacjentów, ich rodziny i ich opiekunów o korzyściach i zagrożeniach związanych z leczeniem preparatem REMERON (mirtazapina) w tabletkach oraz powinni doradzać im w zakresie właściwego stosowania. Pacjent Przewodnik po lekach o „Lekach przeciwdepresyjnych, depresji i innych poważnych chorobach psychicznych oraz myślach i działaniach samobójczych” jest dostępna dla firmy REMERON. Lekarz lub pracownik służby zdrowia powinien poinstruować pacjentów, ich rodziny i ich opiekunów, aby przeczytali Przewodnik po lekach i powinien pomóc im w zrozumieniu jego treści. Pacjenci powinni mieć możliwość omówienia treści Przewodnik po lekach oraz uzyskanie odpowiedzi na wszelkie pytania, jakie mogą mieć. Pełny tekst Przewodnik po lekach jest przedrukowany na końcu tego dokumentu.
Pacjentów należy poinformować o następujących kwestiach i poprosić o powiadomienie lekarza przepisującego lek, jeśli wystąpią one podczas przyjmowania leku REMERON.
Pogorszenie stanu klinicznego i ryzyko samobójstwa
Należy zachęcać pacjentów, ich rodziny i ich opiekunów do wyczulenia na pojawienie się lęku, pobudzenia, ataków paniki, bezsenności, drażliwości, wrogości, agresywności, impulsywności, akatyzji (niepokoju psychoruchowego), hipomanii, manii i innych nietypowych zmian w zachowaniu , nasilenie depresji i myśli samobójcze, szczególnie na początku leczenia przeciwdepresyjnego oraz przy zwiększaniu lub zmniejszaniu dawki. Rodzinom i opiekunom pacjentów należy zalecić, aby codziennie zwracali uwagę na pojawienie się takich objawów, ponieważ zmiany mogą być nagłe. Takie objawy należy zgłaszać lekarzowi lub pracownikowi służby zdrowia, zwłaszcza jeśli są one ciężkie, mają nagły początek lub nie były częścią objawów występujących u pacjenta. Takie objawy mogą wiązać się ze zwiększonym ryzykiem myśli i zachowań samobójczych i wskazują na potrzebę bardzo ścisłego monitorowania i ewentualnie zmian w leczeniu.
Agranulocytoza
Pacjentów, którzy mają otrzymać preparat REMERON, należy ostrzec o ryzyku rozwoju agranulocytozy. Pacjentom należy zalecić, aby skontaktowali się z lekarzem, jeśli wystąpią jakiekolwiek oznaki zakażenia, takie jak gorączka, dreszcze, ból gardła, owrzodzenie błony śluzowej lub inne możliwe objawy zakażenia. Szczególną uwagę należy zwrócić na wszelkie dolegliwości grypopodobne lub inne objawy, które mogą sugerować zakażenie.
Zakłócenia sprawności poznawczej i motorycznej
REMERON 15mg może zaburzać ocenę sytuacji, myślenie, a zwłaszcza zdolności motoryczne, ze względu na silne działanie uspokajające. Senność związana ze stosowaniem mirtazapiny może upośledzać zdolność pacjenta do prowadzenia pojazdów, obsługiwania maszyn lub wykonywania zadań wymagających czujności. Dlatego należy ostrzec pacjentów przed podejmowaniem niebezpiecznych czynności, dopóki nie upewnią się, że terapia REMERON nie wpływa niekorzystnie na ich zdolność do wykonywania takich czynności.
Ukończenie kursu terapii
Chociaż pacjenci mogą zauważyć poprawę podczas leczenia preparatem REMERON 15 mg w ciągu 1 do 4 tygodni, należy im zalecić kontynuację leczenia zgodnie z zaleceniami.
Leki towarzyszące
Pacjentom należy zalecić poinformowanie lekarza o przyjmowaniu lub zamiarze przyjmowania jakichkolwiek leków na receptę lub bez recepty, ponieważ istnieje możliwość interakcji REMERON z innymi lekami.
Pacjenci powinni być świadomi potencjalnego zwiększonego ryzyka wystąpienia zespołu serotoninowego, jeśli jednoczesne stosowanie produktu REMERON 15 mg z innymi lekami serotoninergicznymi, w tym tryptanami, trójpierścieniowymi lekami przeciwdepresyjnymi, fentanylem, litem, tramadolem, buspironem, tryptofanem i zielem dziurawca, jest klinicznie uzasadnione. szczególnie podczas rozpoczynania leczenia i zwiększania dawki.
Alkohol
Wykazano, że upośledzenie zdolności poznawczych i motorycznych wywoływane przez REMERON sumuje się z zaburzeniami wywoływanymi przez alkohol. W związku z tym pacjentom należy zalecić unikanie alkoholu podczas przyjmowania mirtazapiny.
Ciąża
Pacjentkom należy zalecić, aby powiadomiły lekarza, jeśli zajdą w ciążę lub zamierzają zajść w ciążę podczas leczenia preparatem REMERON.
Pielęgniarstwo
Pacjentkom należy doradzić, aby powiadomiły lekarza, jeśli karmią piersią niemowlę.
Testy laboratoryjne
Nie zaleca się rutynowych badań laboratoryjnych.
rakotwórczość, mutageneza, upośledzenie płodności
Karcynogeneza
Przeprowadzono badania rakotwórczości mirtazapiny podawanej w diecie w dawkach 2, 20 i 200 mg/kg/dobę myszom oraz 2, 20 i 60 mg/kg/dobę szczurom. Najwyższe stosowane dawki są około 20 i 12 razy większe od maksymalnej zalecanej dawki u ludzi (MRHD) wynoszącej 45 mg/dobę w przeliczeniu na mg/m² odpowiednio u myszy i szczurów. Stwierdzono zwiększoną częstość występowania gruczolaka i raka wątrobowokomórkowego u samców myszy przy wysokich dawkach. U szczurów obserwowano wzrost gruczolaka wątrobowokomórkowego u samic po podaniu średnich i wysokich dawek oraz guzów wątrobowokomórkowych i gruczolaka/torbielaka pęcherzykowego tarczycy oraz raka u samców po podaniu dużych dawek. Dane sugerują, że w powyższych skutkach mogą prawdopodobnie pośredniczyć mechanizmy niegenotoksyczne, których znaczenie dla ludzi nie jest znane.
Dawki zastosowane w badaniu na myszach mogły nie być wystarczająco wysokie, aby w pełni scharakteryzować rakotwórczy potencjał tabletek REMERON (mirtazapiny).
Mutageneza
Mirtazapina nie wykazywała działania mutagennego ani klastogennego i nie wywoływała ogólnego uszkodzenia DNA, co stwierdzono w kilku testach genotoksyczności: test Amesa, test mutacji genów in vitro w komórkach V 79 chomika chińskiego, test wymiany chromatyd siostrzanych in vitro w hodowanych limfocytach królika, in vivo szpik kostny test mikrojądrowy u szczurów oraz test nieplanowanej syntezy DNA w komórkach HeLa.
Upośledzenie płodności
W badaniu płodności u szczurów mirtazapinę podawano w dawkach do 100 mg/kg [20-krotność maksymalnej zalecanej dawki u ludzi (MRHD) w przeliczeniu na mg/m2]. Lek nie miał wpływu na kojarzenie się i poczęcie, ale cykl rujowy został zakłócony przy dawkach, które były 3 lub więcej razy większe od MRHD, a straty przed implantacją wystąpiły przy 20-krotności MRHD.
Ciąża
Efekty teratogenne
Ciąża Kategoria C
Badania reprodukcji na ciężarnych szczurach i królikach w dawkach do 100 mg/kg i 40 mg/kg [odpowiednio 20 i 17-krotność maksymalnej zalecanej dawki u ludzi (MRHD) w przeliczeniu na mg/m²] nie wykazały dowodów na działanie teratogenne. Jednak u szczurów zaobserwowano wzrost strat poimplantacyjnych u samic leczonych mirtazapiną. Nastąpił wzrost śmiertelności młodych w ciągu pierwszych 3 dni laktacji i spadek masy urodzeniowej młodych. Przyczyna tych zgonów nie jest znana. Efekty wystąpiły przy dawkach, które były 20 razy większe od MRHD, ale nie przy 3 razy większych od MRHD, w przeliczeniu na mg/m². Nie ma odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Ponieważ badania reprodukcji na zwierzętach nie zawsze pozwalają przewidzieć reakcję człowieka, lek ten powinien być stosowany w czasie ciąży tylko wtedy, gdy jest to bezwzględnie konieczne.
Matki karmiące
Ponieważ pewna ilość leku REMERON może przenikać do mleka matki, należy zachować ostrożność przy podawaniu leku REMERON (mirtazapina) w tabletkach kobietom karmiącym piersią.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność w populacji pediatrycznej nie zostały ustalone (patrz OSTRZEŻENIE W PUDEŁKU oraz OSTRZEŻENIA : Pogorszenie stanu klinicznego i ryzyko samobójstwa ). Przeprowadzono dwa kontrolowane placebo badania z udziałem 258 pacjentów pediatrycznych z MDD z zastosowaniem tabletek REMERON (mirtazapiny) i dane nie były wystarczające, aby uzasadnić twierdzenie o stosowaniu u dzieci. Każdy, kto rozważa stosowanie leku REMERON 30 mg u dzieci lub młodzieży, musi zrównoważyć potencjalne ryzyko z potrzebą kliniczną.
W trwającym 8 tygodni pediatrycznym badaniu klinicznym, w którym stosowano dawki od 15 do 45 mg/dobę, 49% pacjentów leczonych produktem REMERON odnotowało przyrost masy ciała o co najmniej 7% w porównaniu z 5,7% pacjentów otrzymujących placebo. Średni wzrost masy ciała wyniósł 4 kg (2 kg SD) u pacjentów leczonych produktem REMERON w porównaniu do 1 kg (2 kg SD) u pacjentów otrzymujących placebo (patrz ŚRODKI OSTROŻNOŚCI : Zwiększony apetyt/przyrost masy ciała ).
Zastosowanie geriatryczne
Około 190 osób w podeszłym wieku (≥ 65 lat) uczestniczyło w badaniach klinicznych z preparatem REMERON (mirtazapina) w tabletkach. Wiadomo, że lek ten jest w znacznym stopniu wydalany przez nerki (75%), a ryzyko zmniejszenia klirensu tego leku jest większe u pacjentów z zaburzeniami czynności nerek. Ponieważ pacjenci w podeszłym wieku są bardziej narażeni na zaburzenia czynności nerek, należy zachować ostrożność przy doborze dawki. Leki uspokajające mogą powodować dezorientację i nadmierną sedację u osób starszych. W tej grupie nie stwierdzono nietypowych niekorzystnych zjawisk związanych z wiekiem. Badania farmakokinetyczne wykazały zmniejszony klirens u osób starszych. Wskazana jest ostrożność przy podawaniu produktu REMERON pacjentom w podeszłym wieku (patrz: FARMAKOLOGIA KLINICZNA oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
PRZEDAWKOWAĆ
Ludzkie doświadczenie
Doświadczenia dotyczące przedawkowania leku REMERON (mirtazapina) w tabletkach są bardzo ograniczone. W badaniach klinicznych przed wprowadzeniem do obrotu odnotowano 8 zgłoszeń przedawkowania produktu REMERON w monoterapii lub w skojarzeniu z innymi środkami farmakologicznymi. Jedyny zgon związany z przedawkowaniem leku zgłoszony podczas przyjmowania leku REMERON dotyczył skojarzenia z amitryptyliną i chlorprotiksenem w badaniu klinicznym poza USA. Na podstawie stężeń w osoczu, przyjęta dawka preparatu REMERON 15 mg wynosiła od 30 do 45 mg, podczas gdy stężenie amitryptyliny i chlorprotiksenu w osoczu było toksyczne. Wszystkie inne przypadki przedawkowania przed wprowadzeniem do obrotu doprowadziły do pełnego wyzdrowienia. Objawy przedmiotowe i podmiotowe zgłaszane w związku z przedawkowaniem obejmowały dezorientację, senność, zaburzenia pamięci i tachykardię. Nie odnotowano nieprawidłowości w zapisie EKG, śpiączki ani drgawek po przedawkowaniu samego produktu REMERON.
Jednak na podstawie doniesień po wprowadzeniu produktu do obrotu istnieje możliwość poważniejszych skutków (w tym zgonów) przy dawkach znacznie wyższych niż dawka terapeutyczna, zwłaszcza w przypadku przedawkowania mieszanego. W takich przypadkach zgłaszano również wydłużenie odstępu QT i Torsades de Pointes (patrz INTERAKCJE Z LEKAMI oraz DZIAŁANIA NIEPOŻĄDANE Sekcje).
Zarządzanie przedawkowaniem
Leczenie powinno obejmować te ogólne środki stosowane w przypadku przedawkowania jakiegokolwiek leku skutecznego w leczeniu dużych zaburzeń depresyjnych. Zapewnić odpowiednie drogi oddechowe, natlenienie i wentylację. Monitoruj parametry EKG (w tym rytm serca) i parametry życiowe. Zalecane są również ogólne środki podtrzymujące i objawowe. Nie zaleca się wywoływania wymiotów. Płukanie żołądka za pomocą zgłębnika żołądkowo-jelitowego o dużej średnicy z odpowiednią ochroną dróg oddechowych, w razie potrzeby, może być wskazane, jeśli jest wykonywane wkrótce po spożyciu lub u pacjentów z objawami. Należy podać węgiel aktywowany. Brak doświadczenia w stosowaniu wymuszonej diurezy, dializy, hemoperfuzji lub transfuzji wymiennej w leczeniu przedawkowania mirtazapiny. Nie są znane żadne specyficzne antidotum na mirtazapinę.
radzeniu sobie z przedawkowaniem należy rozważyć możliwość zaangażowania wielu leków. Lekarz powinien rozważyć skontaktowanie się z centrum kontroli zatruć w celu uzyskania dodatkowych informacji na temat leczenia przedawkowania. Numery telefonów do certyfikowanych ośrodków kontroli zatruć są wymienione w Physicians' Desk Reference (PDR).
PRZECIWWSKAZANIA
Nadwrażliwość
Remeron (mirtazapina) Tabletki są przeciwwskazane u pacjentów ze stwierdzoną nadwrażliwością na mirtazapinę lub którąkolwiek substancję pomocniczą.
Inhibitory monoaminooksydazy
Stosowanie inhibitorów monoaminooksydazy (IMAO) przeznaczonych do leczenia zaburzeń psychicznych za pomocą tabletek REMERON 15 mg lub w ciągu 14 dni od zakończenia leczenia preparatem REMERON 15 mg jest przeciwwskazane ze względu na zwiększone ryzyko wystąpienia zespołu serotoninowego. Przeciwwskazane jest również stosowanie leku REMERON 15 mg w ciągu 14 dni od odstawienia MAOI przeznaczonego do leczenia zaburzeń psychicznych (patrz OSTRZEŻENIA oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
Rozpoczęcie leczenia produktem REMERON u pacjenta leczonego inhibitorami MAO, takimi jak linezolid lub dożylnie błękit metylenowy, jest również przeciwwskazane ze względu na zwiększone ryzyko wystąpienia zespołu serotoninowego (patrz OSTRZEŻENIA oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
FARMAKOLOGIA KLINICZNA
Farmakodynamika
Mechanizm działania tabletek REMERON (mirtazapiny), podobnie jak innych leków skutecznych w leczeniu dużych zaburzeń depresyjnych, jest nieznany.
Dowody zebrane w badaniach przedklinicznych sugerują, że mirtazapina zwiększa ośrodkowe działanie noradrenergiczne i serotoninergiczne. Badania te wykazały, że mirtazapina działa jako antagonista ośrodkowych presynaptycznych hamujących autoreceptorów i heteroreceptorów α2-adrenergicznych, które to działanie ma prowadzić do zwiększenia ośrodkowej aktywności noradrenergicznej i serotoninergicznej.
Mirtazapina jest silnym antagonistą receptorów 5-HT2 i 5-HT3. Mirtazapina nie wykazuje znaczącego powinowactwa do receptorów 5-HT1A i 5-HT1B.
Mirtazapina jest silnym antagonistą receptorów histaminowych (H1), co może wyjaśniać jej silne działanie uspokajające.
Mirtazapina jest umiarkowanym obwodowym antagonistą receptorów α-adrenergicznych, co może wyjaśniać sporadyczne niedociśnienie ortostatyczne zgłaszane w związku z jej stosowaniem.
Mirtazapina jest umiarkowanym antagonistą receptorów muskarynowych, co może wyjaśniać stosunkowo niską częstość występowania antycholinergicznych skutków ubocznych związanych z jej stosowaniem.
Farmakokinetyka
Tabletki REMERON (mirtazapina) są szybko i całkowicie wchłaniane po podaniu doustnym, a ich okres półtrwania wynosi około 20 do 40 godzin. Maksymalne stężenie w osoczu osiągane jest w ciągu około 2 godzin po podaniu doustnym. Obecność pokarmu w żołądku ma minimalny wpływ zarówno na szybkość, jak i stopień wchłaniania i nie wymaga dostosowania dawki.
Mirtazapina jest intensywnie metabolizowana po podaniu doustnym. Główne szlaki biotransformacji to demetylacja i hydroksylacja, po których następuje sprzęganie z glukuronidami. Dane in vitro z mikrosomów wątroby ludzkiej wskazują, że cytochrom 2D6 i 1A2 biorą udział w tworzeniu 8-hydroksy metabolitu mirtazapiny, podczas gdy cytochrom 3A uważany jest za odpowiedzialny za tworzenie metabolitu N-demetylowego i N-tlenku. Mirtazapina ma bezwzględną biodostępność około 50%. Jest wydalany głównie z moczem (75%), a 15% z kałem. Kilka nieskoniugowanych metabolitów wykazuje aktywność farmakologiczną, ale jest obecnych w osoczu w bardzo małych ilościach. (-)-enancjomer ma okres półtrwania w fazie eliminacji, który jest około dwa razy dłuższy niż enancjomer (+), a zatem osiąga stężenie w osoczu około 3 razy wyższe niż (+) enancjomer.
Poziomy w osoczu są liniowo zależne od dawki w zakresie dawek od 15 do 80 mg. Średni okres półtrwania w fazie eliminacji mirtazapiny po podaniu doustnym waha się od około 20 do 40 godzin w podgrupach wiekowych i płci, przy czym kobiety w każdym wieku wykazują znacznie dłuższe okresy półtrwania w fazie eliminacji niż mężczyźni (średni okres półtrwania 37 godzin dla kobiet w porównaniu z 26 godzinami). dla mężczyzn). Stężenia mirtazapiny w osoczu w stanie stacjonarnym są osiągane w ciągu 5 dni, z około 50% kumulacją (stosunek kumulacji = 1,5).
Mirtazapina wiąże się w około 85% z białkami osocza w zakresie stężeń od 0,01 do 10 µg/ml.
Specjalne populacje
Geriatryczny
Po doustnym podawaniu leku REMERON (mirtazapina) tabletki 20 mg/dobę przez 7 dni osobom w różnym wieku (zakres 25-74 lata), klirens mirtazapiny po podaniu doustnym był zmniejszony u osób w podeszłym wieku w porównaniu z młodszymi osobami. Różnice były najbardziej uderzające u mężczyzn, z 40% niższym klirensem u starszych mężczyzn w porównaniu z młodszymi mężczyznami, podczas gdy klirens u starszych kobiet był tylko 10% niższy w porównaniu z młodszymi kobietami. Wskazana jest ostrożność przy podawaniu produktu REMERON 30 mg pacjentom w podeszłym wieku (patrz: ŚRODKI OSTROŻNOŚCI oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
Pediatria
Nie ustalono bezpieczeństwa i skuteczności mirtazapiny w populacji pediatrycznej (patrz ŚRODKI OSTROŻNOŚCI ).
Płeć
Średni okres półtrwania w fazie eliminacji mirtazapiny po podaniu doustnym wynosi od około 20 do 40 godzin w podgrupach wiekowych i płciowych, przy czym kobiety w każdym wieku wykazują znacznie dłuższe okresy półtrwania w fazie eliminacji niż mężczyźni (średni okres półtrwania 37 godzin dla kobiet w porównaniu z 26 godzin dla mężczyzn) (patrz Farmakokinetyka ).
Wyścig
Nie przeprowadzono badań klinicznych oceniających wpływ rasy na farmakokinetykę produktu REMERON.
Niewydolność nerek
Dyspozycje mirtazapiny badano u pacjentów z różnym stopniem czynności nerek. Eliminacja mirtazapiny jest skorelowana z klirensem kreatyniny. Całkowity klirens mirtazapiny był zmniejszony o około 30% u pacjentów z umiarkowaną (Clcr=11–39 ml/min/1,73 m²) io około 50% u pacjentów z ciężką (Clcr= ŚRODKI OSTROŻNOŚCI oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
Niewydolność wątroby
Po podaniu doustnym pojedynczej dawki 15 mg produktu REMERON klirens mirtazapiny po podaniu doustnym zmniejszył się o około 30% u pacjentów z zaburzeniami czynności wątroby w porównaniu z osobami z prawidłową czynnością wątroby. Wskazana jest ostrożność przy podawaniu produktu REMERON pacjentom z zaburzeniami czynności wątroby (patrz ŚRODKI OSTROŻNOŚCI oraz DAWKOWANIE I SPOSÓB PODAWANIA ).
Badania kliniczne wykazujące skuteczność
Skuteczność leku REMERON (mirtazapina) tabletki w leczeniu dużych zaburzeń depresyjnych została potwierdzona w 4 6-tygodniowych badaniach kontrolowanych placebo u dorosłych pacjentów ambulatoryjnych spełniających kryteria dużej depresji wg DSM-III. Pacjenci otrzymywali miareczkowanie mirtazapiną w zakresie dawek od 5 mg do 35 mg/dobę. Ogólnie rzecz biorąc, badania te wykazały, że mirtazapina jest lepsza od placebo w co najmniej 3 z następujących 4 pomiarów: całkowity wynik 21-punktowej Skali Depresji Hamiltona (HDRS); Pozycja HDRS w obniżonym nastroju; wynik CGI; oraz Skala Oceny Depresji Montgomery i Asberga (MADRS). Wyższość mirtazapiny nad placebo stwierdzono również w przypadku niektórych czynników HDRS, w tym czynnika lęku/somatycznego i czynnika zaburzeń snu. Średnia dawka mirtazapiny dla pacjentów, którzy ukończyli te 4 badania, wynosiła od 21 do 32 mg/dobę. Piąte badanie o podobnym projekcie wykorzystywało wyższą dawkę (do 50 mg) na dzień i również wykazało skuteczność.
Badanie podzbiorów populacji pod względem wieku i płci nie wykazało żadnej zróżnicowanej reaktywności na podstawie tych podgrup.
W badaniu długoterminowym pacjenci spełniający (DSM-IV) kryteria rozpoznania dużej depresji, u których wystąpiła odpowiedź podczas początkowego, trwającego od 8 do 12 tygodni ostrego leczenia preparatem REMERON 30 mg, zostali losowo przydzieleni do kontynuacji leczenia preparatem REMERON 15 mg lub placebo przez okres do 40 tygodni obserwacja pod kątem nawrotu. Odpowiedź w fazie otwartej została zdefiniowana jako uzyskanie całkowitego wyniku w skali HAM-D 17 ≤ 8 i wyniku w skali CGI-Poprawa 1 lub 2 podczas 2 kolejnych wizyt rozpoczynających się w 6. tygodniu 8. do 12. tygodnia fazy otwartej. badania. Nawrót podczas fazy podwójnie ślepej próby został określony przez poszczególnych badaczy. U pacjentów, którzy kontynuowali leczenie produktem REMERON w dawce 30 mg, częstość nawrotów była istotnie mniejsza w ciągu kolejnych 40 tygodni w porównaniu z pacjentami otrzymującymi placebo. Ten wzór wykazano zarówno u pacjentów płci męskiej, jak i żeńskiej.
INFORMACJA O PACJENCIE
REMERON® (rem' - e - ron) (mirtazapina) Tabletki
Jakie są najważniejsze informacje, które powinienem wiedzieć o REMERON®?
REMERON 15 mg i inne leki przeciwdepresyjne mogą powodować poważne działania niepożądane, w tym:
1. Myśli lub działania samobójcze:
- REMERON 30 mg i inne leki przeciwdepresyjne mogą nasilać myśli lub działania samobójcze u niektórych dzieci, nastolatków lub młodych dorosłych w ciągu pierwszych kilku miesięcy leczenia lub po zmianie dawki.
- Depresja lub inne poważne choroby psychiczne są najważniejszymi przyczynami myśli lub działań samobójczych.
- Zwróć uwagę na te zmiany i natychmiast skontaktuj się z lekarzem, jeśli zauważysz:
- Nowe lub nagłe zmiany nastroju, zachowania, działań, myśli lub uczuć, zwłaszcza jeśli są poważne.
- Należy zwrócić szczególną uwagę na takie zmiany przy uruchamianiu REMERON lub przy zmianie dawki.
Zachowaj wszystkie wizyty kontrolne u swojego lekarza i dzwoń między wizytami, jeśli obawiasz się objawów.
Zadzwoń do swojego lekarza natychmiast, jeśli masz którykolwiek z poniższych objawów, lub zadzwoń pod numer 911 w nagłych wypadkach, zwłaszcza jeśli są nowe, gorsze lub martwią Cię:
- próby popełnienia samobójstwa
- działając na niebezpieczne impulsy
- zachowywanie się agresywnie lub agresywnie
- myśli o samobójstwie lub śmierci
- nowa lub gorsza depresja
- nowy lub gorszy lęk lub ataki paniki
- uczucie pobudzenia, niepokoju, złości lub poirytowania
- problemy ze snem
- wzrost aktywności lub mówienie więcej niż to, co jest dla Ciebie normalne
- inne nietypowe zmiany w zachowaniu lub nastroju
Zadzwoń do swojego lekarza natychmiast, jeśli wystąpi którykolwiek z poniższych objawów, lub zadzwoń pod numer 911 w nagłych wypadkach. REMERON może być związany z następującymi poważnymi działaniami niepożądanymi :
2. Epizody maniakalne:
- znacznie zwiększona energia
- lekkomyślne zachowanie
- mówisz więcej lub szybciej niż zwykle
- poważne problemy ze snem
- niezwykle wielkie pomysły
- wyścigi myśli
- nadmierne szczęście lub drażliwość
3. Zmniejszona liczba białych krwinek zwane neutrofilami, które są potrzebne do zwalczania infekcji. Należy poinformować lekarza, jeśli wystąpią jakiekolwiek oznaki infekcji, takie jak gorączka, dreszcze, ból gardła lub owrzodzenie jamy ustnej lub nosa, zwłaszcza objawy grypopodobne.
4. Zespół serotoninowy. Ten stan może zagrażać życiu i może obejmować:
- pobudzenie, halucynacje, śpiączka lub inne zmiany stanu psychicznego
- przyspieszone bicie serca, wysokie lub niskie ciśnienie krwi
- nudności, wymioty lub biegunka
- problemy z koordynacją lub drgania mięśni (nadmierne odruchy)
- pocenie się lub gorączka
- sztywność mięśni
5. Problemy ze wzrokiem
- ból oka
- zmiany w wizji
- obrzęk lub zaczerwienienie w oku lub wokół niego
Tylko niektórzy ludzie są narażeni na te problemy. Możesz chcieć przejść badanie wzroku, aby sprawdzić, czy jesteś zagrożony i otrzymać leczenie zapobiegawcze, jeśli tak.
6. Napady padaczkowe
7. Niski poziom soli (sodu) we krwi.
Osoby starsze mogą być na to bardziej narażone. Objawy mogą obejmować:
- ból głowy
- splątanie, problemy z koncentracją, myślenie lub problemy z pamięcią
- słabość lub niepewność
8. Senność. Najlepiej wziąć REMERON blisko przed snem.
9. Ciężkie reakcje skórne: Zadzwoń do lekarza natychmiast, jeśli wystąpi którykolwiek lub wszystkie z następujących objawów:
- ciężka wysypka z obrzękiem skóry (w tym na dłoniach i podeszwach stóp)
- bolesne zaczerwienienie skóry, pęcherze lub owrzodzenia na ciele lub w jamie ustnej
10. Ciężkie reakcje alergiczne: problemy z oddychaniem, obrzęk twarzy, języka, oczu lub ust
- wysypka, swędzące pręgi (pokrzywka) lub pęcherze, samodzielnie lub z gorączką lub bólem stawów
11. Wzrost apetytu lub wagi. Podczas leczenia dzieci i młodzież należy monitorować wzrost i wagę.
12. Podwyższony poziom cholesterolu i trójglicerydów we krwi
Nie należy przerywać leku REMERON 15 mg bez uprzedniej rozmowy z lekarzem. Zbyt szybkie odstawienie leku REMERON 15mg może spowodować potencjalnie poważne objawy, w tym:
- zawroty głowy
- zmęczenie
- mrowienie
- nienormalne sny
- dezorientacja
- nudności wymioty
- podniecenie
- ból głowy
- wyzysk
- lęk
- drżący
Co to jest REMERON 15mg?
REMERON 15mg to lek na receptę stosowany w leczeniu depresji. Ważne jest, aby porozmawiać z lekarzem o ryzyku związanym z leczeniem depresji, a także o ryzyku nieleczenia jej. Powinieneś omówić wszystkie opcje leczenia z lekarzem.
Porozmawiaj ze swoim lekarzem, jeśli uważasz, że Twój stan zdrowia nie poprawia się po leczeniu REMERON.
Kto nie powinien brać REMERON 15mg?
Nie stosować leku REMERON:
- jeśli pacjent ma uczulenie na mirtazapinę lub którykolwiek ze składników leku REMERON. Pełna lista składników preparatu REMERON znajduje się na końcu niniejszego Przewodnika po lekach.
- jeśli pacjent przyjmuje inhibitor monoaminooksydazy (IMAO). Zapytaj swojego lekarza lub farmaceutę, jeśli nie jesteś pewien, czy przyjmujesz IMAO, w tym antybiotyk linezolid.
- Nie należy przyjmować IMAO w ciągu 2 tygodni od odstawienia leku REMERON, chyba że zaleci to lekarz.
- Nie należy rozpoczynać stosowania leku REMERON, jeśli w ciągu ostatnich 2 tygodni przestałeś przyjmować IMAO, chyba że zalecił to lekarz.
Osoby, które przyjmują REMERON 15 mg w czasie zbliżonym do MAOI, mogą mieć poważne, a nawet zagrażające życiu skutki uboczne. Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z tych objawów:
- wysoka gorączka
- gwałtowne zmiany częstości akcji serca lub ciśnienia krwi
- niekontrolowane skurcze mięśni
- dezorientacja
- sztywne mięśnie
- utrata przytomności (omdlenie)
O czym powinienem powiedzieć lekarzowi przed zażyciem leku REMERON?
Przed przyjęciem leku REMERON należy poinformować lekarza o wszystkich swoich schorzeniach, w tym o:
- zażywają pewne leki, takie jak:
- Tryptany stosowane w leczeniu migrenowego bólu głowy
- Leki stosowane w leczeniu nastroju, lęku, zaburzeń psychotycznych lub zaburzeń myślenia, w tym trójpierścieniowe, lit, SSRI, SNRI lub leki przeciwpsychotyczne
- Tramadol stosowany w leczeniu bólu
- Suplementy dostępne bez recepty, takie jak tryptofan lub ziele dziurawca
- Fenytoina, karbamazepina lub ryfampicyna (leki te mogą obniżać poziom leku REMERON we krwi)
- Cymetydyna lub ketokonazol (leki te mogą zwiększać stężenie leku REMERON we krwi)
- Leki, które mogą wpływać na rytm serca (takie jak niektóre antybiotyki i niektóre leki przeciwpsychotyczne)
- masz lub miał:
- problemy z wątrobą
- problemy z nerkami
- problemy z sercem lub pewne stany, które mogą zmienić rytm serca
- drgawki lub konwulsje
- zaburzenie dwubiegunowe lub mania
- skłonność do zawrotów głowy lub omdlenia
- są w ciąży lub planują zajść w ciążę. Nie wiadomo, czy REMERON zaszkodzi nienarodzonemu dziecku. Porozmawiaj ze swoim lekarzem o korzyściach i zagrożeniach związanych z leczeniem depresji podczas ciąży
- karmisz piersią lub planujesz karmić piersią. Niektóre leki REMERON mogą przenikać do mleka matki. Porozmawiaj z lekarzem o tym, jak najlepiej karmić dziecko podczas przyjmowania leku REMERON
Poinformuj swojego lekarza o wszystkich przyjmowanych lekach, w tym leki na receptę i bez recepty, witaminy i suplementy ziołowe. REMERON i niektóre leki mogą wchodzić ze sobą w interakcje, mogą nie działać tak dobrze lub mogą powodować poważne działania niepożądane.
Lekarz lub farmaceuta może powiedzieć, czy przyjmowanie leku REMERON 15 mg z innymi lekami jest bezpieczne. Nie należy rozpoczynać ani przerywać przyjmowania jakichkolwiek leków podczas przyjmowania leku REMERON bez uprzedniej konsultacji z lekarzem. W przypadku przyjmowania leku REMERON 30 mg nie należy przyjmować innych leków zawierających mirtazapinę, w tym leku REMERON 30 mg SolTab®.
Jak przyjmować REMERON?
- Lek REMERON należy przyjmować dokładnie zgodnie z zaleceniami. Lekarz może zmienić dawkę leku REMERON 15 mg, aż będzie to dawka właściwa dla pacjenta.
- Lek REMERON należy przyjmować codziennie o tej samej porze, najlepiej wieczorem przed snem.
- Połknąć REMERON 15 mg zgodnie z zaleceniami.
- Często zdarza się, że leki przeciwdepresyjne, takie jak REMERON, potrzebują nawet kilku tygodni, zanim poczujesz się lepiej. Nie należy przerywać stosowania leku REMERON 15 mg, jeśli od razu nie odczuwa się rezultatów.
- Nie należy przerywać przyjmowania ani zmieniać dawki leku REMERON 15 mg bez uprzedniej konsultacji z lekarzem, nawet w przypadku poprawy samopoczucia.
- REMERON można przyjmować z posiłkiem lub bez posiłku.
- W przypadku pominięcia dawki leku REMERON 30 mg, należy przyjąć pominiętą dawkę, gdy tylko sobie o tym przypomni. Jeśli zbliża się pora przyjęcia następnej dawki, pomiń pominiętą dawkę i weź kolejną dawkę o zwykłej porze. Nie należy przyjmować jednocześnie dwóch dawek leku REMERON 15 mg.
- W przypadku zażycia zbyt dużej dawki leku REMERON 15 mg, natychmiast zadzwoń do swojego lekarza lub centrum kontroli zatruć lub skorzystaj z pomocy w nagłych wypadkach. Do objawów przedawkowania leku REMERON (bez innych leków i bez alkoholu) należą:
- dezorientacja,
- problemy z pamięcią
- senność
- zwiększone tętno.
Objawy możliwego przedawkowania mogą obejmować zmiany rytmu serca (szybkie, nieregularne bicie serca) lub omdlenia, które mogą być objawami stanu zagrażającego życiu, znanego jako Torsades de Pointes.
Czego powinienem unikać stosując REMERON 15mg?
- REMERON może powodować senność lub wpływać na zdolność podejmowania decyzji, jasnego myślenia lub szybkiego reagowania. Nie należy prowadzić pojazdów, obsługiwać ciężkich maszyn ani wykonywać innych niebezpiecznych czynności, dopóki nie dowiesz się, jak wpływa na Ciebie REMERON.
- Podczas przyjmowania leku REMERON należy unikać picia alkoholu, przyjmowania diazepamu (lek stosowany na przykład w stanach lękowych, bezsenności i napadów padaczkowych) lub podobnych leków. Jeśli nie masz pewności, czy niektóre leki mogą być przyjmowane z REMERON 30mg, porozmawiaj z lekarzem.
Jakie są możliwe skutki uboczne stosowania preparatu REMERON?
REMERON może powodować poważne skutki uboczne:
- Zobacz „Jakie są najważniejsze informacje, które powinienem wiedzieć o REMERON?”
Do najczęstszych działań niepożądanych leku REMERON należą:
- senność
- zaparcie
- zwiększony apetyt
- zawroty głowy
- przybranie na wadze
- suchość w ustach nienormalne sny
To nie wszystkie możliwe skutki uboczne stosowania preparatu REMERON.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Jak przechowywać REMERON?
- Przechowywać REMERON 15mg w temperaturze pokojowej między 68 ° F do 77 ° F (20 ° C do 25 ° C).
- Trzymaj REMERON 15 mg z dala od światła.
- Butelkę REMERON 30 mg przechowywać szczelnie zamkniętą.
Lek REMERON 30 mg i wszystkie leki należy przechowywać w miejscu niedostępnym dla dzieci.
Ogólne informacje o bezpiecznym i efektywnym stosowaniu REMERON.
Leki są czasami przepisywane do celów innych niż wymienione w Przewodniku po lekach. Nie należy stosować leku REMERON 15 mg w stanach, na które nie został przepisany. Nie należy podawać leku REMERON innym osobom, nawet jeśli mają takie same objawy jak Ty. Może im to zaszkodzić. O informacje na temat leku REMERON 30 mg przeznaczonego dla pracowników służby zdrowia można zapytać farmaceutę lub lekarza.
Jakie są składniki preparatu REMERON 15mg?
Składnik czynny: mirtazapina
Nieaktywne składniki :
- Tabletki 15 mg : Skrobia (kukurydza), hydroksypropyloceluloza, stearynian magnezu, koloidalny dwutlenek krzemu, laktoza, hypromeloza, glikol polietylenowy 8000, dwutlenek tytanu, tlenek żelaza (żółty).
- Tabletki 30 mg : Skrobia (kukurydziana), hydroksypropyloceluloza, stearynian magnezu, koloidalny dwutlenek krzemu, laktoza, hypromeloza, glikol polietylenowy 8000, dwutlenek tytanu, tlenek żelaza (żółty), tlenek żelaza (czerwony).
- Tabletki 45 mg : Skrobia (kukurydza), hydroksypropyloceluloza, stearynian magnezu, koloidalny dwutlenek krzemu, laktoza, hypromeloza, glikol polietylenowy 8000, dwutlenek tytanu.
