Feldene 10mg, 20mg Piroxicam Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Feldene 20mg i jak się go stosuje?
Piroxicam jest lekiem na receptę stosowanym w leczeniu bólu lub zapalenia reumatoidalnego zapalenia stawów (w tym młodzieńczego zapalenia stawów) lub choroby zwyrodnieniowej stawów. Piroxicam można stosować samodzielnie lub z innymi lekami.
Piroksykam jest niesteroidowym lekiem przeciwzapalnym (NLPZ).
Nie wiadomo, czy Piroxicam jest bezpieczny i skuteczny u dzieci w wieku poniżej 12 lat.
Jakie są możliwe skutki uboczne Feldene?
Feldene 10mg może powodować poważne skutki uboczne, w tym:
- stukanie w szyję lub uszy,
- senność,
- rozmazany obraz,
- obrzęk,
- szybki przyrost masy ciała,
- duszność,
- utrata apetytu,
- ból brzucha,
- zmęczenie,
- swędzący,
- ciemny mocz ,
- stołki w kolorze gliny,
- zażółcenie skóry lub oczu (żółtaczka),
- krwawe lub smoliste stolce,
- odkrztuszanie krwi lub wymiocin wyglądających jak fusy z kawy,
- małe lub brak oddawania moczu,
- obrzęk stóp lub kostek,
- uczucie oszołomienia,
- zimne dłonie lub stopy,
- blada skóra i
- silny ból głowy,
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Feldene to:
- nieprawidłowe wyniki testów czynności wątroby,
- trudności z oddawaniem moczu,
- rozstrój żołądka,
- zgaga,
- utrata apetytu,
- ból brzucha,
- mdłości,
- wymioty,
- gaz,
- biegunka ,
- zaparcie,
- zawroty głowy,
- ból głowy,
- swędzenie lub wysypka i
- dzwonienie w uszach,
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Feldene. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OSTRZEŻENIE
RYZYKO POWAŻNYCH ZDARZEŃ SERCOWO-NACZYNIOWYCH I PRZEWODOWYCH
Zdarzenia zakrzepowo-sercowe
- Niesteroidowe leki przeciwzapalne (NLPZ) zwiększają ryzyko poważnych incydentów zakrzepowych układu krążenia, w tym zawału mięśnia sercowego i udaru mózgu, które mogą być śmiertelne. Ryzyko to może wystąpić na początku leczenia i może wzrastać wraz z czasem stosowania. [Widzieć OSTRZEŻENIA I ŚRODKI ].
- FELDENE 20mg jest przeciwwskazany w przypadku operacji pomostowania aortalno-wieńcowego (CABG) [patrz PRZECIWWSKAZANIA oraz OSTRZEŻENIA I ŚRODKI ].
Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja
- NLPZ powodują zwiększone ryzyko poważnych działań niepożądanych ze strony przewodu pokarmowego (GI), w tym krwawienia, owrzodzenia i perforacji żołądka lub jelit, które mogą być śmiertelne. Zdarzenia te mogą wystąpić w dowolnym momencie podczas użytkowania i bez objawów ostrzegawczych. Pacjenci w podeszłym wieku oraz pacjenci z chorobą wrzodową w wywiadzie i/lub krwawieniem z przewodu pokarmowego są bardziej narażeni na poważne zdarzenia dotyczące przewodu pokarmowego [patrz OSTRZEŻENIA I ŚRODKI ].
OPIS
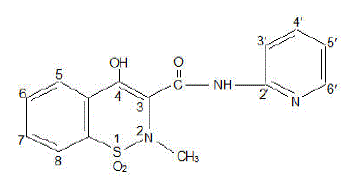
Kapsułka FELDENE (piroksykam) jest niesteroidowym lekiem przeciwzapalnym, dostępnym w postaci bordowych i niebieskich kapsułek 10 mg #322 oraz bordowych kapsułek 20 mg #323 do podawania doustnego. Nazwa chemiczna to 1,1-ditlenek 4-hydroksylo-2-metylo-N-2-pirydynylo-2H-1,2,-benzotiazyno-3-karboksyamidu. Masa cząsteczkowa wynosi 331,35. Jego wzór cząsteczkowy to C15H13N3O4S i ma następującą strukturę chemiczną.
Piroksykam występuje w postaci białego, krystalicznego ciała stałego, słabo rozpuszczalnego w wodzie, rozcieńczonym kwasie i większości rozpuszczalników organicznych. Jest słabo rozpuszczalny w alkoholu i roztworach wodnych. Wykazuje słabo kwaśny 4-hydroksyproton (pKa 5,1) i słabo zasadowy azot pirydylowy (pKa 1,8).
Składniki nieaktywne w FELDENE 10mg to: Blue 1, Red 3, laktoza, stearynian magnezu, laurylosiarczan sodu, skrobia.
WSKAZANIA
FELDENE jest wskazany:
- Do łagodzenia oznak i objawów choroby zwyrodnieniowej stawów.
- Do łagodzenia oznak i objawów reumatoidalnego zapalenia stawów.
DAWKOWANIE I SPOSÓB PODAWANIA
Przed podjęciem decyzji o zastosowaniu produktu FELDENE należy dokładnie rozważyć potencjalne korzyści i ryzyko związane ze stosowaniem leku FELDENE 20 mg i innymi opcjami leczenia. Stosuj najniższą skuteczną dawkę przez najkrótszy czas, zgodnie z indywidualnymi celami leczenia pacjenta [patrz OSTRZEŻENIA I ŚRODKI ].
Po zaobserwowaniu odpowiedzi na początkowe leczenie preparatem FELDENE 20 mg, dawkę i częstotliwość należy dostosować do indywidualnych potrzeb pacjenta.
celu złagodzenia reumatoidalnego zapalenia stawów i choroby zwyrodnieniowej stawów dawka wynosi 20 mg podawana doustnie raz dziennie. W razie potrzeby dawkę dzienną można podzielić. Ze względu na długi okres półtrwania produktu FELDENE stężenie we krwi w stanie stacjonarnym nie jest osiągane przez 7-12 dni. Dlatego też, chociaż efekty terapeutyczne FELDENE są widoczne na wczesnym etapie leczenia, reakcja na leczenie postępuje w ciągu kilku tygodni, a efekt terapii nie powinien być oceniany przez dwa tygodnie.
JAK DOSTARCZONE
Formy dawkowania i mocne strony
FELDENE (piroksykam) Kapsułki
10 mg bordowy i niebieski #322 20 mg bordowy #323
Składowania i stosowania
FELDENE® (piroksykam) 10 mg kapsułki są bordowe i niebieskie #322, dostarczane jako:
FELDENE® (piroksykam) 20 mg kapsułki są bordowe #323, dostarczane jako:
Magazynowanie
Przechowywać w temperaturze pokojowej 20°C do 25°C (68°F do 77°F); dopuszczalne odchylenia od 15°C do 30°C (59°F do 86°F) [patrz Kontrolowana temperatura pokojowa USP].
Dystrybutor: Pfizer Labs, Division of Pfizer Inc., 235 East 42nd Street, Nowy Jork, NY 10017. Aktualizacja: kwiecień 2017 r.
SKUTKI UBOCZNE
Następujące działania niepożądane omówiono bardziej szczegółowo w innych punktach oznakowania:
- Sercowo-naczyniowe zdarzenia zakrzepowe [patrz OSTRZEŻENIA I ŚRODKI ]
- Krwawienie, owrzodzenie i perforacja przewodu pokarmowego [patrz OSTRZEŻENIA I ŚRODKI ]
- Hepatotoksyczność [patrz OSTRZEŻENIA I ŚRODKI ]
- Nadciśnienie [patrz OSTRZEŻENIA I ŚRODKI ]
- Niewydolność serca i obrzęk [patrz OSTRZEŻENIA I ŚRODKI ]
- Toksyczność nerek i hiperkaliemia [patrz OSTRZEŻENIA I ŚRODKI ]
- Reakcje anafilaktyczne [patrz OSTRZEŻENIA I ŚRODKI ]
- Poważne reakcje skórne [patrz OSTRZEŻENIA I ŚRODKI ]
- Toksyczność hematologiczna [patrz OSTRZEŻENIA I ŚRODKI ]
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
U pacjentów przyjmujących FELDENE 10 mg lub inne NLPZ najczęściej zgłaszanymi działaniami niepożądanymi występującymi u około 1–10% pacjentów są:
Układu sercowo-naczyniowego: Obrzęk
Układ trawienny: Anoreksja, ból brzucha, zaparcia, biegunka, wzdęcia, nudności, wymioty
System nerwowy : Zawroty głowy, ból głowy, zawroty głowy
Skóra i przydatki: świąd, wysypka
Zmysły specjalne: szum w uszach
Dodatkowe zdarzenia niepożądane zgłaszane sporadycznie obejmują:
Układu sercowo-naczyniowego: Kołatanie serca
Układ trawienny: Zapalenie jamy ustnej
System nerwowy: Senność
Zmysły specjalne: Rozmazany obraz
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane podczas stosowania produktu FELDENE po dopuszczeniu do obrotu. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek.
Ciało jako całość: Gorączka, infekcja, posocznica, reakcje anafilaktyczne, zmiany apetytu, śmierć, zespół grypopodobny, ból (kolka), choroba posurowicza
Układu sercowo-naczyniowego: Zastoinowa niewydolność serca, nadciśnienie, tachykardia, omdlenie, arytmia, zaostrzenie dusznicy bolesnej, niedociśnienie, zawał mięśnia sercowego, zapalenie naczyń
Układ trawienny: Niestrawność, podwyższona aktywność enzymów wątrobowych, duże krwawienie/perforacja, zgaga, wrzody (żołądka/dwunastnicy), suchość błony śluzowej jamy ustnej, zapalenie przełyku, zapalenie żołądka, zapalenie języka, krwawe wymioty, zapalenie wątroby, żółtaczka, smoliste stolce, krwawienie z odbytu, odbijanie się, niewydolność wątroby, zapalenie trzustki
Układ hemiczny i limfatyczny: niedokrwistość, wydłużony czas krwawienia, mi chymoza, eozynofilia, krwawienie z nosa, leukopenia, plamica, wysypka wybroczynowa, małopłytkowość, agranulocytoza, niedokrwistość hemolityczna, niedokrwistość aplastyczna, powiększenie węzłów chłonnych, pancytopenia
Nadwrażliwość: Pozytywna ANA
Metaboliczne i odżywcze: Zmiany masy ciała, zatrzymanie płynów, hiperglikemia, hipoglikemia
System nerwowy: Lęk, osłabienie, splątanie, depresja, zaburzenia snu, bezsenność, złe samopoczucie, nerwowość, parestezje, senność, drżenie, akatyzja, drgawki, śpiączka, omamy, zapalenie opon mózgowych, zmiany nastroju
Układ oddechowy: Astma, duszność, depresja oddechowa, zapalenie płuc
Skóra i przydatki: Łysienie, siniaki, łuszczenie, rumień, nadwrażliwość na światło, pot, obrzęk naczynioruchowy, toksyczna martwica naskórka, rumień wielopostaciowy, złuszczające zapalenie skóry, onycholiza, zespół Stevensa Johnsona, pokrzywka, reakcja pęcherzykowo-pęcherzykowa
Zmysły specjalne: Zapalenie spojówek, upośledzenie słuchu, obrzęk oczu
Układ moczowo-płciowy: zaburzenia czynności nerek, c zapalenie pęcherza moczowego, bolesne oddawanie moczu, krwiomocz, hiperkaliemia, śródmiąższowe zapalenie nerek, zespół nerczycowy, skąpomocz/wielomocz, białkomocz, niewydolność nerek, kłębuszkowe zapalenie nerek
Zaburzenia układu rozrodczego i piersi: Zmniejszona płodność kobiet
INTERAKCJE Z LEKAMI
W Tabeli 1 przedstawiono klinicznie istotne interakcje leków z piroksykamem.
OSTRZEŻENIA
Zawarte jako część "ŚRODKI OSTROŻNOŚCI" Sekcja
ŚRODKI OSTROŻNOŚCI
Zdarzenia zakrzepowo-sercowe
Badania kliniczne kilku selektywnych i nieselektywnych NLPZ COX-2 trwające do trzech lat wykazały zwiększone ryzyko poważnych zakrzepowych zdarzeń sercowo-naczyniowych (CV), w tym zawału mięśnia sercowego (MI) i udaru mózgu, które mogą być śmiertelne. Na podstawie dostępnych danych nie jest jasne, czy ryzyko wystąpienia incydentów zakrzepowych w układzie sercowo-naczyniowym jest podobne w przypadku wszystkich NLPZ. Względny wzrost częstości występowania poważnych incydentów zakrzepowych w układzie sercowo-naczyniowym w porównaniu z wartościami wyjściowymi spowodowany stosowaniem NLPZ wydaje się być podobny u osób z rozpoznaną chorobą sercowo-naczyniową lub czynnikami ryzyka choroby sercowo-naczyniowej lub bez nich. Jednak pacjenci z rozpoznaną chorobą sercowo-naczyniową lub czynnikami ryzyka mieli większą bezwzględną częstość występowania poważnych incydentów zakrzepowych sercowo-naczyniowych ze względu na ich zwiększoną wyjściową częstość występowania. Niektóre badania obserwacyjne wykazały, że to zwiększone ryzyko poważnych incydentów zakrzepowych układu sercowo-naczyniowego rozpoczęło się już w pierwszych tygodniach leczenia. Wzrost ryzyka zakrzepicy sercowo-naczyniowej był najbardziej konsekwentnie obserwowany przy wyższych dawkach.
Aby zminimalizować potencjalne ryzyko wystąpienia niepożądanego zdarzenia sercowo-naczyniowego u pacjentów leczonych NLPZ, należy stosować najniższą skuteczną dawkę przez możliwie najkrótszy czas. Lekarze i pacjenci powinni zachować czujność na rozwój takich zdarzeń przez cały cykl leczenia, nawet przy braku wcześniejszych objawów sercowo-naczyniowych. Pacjentów należy poinformować o objawach poważnych zdarzeń sercowo-naczyniowych oraz o krokach, jakie należy podjąć w przypadku ich wystąpienia.
Nie ma spójnych dowodów na to, że jednoczesne stosowanie aspiryny łagodzi zwiększone ryzyko poważnych incydentów zakrzepicy sercowo-naczyniowej związane ze stosowaniem NLPZ. Jednoczesne stosowanie aspiryny i NLPZ, takich jak piroksykam, zwiększa ryzyko poważnych zdarzeń żołądkowo-jelitowych (GI) [patrz Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja ].
Stan po zabiegu pomostowania tętnic wieńcowych (CABG)
Dwa duże, kontrolowane badania kliniczne NLPZ selektywnego wobec COX-2 w leczeniu bólu w ciągu pierwszych 10–14 dni po operacji CABG wykazały zwiększoną częstość występowania zawału mięśnia sercowego i udaru mózgu. NLPZ są przeciwwskazane w CABG [patrz PRZECIWWSKAZANIA ].
Pacjenci po MI
Badania obserwacyjne przeprowadzone w Duńskim Krajowym Rejestrze wykazały, że pacjenci leczeni NLPZ w okresie po MI byli narażeni na zwiększone ryzyko ponownego zawału, zgonów z przyczyn sercowo-naczyniowych i śmiertelności z jakiejkolwiek przyczyny, począwszy od pierwszego tygodnia leczenia. W tej samej kohorcie częstość zgonów w pierwszym roku po MI wynosiła 20 na 100 osobolat u pacjentów leczonych NLPZ w porównaniu z 12 na 100 osobolat u pacjentów nie narażonych na NLPZ. Chociaż bezwzględny wskaźnik zgonów zmniejszył się nieco po pierwszym roku po MI, zwiększone względne ryzyko zgonu u osób stosujących NLPZ utrzymywało się przez co najmniej kolejne cztery lata obserwacji.
Należy unikać stosowania produktu FELDENE 10 mg u pacjentów po niedawno przebytym zawale serca, chyba że spodziewane korzyści przewyższają ryzyko nawrotów zakrzepicy sercowo-naczyniowej. Jeśli FELDENE jest stosowany u pacjentów po niedawno przebytym MI, należy monitorować pacjentów pod kątem objawów niedokrwienia serca.
Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja
NLPZ, w tym FELDENE, powodują poważne działania niepożądane ze strony przewodu pokarmowego (GI), w tym zapalenie, krwawienie, owrzodzenie i perforację przełyku, żołądka, jelita cienkiego lub grubego, które mogą być śmiertelne. Te poważne zdarzenia niepożądane mogą wystąpić w dowolnym momencie, z objawami ostrzegawczymi lub bez, u pacjentów leczonych NLPZ. Tylko jeden na pięciu pacjentów, u których wystąpiło poważne zdarzenie niepożądane w górnym odcinku przewodu pokarmowego podczas leczenia NLPZ, ma charakter objawowy. Owrzodzenia górnego odcinka przewodu pokarmowego, duże krwawienia lub perforacje spowodowane przez NLPZ wystąpiły u około 1% pacjentów leczonych przez 3–6 miesięcy i u około 2%–4% pacjentów leczonych przez rok. Jednak nawet krótkotrwała terapia NLPZ nie jest pozbawiona ryzyka.
Czynniki ryzyka krwawienia z przewodu pokarmowego, owrzodzeń i perforacji
Pacjenci z chorobą wrzodową w wywiadzie i/lub krwawieniem z przewodu pokarmowego, którzy stosowali NLPZ, mieli ponad 10-krotnie większe ryzyko wystąpienia krwawienia z przewodu pokarmowego w porównaniu z pacjentami bez tych czynników ryzyka. Inne czynniki zwiększające ryzyko krwawienia z przewodu pokarmowego u pacjentów leczonych NLPZ obejmują dłuższy czas leczenia NLPZ; jednoczesne stosowanie doustnych kortykosteroidów, aspiryny, antykoagulantów lub selektywnych inhibitorów wychwytu zwrotnego serotoniny (SSRI); palenie; używanie alkoholu; starszy wiek; i zły ogólny stan zdrowia. Większość zgłoszeń po wprowadzeniu do obrotu śmiertelnych zdarzeń ze strony przewodu pokarmowego dotyczyła pacjentów w podeszłym wieku lub osłabionych. Ponadto pacjenci z zaawansowaną chorobą wątroby i/lub koagulopatią są narażeni na zwiększone ryzyko krwawienia z przewodu pokarmowego.
Strategie minimalizacji ryzyka przewodu pokarmowego u pacjentów leczonych NLPZ
- Użyj najniższej skutecznej dawki przez możliwie najkrótszy czas.
- Unikaj jednoczesnego podawania więcej niż jednego NLPZ.
- Należy unikać stosowania u pacjentów z grupy podwyższonego ryzyka, chyba że spodziewane korzyści przewyższają zwiększone ryzyko krwawienia. W przypadku takich pacjentów, a także tych z aktywnym krwawieniem z przewodu pokarmowego, należy rozważyć alternatywne terapie inne niż NLPZ.
- Zachowaj czujność na oznaki i objawy owrzodzenia przewodu pokarmowego i krwawienia podczas leczenia NLPZ.
- przypadku podejrzenia poważnego zdarzenia niepożądanego ze strony przewodu pokarmowego należy niezwłocznie rozpocząć ocenę i leczenie, a następnie odstawić produkt FELDENE do czasu wykluczenia poważnego zdarzenia niepożądanego ze strony przewodu pokarmowego.
- W przypadku jednoczesnego stosowania małej dawki aspiryny w profilaktyce kardiologicznej należy uważniej monitorować pacjentów pod kątem krwawienia z przewodu pokarmowego [patrz INTERAKCJE Z LEKAMI ].
Hepatotoksyczność
W badaniach klinicznych u około 1% pacjentów leczonych NLPZ zgłaszano zwiększenie aktywności AlAT lub AspAT (trzy lub więcej razy powyżej górnej granicy normy [GGN]). Ponadto zgłaszano rzadkie, czasami śmiertelne przypadki ciężkiego uszkodzenia wątroby, w tym piorunującego zapalenia wątroby, martwicy wątroby i niewydolności wątroby.
Podwyższenie aktywności AlAT lub AspAT (mniej niż trzykrotność GGN) może wystąpić nawet u 15% pacjentów leczonych NLPZ, w tym piroksykamem.
Należy poinformować pacjentów o oznakach i objawach ostrzegawczych hepatotoksyczności (np. nudności, zmęczenie, letarg, biegunka, świąd, żółtaczka, tkliwość w prawym górnym kwadrancie i objawy grypopodobne). Jeśli pojawią się objawy kliniczne wskazujące na chorobę wątroby lub jeśli wystąpią objawy ogólnoustrojowe (np. eozynofilia, wysypka itp.), należy natychmiast przerwać leczenie produktem FELDENE i przeprowadzić ocenę kliniczną pacjenta.
Nadciśnienie
NLPZ, w tym FELDENE, mogą prowadzić do nowego wystąpienia nadciśnienia lub pogorszenia istniejącego nadciśnienia, co może przyczynić się do zwiększonej częstości występowania incydentów sercowo-naczyniowych. Pacjenci przyjmujący inhibitory konwertazy angiotensyny (ACE), diuretyki tiazydowe lub diuretyki pętlowe mogą mieć osłabioną odpowiedź na te terapie podczas przyjmowania NLPZ [patrz INTERAKCJE Z LEKAMI ].
Monitorować ciśnienie krwi (BP) podczas rozpoczynania leczenia NLPZ oraz w trakcie leczenia.
Niewydolność serca i obrzęk
Metaanaliza randomizowanych badań kontrolowanych Coxib and traditional NSAID Trialists' Collaboration wykazała około dwukrotny wzrost liczby hospitalizacji z powodu niewydolności serca u pacjentów leczonych selektywnie COX-2 i nieselektywnych NLPZ w porównaniu z pacjentami otrzymującymi placebo. W badaniu duńskiego krajowego rejestru pacjentów z niewydolnością serca stosowanie NLPZ zwiększało ryzyko zawału serca, hospitalizacji z powodu niewydolności serca i zgonu.
Ponadto u niektórych pacjentów leczonych NLPZ obserwowano zatrzymanie płynów i obrzęki. Stosowanie piroksykamu może osłabić wpływ na CV kilku środków terapeutycznych stosowanych w leczeniu tych schorzeń (np. diuretyków, inhibitorów ACE lub blokerów receptora angiotensyny [ARB]) [patrz INTERAKCJE Z LEKAMI ].
Należy unikać stosowania leku FELDENE 10 mg u pacjentów z ciężką niewydolnością serca, chyba że spodziewane korzyści przewyższają ryzyko pogorszenia niewydolności serca. Jeśli FELDENE jest stosowany u pacjentów z ciężką niewydolnością serca, należy monitorować pacjentów pod kątem objawów pogorszenia niewydolności serca.
Toksyczność nerek i hiperkaliemia
Toksyczność nerek
Długotrwałe podawanie NLPZ spowodowało martwicę brodawek nerkowych i inne uszkodzenie nerek.
Toksyczny wpływ na nerki obserwowano również u pacjentów, u których prostaglandyny nerkowe pełnią funkcję kompensacyjną w utrzymaniu perfuzji nerek. U tych pacjentów podawanie NLPZ może powodować zależne od dawki zmniejszenie wytwarzania prostaglandyn i, wtórnie, nerkowego przepływu krwi, co może przyspieszyć jawną dekompensację nerek. Największe ryzyko wystąpienia tej reakcji to pacjenci z zaburzeniami czynności nerek, odwodnieniem, hipowolemią, niewydolnością serca, zaburzeniami czynności wątroby, przyjmujący leki moczopędne i inhibitory ACE lub ARB oraz osoby starsze. Po przerwaniu leczenia NLPZ następuje zazwyczaj powrót do stanu sprzed leczenia.
Brak dostępnych informacji z kontrolowanych badań klinicznych dotyczących stosowania leku FELDEN 20 mg u pacjentów z zaawansowaną chorobą nerek. Działanie FELDENE 20 mg na nerki może przyspieszyć postęp zaburzeń czynności nerek u pacjentów z istniejącą wcześniej chorobą nerek.
Prawidłowy stan objętości u pacjentów odwodnionych lub z hipowolemią przed rozpoczęciem leczenia produktem FELDENE. Monitorować czynność nerek u pacjentów z zaburzeniami czynności nerek lub wątroby, niewydolnością serca, odwodnieniem lub hipowolemią podczas stosowania produktu FELDENE [patrz INTERAKCJE Z LEKAMI ]. Należy unikać stosowania produktu FELDENE u pacjentów z zaawansowaną chorobą nerek, chyba że spodziewane korzyści przewyższają ryzyko pogorszenia czynności nerek. Jeśli FELDENE jest stosowany u pacjentów z zaawansowaną chorobą nerek, należy monitorować pacjentów pod kątem objawów pogorszenia czynności nerek.
Hiperkaliemia
Podczas stosowania NLPZ zgłaszano zwiększenie stężenia potasu w surowicy, w tym hiperkaliemię, nawet u niektórych pacjentów bez zaburzeń czynności nerek. U pacjentów z prawidłową czynnością nerek działania te przypisano stanowi hiporeninemii i hipoaldosteronizmu.
Reakcje anafilaktyczne
Piroksykam był związany z reakcjami anafilaktycznymi u pacjentów z nadwrażliwością na piroksykam i bez znanej nadwrażliwości na piroksykam oraz u pacjentów z astmą wrażliwą na aspirynę [patrz PRZECIWWSKAZANIA oraz Zaostrzenie astmy związane z wrażliwością na aspirynę ].
Poszukaj pomocy w nagłych wypadkach, jeśli wystąpi reakcja anafilaktyczna.
Zaostrzenie astmy związane z wrażliwością na aspirynę
Subpopulacja pacjentów z astmą może mieć astmę wrażliwą na aspirynę, która może obejmować przewlekłe zapalenie zatok przynosowych powikłane polipami nosa; ciężki, potencjalnie śmiertelny skurcz oskrzeli; i/lub nietolerancja aspiryny i innych NLPZ. Ponieważ u takich pacjentów wrażliwych na aspirynę odnotowano reakcje krzyżowe między aspiryną i innymi NLPZ, FELDENE 20 mg jest przeciwwskazany u pacjentów z tą formą wrażliwości na aspirynę [patrz PRZECIWWSKAZANIA ]. Gdy FELDENE jest stosowany u pacjentów z istniejącą wcześniej astmą (bez znanej wrażliwości na aspirynę), należy monitorować pacjentów pod kątem zmian w objawach astmy.
Poważne reakcje skórne
NLPZ, w tym piroksykam, mogą powodować poważne reakcje skórne, takie jak złuszczające zapalenie skóry, zespół Stevensa-Johnsona (SJS) i toksyczna nekroliza naskórka (TEN), które mogą być śmiertelne. Te poważne zdarzenia mogą wystąpić bez ostrzeżenia. Należy poinformować pacjentów o objawach przedmiotowych i podmiotowych ciężkich reakcji skórnych oraz o zaprzestaniu stosowania leku FELDENE 10 mg w przypadku pojawienia się pierwszych objawów wysypki skórnej lub jakichkolwiek innych objawów nadwrażliwości. FELDENE 20 mg jest przeciwwskazany u pacjentów z wcześniejszymi ciężkimi reakcjami skórnymi na NLPZ [patrz PRZECIWWSKAZANIA ].
Przedwczesne zamknięcie przewodu tętniczego płodu
Piroksykam może spowodować przedwczesne zamknięcie przewodu tętniczego płodu. Unikaj stosowania NLPZ, w tym FELDENE 20 mg, u kobiet w ciąży począwszy od 30 tygodnia ciąży (trzeci trymestr) [patrz Używaj w określonych populacjach ].
Toksyczność hematologiczna
pacjentów leczonych NLPZ wystąpiła niedokrwistość. Może to być spowodowane utajoną lub znaczną utratą krwi, zatrzymaniem płynów lub niekompletnie opisanym wpływem na erytropoezę. Jeśli pacjent leczony FELDENE ma jakiekolwiek oznaki lub objawy niedokrwistości, należy monitorować poziom hemoglobiny lub hematokrytu.
NLPZ, w tym FELDENE, mogą zwiększać ryzyko krwawień. Choroby współistniejące, takie jak zaburzenia krzepnięcia, jednoczesne stosowanie warfaryny, innych leków przeciwzakrzepowych, leków przeciwpłytkowych (np. aspiryna), inhibitorów wychwytu zwrotnego serotoniny (SSRI) i inhibitorów wychwytu zwrotnego serotoniny i noradrenaliny (SNRI) mogą zwiększać to ryzyko. Monitoruj tych pacjentów pod kątem oznak krwawienia [patrz INTERAKCJE Z LEKAMI ].
Maskowanie stanu zapalnego i gorączki
Aktywność farmakologiczna leku FELDENE 10 mg w zmniejszaniu stanu zapalnego i ewentualnie gorączki może zmniejszyć użyteczność objawów diagnostycznych w wykrywaniu infekcji.
Monitoring laboratoryjny
Ponieważ poważne krwawienie z przewodu pokarmowego, hepatotoksyczność i uszkodzenie nerek mogą wystąpić bez objawów lub oznak ostrzegawczych, należy rozważyć okresowe monitorowanie pacjentów długotrwale leczonych NLPZ za pomocą CBC i profilu chemicznego [patrz Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja, hepatotoksyczność, toksyczność nerek i hiperkaliemia ] .
Efekty okulistyczne
Ze względu na doniesienia o niepożądanych objawach dotyczących oka po zastosowaniu niesteroidowych leków przeciwzapalnych, zaleca się, aby pacjenci, u których podczas leczenia produktem FELDENE pojawiły się dolegliwości ze strony wzroku, byli poddani ocenie okulistycznej.

Informacje dotyczące poradnictwa dla pacjentów
Poinformuj pacjenta, aby przeczytał zatwierdzone przez FDA oznakowanie pacjenta ( Przewodnik po lekach ), która towarzyszy każdej zrealizowanej recepcie. Należy poinformować pacjentów, rodziny lub ich opiekunów o następujących informacjach przed rozpoczęciem leczenia produktem FELDENE oraz okresowo w trakcie trwającej terapii.
Zdarzenia zakrzepowo-sercowe
Należy doradzić pacjentom, aby zwracali uwagę na objawy zakrzepicy sercowo-naczyniowej, w tym ból w klatce piersiowej, duszność, osłabienie lub niewyraźną mowę, i natychmiast zgłaszali każdy z tych objawów swojemu lekarzowi [patrz OSTRZEŻENIA I ŚRODKI ].
Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja
Poradź pacjentom, aby zgłaszali swojemu lekarzowi objawy owrzodzeń i krwawień, w tym ból w nadbrzuszu, niestrawność, smoliste stolce i krwawe wymioty. W przypadku jednoczesnego stosowania aspiryny w małych dawkach w profilaktyce kardiologicznej należy poinformować pacjentów o zwiększonym ryzyku wystąpienia krwawienia z przewodu pokarmowego [patrz OSTRZEŻENIA I ŚRODKI ].
Hepatotoksyczność
Należy poinformować pacjentów o oznakach i objawach ostrzegawczych hepatotoksyczności (np. nudności, zmęczenie, letarg, świąd, biegunka, żółtaczka, tkliwość w prawym górnym kwadrancie i objawy grypopodobne). W takim przypadku należy poinstruować pacjentów, aby odstawili produkt FELDENE i natychmiast podjęli leczenie [patrz OSTRZEŻENIA I ŚRODKI ].
Niewydolność serca i obrzęk
Należy doradzić pacjentom, aby zwracali uwagę na objawy zastoinowej niewydolności serca, w tym duszność, niewyjaśniony przyrost masy ciała lub obrzęki, i skontaktowali się z lekarzem, jeśli takie objawy wystąpią [patrz OSTRZEŻENIA I ŚRODKI ].
Reakcje anafilaktyczne
Poinformuj pacjentów o objawach reakcji anafilaktycznej (np. trudności w oddychaniu, obrzęk twarzy lub gardła). Należy poinstruować pacjentów, aby w razie ich wystąpienia szukali natychmiastowej pomocy w nagłych wypadkach [patrz PRZECIWWSKAZANIA oraz OSTRZEŻENIA I ŚRODKI ].
Poważne reakcje skórne
Należy doradzić pacjentom natychmiastowe przerwanie stosowania produktu FELDENE w przypadku wystąpienia jakiejkolwiek wysypki i jak najszybsze skontaktowanie się z lekarzem [patrz OSTRZEŻENIA I ŚRODKI ].
Płodność kobiet
Poinformuj kobiety w wieku rozrodczym, które pragną zajść w ciążę, że NLPZ, w tym FELDENE 20 mg, mogą być związane z odwracalnym opóźnieniem owulacji [patrz Używaj w określonych populacjach ].
Toksyczność płodu
Poinformuj kobiety w ciąży, aby unikały stosowania FELDENE i innych NLPZ począwszy od 30 tygodnia ciąży ze względu na ryzyko przedwczesnego zamknięcia przewodu tętniczego płodu [patrz OSTRZEŻENIA I ŚRODKI oraz Używaj w określonych populacjach ].
Unikaj jednoczesnego stosowania NLPZ
Należy poinformować pacjentów, że jednoczesne stosowanie produktu FELDENE z innymi NLPZ lub salicylanami (np. diflunisalem, salsalatem) nie jest zalecane ze względu na zwiększone ryzyko toksyczności żołądkowo-jelitowej oraz niewielki lub żaden wzrost skuteczności [patrz OSTRZEŻENIA I ŚRODKI oraz INTERAKCJE Z LEKAMI ]. Ostrzegaj pacjentów, że NLPZ mogą być obecne w lekach „bez recepty” stosowanych w leczeniu przeziębienia, gorączki lub bezsenności.
Stosowanie NLPZ i aspiryny w niskich dawkach
Poinformuj pacjentów, aby nie stosowali małych dawek aspiryny jednocześnie z produktem FELDENE, dopóki nie porozmawiają ze swoim lekarzem [patrz INTERAKCJE Z LEKAMI ].
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Karcynogeneza
Nie przeprowadzono długoterminowych badań na zwierzętach w celu scharakteryzowania potencjalnego działania rakotwórczego piroksykamu.
Mutageneza
Piroksykam nie wykazywał działania mutagennego w teście powrotnych mutacji bakteryjnych Amesa ani w teście dominujących mutacji letalnych u myszy i nie wykazywał działania klastogennego w teście aberracji chromosomowych in vivo u myszy.
Upośledzenie płodności
Badania dotyczące reprodukcji, w których szczurom podawano piroksykam w dawkach 2, 5 lub 10 mg/kg/dobę (do 5-krotności maksymalnej zalecanej dawki u ludzi [MRHD] wynoszącej 20 mg w przeliczeniu na mg/m2 powierzchni ciała [BSA]) nie wykazał upośledzenia płodności mężczyzn ani kobiet.
Używaj w określonych populacjach
Ciąża
Podsumowanie ryzyka
Stosowanie NLPZ, w tym FELDENE 20 mg, w trzecim trymestrze ciąży zwiększa ryzyko przedwczesnego zamknięcia przewodu tętniczego płodu. Unikaj stosowania NLPZ, w tym FELDENE 10 mg, u kobiet w ciąży począwszy od 30 tygodnia ciąży (trzeci trymestr).
Nie ma odpowiednich i dobrze kontrolowanych badań dotyczących stosowania leku FELDENE 20 mg u kobiet w ciąży.
Dane z badań obserwacyjnych dotyczące potencjalnego ryzyka dla zarodka i płodu związanego ze stosowaniem NLPZ u kobiet w pierwszym lub drugim trymestrze ciąży są niejednoznaczne. W ogólnej populacji Stanów Zjednoczonych we wszystkich klinicznie rozpoznanych ciążach, niezależnie od ekspozycji na lek, częstość występowania poważnych wad rozwojowych wynosi 2–4%, a poronienia 15–20%.
badaniach rozrodczości zwierząt na szczurach i królikach nie było dowodów na teratogenność przy ekspozycjach odpowiednio do 5- i 10-krotności MRHD. W badaniach piroksykamu na szczurach fetotoksyczność (poronienie implantacji) obserwowano przy ekspozycji 2 razy większej niż MRHD, a opóźniony poród i zwiększoną częstość występowania martwych urodzeń po dawkach równoważnych MRHD piroksykamu. Na podstawie danych na zwierzętach wykazano, że prostaglandyny odgrywają ważną rolę w przepuszczalności naczyń endometrium, implantacji blastocysty i decydualizacji. W badaniach na zwierzętach podawanie inhibitorów syntezy prostaglandyn, takich jak piroksykam, powodowało zwiększenie poronień przed i po implantacji.
Rozważania kliniczne
Praca lub dostawa
Nie ma badań dotyczących wpływu produktu FELDENE podczas porodu lub porodu. W badaniach na zwierzętach NLPZ, w tym piroksykam, hamują syntezę prostaglandyn, powodują opóźnienie porodu i zwiększają częstość martwych urodzeń.
Dane
Dane zwierząt
Ciężarne szczury, którym podawano piroksykam w dawce 2, 5 lub 10 mg/kg/dobę w okresie organogenezy (od 6 do 15. dnia ciąży) wykazywały zwiększone straty po implantacji po podaniu 5 i 10 mg/kg/dobę piroksykamu (co odpowiada 2 i 5-krotność maksymalnej zalecanej dawki dla ludzi [MRHD], odpowiednio 20 mg, w przeliczeniu na mg/m2 powierzchni ciała [BSA]). U potomstwa nie stwierdzono żadnych nieprawidłowości rozwojowych związanych z przyjmowaniem leku. Toksyczność w przewodzie pokarmowym była zwiększona u ciężarnych szczurów w ostatnim trymestrze ciąży w porównaniu do szczurów niebędących w ciąży lub szczurów we wcześniejszych trymestrach ciąży. Ciężarne króliki, którym podawano piroksykam w dawce 2, 5 lub 10 mg/kg/dobę w okresie organogenezy (od 7 do 18 dnia ciąży) nie wykazywały żadnych nieprawidłowości rozwojowych związanych z lekiem u potomstwa (do 10-krotności MRHD na podstawie mg/m2 BSA).
badaniu rozwoju przed- i pourodzeniowego, w którym ciężarnym szczurom podawano piroksykam w dawce 2, 5 lub 10 mg/kg mc./dobę w 15. dniu ciąży do czasu porodu i odstawienia potomstwa, u samic w 10 mg/kg/dzień (5-krotność MRHD w oparciu o mg/m2 BSA) począwszy od 20. dnia ciąży. Leczone matki ujawniły zapalenie otrzewnej, zrosty, krwawienie z żołądka, krwotoczne zapalenie jelit i martwe płody w macicy. Poród był opóźniony i występowała zwiększona częstość martwych urodzeń we wszystkich grupach leczonych piroksykamem (w dawkach równoważnych MRHD). Nie można było wiarygodnie ocenić rozwoju poporodowego ze względu na brak opieki matczynej wtórnej do ciężkiej toksyczności matczynej.
Laktacja
Podsumowanie ryzyka
Ograniczone dane z 2 opublikowanych raportów, które obejmowały łącznie 6 kobiet karmiących piersią i 2 niemowlęta, wykazały, że piroksykam przenika do mleka ludzkiego w ilości około 1% do 3% stężenia matki. Podczas leczenia nie wystąpiła kumulacja piroksykamu w mleku w porównaniu z akumulacją w osoczu matki. Należy wziąć pod uwagę korzyści rozwojowe i zdrowotne wynikające z karmienia piersią wraz z klinicznym zapotrzebowaniem matki na FELDEN 20 mg i wszelkimi potencjalnym niekorzystnym wpływem FELDEN na karmione piersią niemowlę lub związanym z tym schorzeniem matki.
Kobiety i mężczyźni o potencjale rozrodczym
Bezpłodność
Kobiety
oparciu o mechanizm działania, stosowanie NLPZ, w których pośredniczą prostaglandyny, w tym FELDENE, może opóźniać lub zapobiegać pękaniu pęcherzyków jajnikowych, które u niektórych kobiet jest związane z odwracalną niepłodnością. Opublikowane badania na zwierzętach wykazały, że podawanie inhibitorów syntezy prostaglandyn może zaburzać pośredniczone przez prostaglandyny pęknięcie pęcherzyka wymagane do owulacji. Niewielkie badania u kobiet leczonych NLPZ wykazały również odwracalne opóźnienie owulacji. Rozważ odstawienie NLPZ, w tym FELDENE, u kobiet, które mają trudności z zajściem w ciążę lub są w trakcie badania niepłodności.
Zastosowanie pediatryczne
FELDENE 20 mg nie był badany u dzieci. Bezpieczeństwo i skuteczność FELDENE 10mg nie zostały ustalone.
Zastosowanie geriatryczne
Pacjenci w podeszłym wieku, w porównaniu z młodszymi pacjentami, są narażeni na większe ryzyko poważnych działań niepożądanych ze strony układu krążenia, przewodu pokarmowego i (lub) nerek związanych z NLPZ. Jeśli przewidywane korzyści dla pacjenta w podeszłym wieku przewyższają potencjalne ryzyko, należy rozpocząć dawkowanie od dolnej granicy zakresu dawkowania i monitorować pacjentów pod kątem działań niepożądanych [patrz OSTRZEŻENIA I ŚRODKI ].
PRZEDAWKOWAĆ
Objawy po ostrym przedawkowaniu NLPZ ograniczały się zazwyczaj do letargu, senności, nudności, wymiotów i bólu w nadbrzuszu, które na ogół ustępują po zastosowaniu leczenia podtrzymującego. Wystąpiło krwawienie z przewodu pokarmowego. Wystąpiło nadciśnienie, ostra niewydolność nerek, depresja oddechowa i śpiączka, ale występowały one rzadko [patrz OSTRZEŻENIA I ŚRODKI ].
Prowadź pacjentów z opieką objawową i podtrzymującą po przedawkowaniu NLPZ. Nie ma swoistych odtrutek. Rozważyć wymioty i/lub węgiel aktywowany (60–100 gramów u dorosłych, 1–2 gramy na kg masy ciała u dzieci) i/lub przeczyszczenie osmotyczne u pacjentów z objawami obserwowanymi w ciągu czterech godzin od spożycia lub u pacjentów z dużym przedawkowaniem ( 5 do 10 razy więcej niż zalecana dawka).
Podczas leczenia przedawkowania piroksykamu należy wziąć pod uwagę długi okres półtrwania piroksykamu w osoczu. Wymuszona diureza, alkalizacja moczu, hemodializa lub hemoperfuzja mogą nie być przydatne ze względu na wysokie wiązanie z białkami.
Aby uzyskać dodatkowe informacje na temat leczenia przedawkowania, skontaktuj się z centrum kontroli zatruć (1-800-222-1222).
PRZECIWWSKAZANIA
FELDENE 10 mg jest przeciwwskazany u następujących pacjentów:
- Znana nadwrażliwość (np. reakcje anafilaktyczne i poważne reakcje skórne) na piroksykam lub którykolwiek ze składników produktu leczniczego [patrz OSTRZEŻENIA I ŚRODKI ]
- Historia astmy, pokrzywki lub innych reakcji alergicznych po przyjęciu aspiryny lub innych NLPZ. U takich pacjentów zgłaszano ciężkie, czasami prowadzące do zgonu reakcje anafilaktyczne na NLPZ [patrz OSTRZEŻENIA I ŚRODKI ]
- W przypadku operacji pomostowania aortalno-wieńcowego (CABG) [patrz OSTRZEŻENIA I ŚRODKI ]
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Piroksykam ma właściwości przeciwbólowe, przeciwzapalne i przeciwgorączkowe.
Mechanizm działania FELDENE 20 mg, podobnie jak innych NLPZ, nie jest w pełni poznany, ale obejmuje hamowanie cyklooksygenazy (COX-1 i COX-2).
Piroksykam jest silnym inhibitorem syntezy prostaglandyn (PG) in vitro. Stężenia piroksykamu osiągnięte podczas terapii wywoływały efekty in vivo. Prostaglandyny uwrażliwiają nerwy doprowadzające i nasilają działanie bradykininy w wywoływaniu bólu w modelach zwierzęcych. Prostaglandyny są mediatorami stanu zapalnego. Ponieważ piroksykam jest inhibitorem syntezy prostaglandyn, jego mechanizm działania może wynikać ze zmniejszenia stężenia prostaglandyn w tkankach obwodowych.
Farmakokinetyka
Ogólna charakterystyka farmakokinetyczna
Farmakokinetykę piroksykamu scharakteryzowano u zdrowych ochotników, specjalnych populacji i pacjentów. Farmakokinetyka piroksykamu jest liniowa. Proporcjonalny wzrost ekspozycji obserwuje się wraz ze wzrostem dawek. Wydłużony okres półtrwania (50 godzin) powoduje utrzymanie względnie stałych stężeń w osoczu przez cały dzień przy dawkach raz na dobę i znaczną kumulację przy wielokrotnym dawkowaniu. Większość pacjentów zbliża się do poziomu w osoczu w stanie stacjonarnym w ciągu 7-12 dni. Wyższe stężenia, które zbliżają się do stanu stacjonarnego po dwóch do trzech tygodniach, obserwowano u pacjentów, u których wystąpił dłuższy okres półtrwania piroksykamu w osoczu.
Wchłanianie
Piroksykam dobrze się wchłania po podaniu doustnym. Stężenia leku w osoczu są proporcjonalne do dawek 10 i 20 mg i zazwyczaj osiągają maksymalne wartości w ciągu trzech do pięciu godzin po podaniu. Pojedyncza dawka 20 mg na ogół daje szczytowe stężenie piroksykamu w osoczu od 1,5 do 2 μg/ml, podczas gdy maksymalne stężenie leku w osoczu po wielokrotnym podawaniu 20 mg piroksykamu dziennie zwykle stabilizuje się na poziomie 3–8 μg/ml.
Po podaniu doustnym występuje niewielkie opóźnienie w szybkości, ale nie w zakresie wchłaniania z pokarmem. Wykazano, że równoczesne podawanie leków zobojętniających (wodorotlenek glinu lub wodorotlenek glinu z wodorotlenkiem magnezu) nie ma wpływu na stężenie w osoczu piroksykamu podawanego doustnie.
Dystrybucja
Pozorna objętość dystrybucji piroksykamu wynosi około 0,14 l/kg. Dziewięćdziesiąt dziewięć procent piroksykamu w osoczu wiąże się z białkami osocza. Piroksykam przenika do mleka ludzkiego. Obecność w mleku kobiecym oznaczano w warunkach początkowych i długotrwałych (52 dni). Piroksykam pojawiał się w mleku matki w stężeniu około 1% do 3% stężenia matki. Podczas leczenia nie wystąpiła kumulacja piroksykamu w mleku w porównaniu z akumulacją w osoczu.
Eliminacja
Metabolizm
Metabolizm piroksykamu zachodzi przez hydroksylację w pozycji 5 bocznego łańcucha pirydylowego i sprzęganie tego produktu; przez cyklodehydratację; oraz przez sekwencję reakcji obejmujących hydrolizę wiązania amidowego, dekarboksylację, skurcz pierścienia i N-demetylację. Badania in vitro wskazują cytochrom P4502C9 (CYP2C9) jako główny enzym biorący udział w tworzeniu 5'-hydroksypiroksykamu, głównego metabolitu [patrz Farmakogenomika ]. Doniesiono, że produkty biotransformacji metabolizmu piroksykamu nie wykazują żadnego działania przeciwzapalnego.
Większą ogólnoustrojową ekspozycję na piroksykam odnotowano u osób z polimorfizmami CYP2C9 w porównaniu z osobami z prawidłowym metabolizmem [patrz Farmakogenomika ].
Wydalanie
Piroksykam i produkty jego biotransformacji są wydalane z moczem i kałem, przy czym w moczu pojawia się około dwa razy więcej niż w kale. Około 5% dawki leku FELDENE 10 mg jest wydalane w postaci niezmienionej. Okres półtrwania w osoczu (t½ ) piroksykamu wynosi około 50 godzin.
Określone populacje
Pediatryczny
Piroksykam nie był badany u dzieci.
Wyścig
Różnice farmakokinetyczne ze względu na rasę nie zostały zidentyfikowane.
Niewydolność wątroby
Nie ustalono wpływu choroby wątroby na farmakokinetykę piroksykamu. Jednak znaczna część piroksykamu jest wydalana na drodze metabolizmu wątrobowego. W związku z tym pacjenci z chorobą wątroby mogą wymagać zmniejszonych dawek piroksykamu w porównaniu z pacjentami z prawidłową czynnością wątroby.
Zaburzenia czynności nerek
Farmakokinetykę piroksykamu badano u pacjentów z niewydolnością nerek. Badania wskazują, że pacjenci z łagodnymi lub umiarkowanymi zaburzeniami czynności nerek mogą nie wymagać dostosowania dawkowania. Jednak właściwości farmakokinetyczne piroksykamu u pacjentów z ciężką niewydolnością nerek lub poddawanych hemodializie nie są znane.
Badania interakcji leków
Leki zobojętniające sok żołądkowy
Jednoczesne podawanie leków zobojętniających kwas nie miało wpływu na stężenie piroksykamu w osoczu.
Aspiryna
Gdy piroksykam podawano z aspiryną, jego wiązanie z białkami było zmniejszone, chociaż klirens wolnego FELDENU 20 mg nie uległ zmianie. Poziomy piroksykamu w osoczu zmniejszyły się do około 80% wartości prawidłowych, gdy FELDENE podawano (20 mg/dobę) w połączeniu z aspiryną (3900 mg/dobę). Kliniczne znaczenie tej interakcji nie jest znane [patrz INTERAKCJE Z LEKAMI ].
Farmakogenomika
Aktywność CYP2C9 jest zmniejszona u osób z polimorfizmami genetycznymi, takimi jak polimorfizmy CYP2C9*2 i CYP2C9*3. Ograniczone dane z dwóch opublikowanych raportów wykazały, że osoby z heterozygotycznymi genotypami CYP2C9*1/*2 (n=9), heterozygotycznymi CYP2C9*1/*3 (n=9) i homozygotycznymi CYP2C9*3/*3 (n=1) wykazali odpowiednio 1,7-, 1,7- i 5,3-krotnie wyższe ogólnoustrojowe stężenia piroksykamu niż u osób z CYP2C9*1/*1 (n=17, genotyp prawidłowego metabolizmu) po podaniu pojedynczej dawki doustnej. Średnie wartości okresu półtrwania w fazie eliminacji piroksykamu u osób z genotypami CYP2C9*1/*3 (n=9) i CYP2C9*3/*3 (n=1) były 1,7- i 8,8-krotnie wyższe niż u osób z CYP2C9*1 /*1 (n=17). Szacuje się, że częstość genotypu homozygotycznego*3/*3 wynosi od 0% do 1% w całej populacji; jednak w niektórych grupach etnicznych odnotowano częstości sięgające 5,7%.
Słabe metabolizatory substratów CYP2C9
pacjentów ze stwierdzonym lub podejrzewanym słabym metabolizmem CYP2C9 na podstawie genotypu lub wcześniejszej historii/doświadczenia z innymi substratami CYP2C9 (takimi jak warfaryna i fenytoina) należy rozważyć zmniejszenie dawki, ponieważ mogą oni mieć nienormalnie wysokie stężenia w osoczu z powodu zmniejszonego klirensu metabolicznego.
Studia kliniczne
W kontrolowanych badaniach klinicznych ustalono skuteczność FELDENE zarówno w przypadku ostrych zaostrzeń, jak i długotrwałego leczenia reumatoidalnego zapalenia stawów i choroby zwyrodnieniowej stawów.
Efekty terapeutyczne FELDENE 20 mg są widoczne we wczesnym okresie leczenia obu chorób, z postępującym wzrostem odpowiedzi w ciągu kilku (8-12) tygodni. Skuteczność jest postrzegana w kategoriach łagodzenia bólu i, jeśli występuje, ustępowania stanu zapalnego.
Dawki 20 mg/dzień FELDENE 20 mg wykazują działanie terapeutyczne porównywalne z terapeutycznymi dawkami aspiryny, z mniejszą częstością występowania niewielkich skutków żołądkowo-jelitowych i szumów usznych.
FELDENE 10 mg podawano jednocześnie ze stałymi dawkami złota i kortykosteroidów. Istnienie efektu „oszczędzania sterydów” nie zostało do tej pory odpowiednio zbadane.
INFORMACJA O PACJENCIE
Jakie są najważniejsze informacje, które powinienem wiedzieć o lekach zwanych niesteroidowymi lekami przeciwzapalnymi (NLPZ)?
NLPZ mogą powodować poważne skutki uboczne, w tym:
- Zwiększone ryzyko zawału serca lub udaru mózgu, które mogą prowadzić do śmierci. Ryzyko to może wystąpić na początku leczenia i może wzrosnąć:
- ze wzrastającymi dawkami NLPZ
- przy dłuższym stosowaniu NLPZ
- Zwiększone ryzyko krwawienia, owrzodzeń i pęknięć (perforacji) przełyku (przewodu prowadzącego z jamy ustnej do żołądka), żołądka i jelit:
- w dowolnym momencie podczas użytkowania
- bez objawów ostrzegawczych
- które mogą spowodować śmierć
Ryzyko owrzodzenia lub krwawienia wzrasta wraz z:
- wrzody żołądka w przeszłości lub krwawienie z żołądka lub jelit po zastosowaniu NLPZ
- przyjmowanie leków zwanych „kortykosteroidami”, „antykoagulantami”, „SSRI” lub „SNRI”
- rosnące dawki NLPZ
- dłuższe stosowanie NLPZ
- palenie
- picie alkoholu
- starszy wiek
- słabe zdrowie
- zaawansowana choroba wątroby
- problemy z krwawieniem
NLPZ powinny być stosowane wyłącznie:
- dokładnie zgodnie z zaleceniami
- w najniższej możliwej dawce dla twojego leczenia
- na najkrótszy potrzebny czas
Nie należy przyjmować NLPZ bezpośrednio przed lub po operacji serca zwanej „pomostowaniem aortalno-wieńcowym (CABG).”
Unikaj przyjmowania NLPZ po niedawnym zawale serca, chyba że zaleci Ci to Twój lekarz. Możesz mieć zwiększone ryzyko kolejnego zawału serca, jeśli przyjmujesz NLPZ po niedawnym zawale serca
Co to są NLPZ?
NLPZ są stosowane w leczeniu bólu i zaczerwienienia, obrzęku i gorąca (zapalenia) z powodu schorzeń, takich jak różne rodzaje zapalenia stawów, skurcze menstruacyjne i inne rodzaje krótkotrwałego bólu.
Kto nie powinien brać NLPZ?
Nie przyjmuj NLPZ:
- jeśli u pacjenta wystąpił atak astmy, pokrzywka lub inna reakcja alergiczna na aspirynę lub inne NLPZ.
- tuż przed lub po operacji pomostowania aortalno-wieńcowego.
Przed zażyciem NLPZ poinformuj swojego lekarza o wszystkich swoich schorzeniach, w tym jeśli:
- masz problemy z wątrobą lub nerkami
- mieć wysokie ciśnienie krwi
- mieć astmę
- są w ciąży lub planują zajść w ciążę. Porozmawiaj ze swoim lekarzem, jeśli rozważasz przyjmowanie NLPZ w czasie ciąży. Nie należy przyjmować NLPZ po 29. tygodniu ciąży
- karmisz piersią lub planujesz karmić piersią.
Poinformuj swojego lekarza o wszystkich przyjmowanych lekach, w tym o lekach wydawanych na receptę lub bez recepty, witaminach lub suplementach ziołowych. NLPZ i niektóre inne leki mogą wchodzić ze sobą w interakcje i powodować poważne skutki uboczne. Nie rozpoczynaj przyjmowania nowych leków bez uprzedniej konsultacji z lekarzem.
Jakie są możliwe skutki uboczne NLPZ?
NLPZ mogą powodować poważne skutki uboczne, w tym:
Zobacz „Jakie są najważniejsze informacje, które powinienem wiedzieć o lekach zwanych niesteroidowymi lekami przeciwzapalnymi (NLPZ)?
- nowe lub gorsze wysokie ciśnienie krwi
- niewydolność serca
- problemy z wątrobą, w tym niewydolność wątroby
- problemy z nerkami, w tym niewydolność nerek
- niski poziom czerwonych krwinek (niedokrwistość)
- zagrażające życiu reakcje skórne
- zagrażające życiu reakcje alergiczne
- Inne skutki uboczne NLPZ obejmują: ból brzucha, zaparcia, biegunka, gazy, zgaga, nudności, wymioty i zawroty głowy.
Natychmiast uzyskaj pomoc w nagłych wypadkach, jeśli wystąpi którykolwiek z następujących objawów:
- duszność lub trudności w oddychaniu
- ból w klatce piersiowej
- osłabienie w jednej części lub boku ciała
- bełkotliwa wymowa
- obrzęk twarzy lub gardła
Przestań brać NLPZ i natychmiast skontaktuj się z lekarzem, jeśli wystąpi którykolwiek z następujących objawów:
- mdłości
- bardziej zmęczony lub słabszy niż zwykle
- biegunka
- swędzący
- Twoja skóra lub oczy wyglądają na żółte
- niestrawność lub ból brzucha
- objawy grypopodobne
- krew wymiotów
- w wypróżnieniach pojawia się krew lub jest czarna i lepka jak smoła
- nietypowy przyrost masy ciała
- wysypka skórna lub pęcherze z gorączką
- obrzęk ramion, nóg, dłoni i stóp
Jeśli zażyjesz zbyt dużo NLPZ, skontaktuj się z lekarzem lub natychmiast uzyskaj pomoc medyczną.
To nie wszystkie możliwe skutki uboczne NLPZ. Aby uzyskać więcej informacji, zapytaj swojego lekarza lub farmaceutę o NLPZ.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Inne informacje o NLPZ
- Aspiryna jest NLPZ, ale nie zwiększa ryzyka zawału serca. Aspiryna może powodować krwawienie w mózgu, żołądku i jelitach. Aspiryna może również powodować wrzody żołądka i jelit.
- Niektóre NLPZ są sprzedawane w mniejszych dawkach bez recepty (bez recepty). Porozmawiaj ze swoim lekarzem przed użyciem NLPZ dostępnych bez recepty przez ponad 10 dni.
Ogólne informacje o bezpiecznym i skutecznym stosowaniu NLPZ
Leki są czasami przepisywane do celów innych niż wymienione w Przewodniku po lekach. Nie należy stosować NLPZ w stanie, na który nie został przepisany. Nie podawaj NLPZ innym osobom, nawet jeśli mają takie same objawy jak ty. Może im to zaszkodzić.
Jeśli chcesz uzyskać więcej informacji na temat NLPZ, porozmawiaj ze swoim lekarzem. Możesz poprosić farmaceutę lub pracownika służby zdrowia o informacje na temat NLPZ, które są przeznaczone dla pracowników służby zdrowia.
Ten przewodnik po lekach został zatwierdzony przez amerykańską Agencję ds. Żywności i Leków.
