Suprax 100mg, 200mg Cefixime Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Suprax 200mg i jak się go stosuje?
Suprax (cefiksym) do zawiesiny doustnej jest antybiotykiem cefalosporynowym stosowanym w leczeniu wielu różnych rodzajów zakażeń wywołanych przez bakterie.
Jakie są skutki uboczne Supraxu?
Częste działania niepożądane Suprax 100mg obejmują:
- rozstrój/ból żołądka,
- biegunka,
- mdłości,
- zaparcie,
- utrata apetytu,
- gaz,
- ból głowy,
- zawroty głowy,
- lęk,
- senność,
- zwiększone oddawanie moczu w nocy,
- katar,
- ból gardła,
- kaszel, lub
- swędzenie lub wydzielina pochwy.
Należy poinformować lekarza, jeśli wystąpią rzadkie, ale bardzo poważne działania niepożądane leku Suprax 200mg, w tym:
- silny ból brzucha lub brzucha,
- uporczywe nudności lub wymioty,
- zażółcenie oczu lub skóry,
- ciemny mocz,
- niezwykłe zmęczenie,
- nowe oznaki infekcji (np. uporczywy ból gardła, gorączka),
- łatwe siniaczenie lub krwawienie,
- zmiana ilości moczu lub
- zmiany psychiczne/nastroju (takie jak splątanie).
OPIS
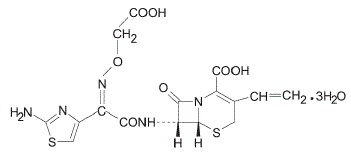
Cefiksym jest półsyntetycznym cefalosporynowym środkiem przeciwbakteryjnym do podawania doustnego. Chemicznie jest to (6R,7R)-7-[2-(2-amino-4-tiazolilo)glioksylamido]-8-okso-3-winylo-5-tia-1-azabicyklo [4.2.0] oct-2 kwas -eno-2-karboksylowy, 72-(Z)-[O-(karboksymetylo)oksym] trihydrat.
Masa cząsteczkowa = 507,50 jako trihydrat. Wzór chemiczny to C16H15N5O7S2.3H2O
Wzór strukturalny cefiksymu to:
- Składniki nieaktywne zawarte w SUPRAX® (cefiksym) 400 mg tabletki USP to: dwuzasadowy fosforan wapnia, hypromeloza, monohydrat laktozy, stearynian magnezu, celuloza mikrokrystaliczna, glikol polietylenowy, wstępnie żelowana skrobia, dwutlenek tytanu i triacetyna.
- Składniki nieaktywne zawarte w kapsułkach SUPRAX® (cefiksym) 400 mg to: koloidalny dwutlenek krzemu, krospowidon, niskopodstawiona hydroksypropyloceluloza, stearynian magnezu i mannitol. Otoczka kapsułki zawiera następujące składniki nieaktywne: czarny tlenek żelaza, czerwony tlenek żelaza, żelatynę, wodorotlenek potasu, glikol propylenowy, szelak, laurylosiarczan sodu i dwutlenek tytanu.
- Składniki nieaktywne zawarte w tabletkach do żucia SUPRAX® (cefiksym) 100 mg lub 150 mg lub 200 mg to: aspartam, koloidalny dwutlenek krzemu, krospowidon, FD&C Red # 40 Aluminium Lake, niskopodstawiona hydroksypropyloceluloza, stearynian magnezu, mannitol, permaseal o smaku fantazyjnym, i smak tutti frutti.
- Składniki nieaktywne zawarte w proszku SUPRAX® (cefiksym) do sporządzania zawiesiny doustnej USP to: koloidalny dwutlenek krzemu, benzoesan sodu, aromat truskawkowy, sukraloza (tylko w mocy 500 mg/5 ml), sacharoza i guma ksantanowa.
WSKAZANIA
Nieskomplikowane infekcje dróg moczowych
SUPRAX jest wskazany w leczeniu dorosłych i dzieci w wieku sześciu miesięcy lub starszych z niepowikłanymi zakażeniami dróg moczowych wywołanymi przez wrażliwe szczepy Escherichia coli i Proteus mirabilis.
Zapalenie ucha środkowego
SUPRAX jest wskazany w leczeniu dorosłych i dzieci w wieku sześciu miesięcy lub starszych z zapaleniem ucha środkowego wywołanym przez wrażliwe szczepy Haemophilus influenzae, Moraxella catarrhalis i Streptococcus pyogenes. (Skuteczność wobec Streptococcus pyogenes w tym układzie narządów została zbadana w mniej niż 10 zakażeniach.)
Notatka
U pacjentów z zapaleniem ucha środkowego wywołanym przez Streptococcus pneumoniae ogólna odpowiedź była o około 10% niższa dla cefiksymu niż dla leku porównawczego [patrz Studia kliniczne ].
Zapalenie gardła i zapalenie migdałków
SUPRAX jest wskazany w leczeniu dorosłych i dzieci w wieku sześciu miesięcy lub starszychz zapaleniem gardła i migdałków wywołanym przez wrażliwe izolaty Streptococcus pyogenes. (Uwaga: Penicylina jest zwykle lekiem z wyboru w leczeniu zakażeń Streptococcus pyogenes. SUPRAX jest ogólnie skuteczny w eradykacji Streptococcus pyogenes z nosogardzieli; jednak dane potwierdzające skuteczność SUPRAX 100 mg w późniejszej profilaktyce gorączki reumatycznej nie są do dyspozycji.)
Ostre zaostrzenia przewlekłego zapalenia oskrzeli
SUPRAX 200 mg jest wskazany w leczeniu dorosłych i dzieci w wieku 6 miesięcy lub starszych z ostrym zaostrzeniem przewlekłego zapalenia oskrzeli wywołanym przez wrażliwe szczepy Streptococcus pneumoniae i Haemophilus influenzae.
Nieskomplikowana rzeżączka (szyjkowa/cewkowa)
SUPRAX 100 mg jest wskazany w leczeniu dorosłych i dzieci w wieku sześciu miesięcy lub starszych z niepowikłaną rzeżączką (szyjkową/cewkową) wywołaną przez wrażliwe szczepy Neisseria gonorrhoeae (izolaty wytwarzające penicylinazy i nie wytwarzające penicylinazy).
Stosowanie
W celu ograniczenia rozwoju bakterii lekoopornych i utrzymania skuteczności SUPRAX 100 mg i innych leków przeciwbakteryjnych, SUPRAX 100 mg należy stosować wyłącznie w leczeniu zakażeń, co do których udowodniono, że są wywołane przez wrażliwe bakterie lub które są silnie podejrzewane. Gdy dostępne są informacje dotyczące hodowli i wrażliwości, należy je wziąć pod uwagę przy wyborze lub modyfikacji terapii przeciwdrobnoustrojowej. W przypadku braku takich danych, lokalna epidemiologia i wzorce podatności mogą przyczynić się do empirycznego doboru terapii.
DAWKOWANIE I SPOSÓB PODAWANIA
Dorośli ludzie
Zalecana dawka cefiksymu to 400 mg na dobę. Może być podawana jako tabletka lub kapsułka 400 mg na dobę lub tabletka 400 mg może być podzielona i podawana jako pół tabletki co 12 godzin. W leczeniu niepowikłanych zakażeń gonokokowych szyjki macicy/cewki moczowej zaleca się pojedynczą dawkę doustną 400 mg. Kapsułkę i tabletkę można podawać niezależnie od posiłków.
W leczeniu zakażeń wywołanych przez Streptococcus pyogenes należy podawać terapeutyczną dawkę cefiksymu przez co najmniej 10 dni.
Pacjenci pediatryczni (6 miesięcy lub starsi)
Zalecana dawka to 8 mg/kg/dobę zawiesiny. Może być podawana jako pojedyncza dawka dobowa lub może być podawana w dwóch dawkach podzielonych, jako 4 mg/kg co 12 godzin.
Notatka
Sugerowana dawka została określona dla każdego zakresu wagi pediatrycznej. Patrz Tabela 1. Upewnij się, że wszystkie zamówienia określające dawkę w mililitrach zawierają stężenie, ponieważ SUPRAX do zawiesiny doustnej jest dostępny w trzech różnych stężeniach (100 mg/5 ml, 200 mg/5 ml i 500 mg/5 ml).
Dzieci o masie ciała powyżej 45 kg lub starsze niż 12 lat powinny być leczone zalecaną dawką dla dorosłych. Tabletki do żucia SUPRAX (cefiksym) należy żuć lub rozkruszać przed połknięciem.
Zapalenie ucha środkowego należy leczyć tabletkami do żucia lub zawiesiną. Badania kliniczne zapalenia ucha środkowego przeprowadzono z tabletkami do żucia lub zawiesiną, a tabletki do żucia lub zawiesina dawały wyższe maksymalne stężenia we krwi niż tabletki podawane w tej samej dawce.
Dlatego w leczeniu zapalenia ucha środkowego tabletki lub kapsułki nie powinny zastępować tabletek do żucia ani zawiesiny [patrz FARMAKOLOGIA KLINICZNA ].
W leczeniu zakażeń wywołanych przez Streptococcus pyogenes należy podawać terapeutyczną dawkę cefiksymu przez co najmniej 10 dni.
Zaburzenia czynności nerek
SUPRAX 200 mg może być podawany w przypadku zaburzeń czynności nerek. Normalną dawkę i schemat można zastosować u pacjentów z klirensem kreatyniny 60 ml/min lub większym. Dostosowanie dawki u osób dorosłych z zaburzeniami czynności nerek znajduje się w Tabeli 2. Ani hemodializa, ani dializa otrzewnowa nie usuwają z organizmu znacznych ilości leku.
Wskazówki dotyczące rekonstytucji zawiesiny doustnej
Po rekonstytucji zawiesinę można przechowywać przez 14 dni w temperaturze pokojowej lub w lodówce bez znaczącej utraty mocy. Przechowywać szczelnie zamknięte. Wstrząśnij porządnie przed użyciem. Wyrzucić niewykorzystaną porcję po 14 dniach.
JAK DOSTARCZONE
Formy dawkowania i mocne strony
SUPRAX jest dostępny do podawania doustnego w następujących postaciach dawkowania i mocach:
- Tabletki powlekane dostarczają 400 mg cefiksymu w postaci trójwodzianu. Są to białe lub prawie białe, powlekane tabletki w kształcie kapsułki ze ściętymi krawędziami i podzieloną linią podziału po każdej stronie. Tabletka ma wytłoczony napis „SUPRAX” po jednej stronie i „LUPIN” po drugiej stronie.
- Kapsułki dostarczają 400 mg cefiksymu w postaci trójwodzianu. Są to kapsułki w rozmiarze „00EL” z różowym nieprzezroczystym wieczkiem i różowym nieprzezroczystym korpusem, z czarnym tuszem „LU” na wieczku i „U43” na korpusie. Kapsułki zawierają ziarnisty proszek o barwie od białej do żółtawobiałej.
- Tabletki do żucia zawierają 100 mg lub 150 mg lub 200 mg cefiksymu w postaci trójwodzianu. Tabletka 100 mg jest różowa, okrągła, z wytłoczonym napisem „SUPRAX 100” po jednej stronie i „LUPIN” po drugiej stronie. Tabletka 150 mg jest różowa, okrągła, z wytłoczonym napisem „SUPRAX 150” po jednej stronie i „LUPIN” po drugiej stronie. Tabletka 200 mg jest różowa, okrągła, z wytłoczonym napisem „SUPRAX 200” po jednej stronie i „LUPIN” po drugiej stronie.
- Proszek do sporządzania zawiesiny doustnej po rozpuszczeniu dostarcza 100 mg/5 ml lub 200 mg/5 ml lub 500 mg/5 ml cefiksymu w postaci trójwodzianu. Dla 100 mg/5 ml i 200 mg/5 ml proszek ma kolor od białawego do jasnożółtego i ma smak truskawkowy. Dla 500 mg/5 ml proszek ma kolor od białawego do kremowego i ma smak truskawkowy.
Składowania i stosowania
SUPRAX® jest dostępny do podawania doustnego w następujących postaciach dawkowania, mocach i opakowaniach wymienionych w poniższej tabeli:
Producent: Lupin Limited Mandideep 462 046 Indie. Aktualizacja: marzec 2018 r.
SKUTKI UBOCZNE
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
Najczęściej obserwowanymi działaniami niepożądanymi w badaniach w USA nad tabletkami były zdarzenia żołądkowo-jelitowe, które zgłaszano u 30% dorosłych pacjentów stosujących schemat dwa razy na dobę lub raz na dobę. Pięć procent (5%) pacjentów w badaniach klinicznych w USA przerwało leczenie z powodu działań niepożądanych związanych z lekiem. Poszczególne działania niepożądane obejmowały biegunkę 16%, luźne lub częste stolce 6%, ból brzucha 3%, nudności 7%, niestrawność 3% i wzdęcia 4%. Częstość występowania działań niepożądanych ze strony przewodu pokarmowego, w tym biegunki i luźnych stolców, u dzieci otrzymujących zawiesinę była porównywalna z częstością obserwowaną u dorosłych pacjentów otrzymujących tabletki.
Doświadczenie pomarketingowe
Następujące działania niepożądane zostały zgłoszone po zatwierdzeniu stosowania cefiksymu. Wskaźniki zachorowalności wynosiły mniej niż 1 na 50 (mniej niż 2%).
Przewód pokarmowy
badaniach klinicznych zidentyfikowano kilka przypadków udokumentowanego rzekomobłoniastego zapalenia jelita grubego. Początek objawów rzekomobłoniastego zapalenia jelita grubego może wystąpić w trakcie leczenia lub po jego zakończeniu.
Reakcje nadwrażliwości
Reakcje anafilaktyczne/anafilaktoidalne (w tym wstrząs i zgony), wysypki skórne, pokrzywka, gorączka polekowa, świąd, obrzęk naczynioruchowy i obrzęk twarzy. Zgłaszano rumień wielopostaciowy, zespół Stevensa-Johnsona i reakcje przypominające chorobę posurowiczą.
Wątrobiany
narastające podwyższenie w SGPT, SGOT, fosfatazie alkalicznej, zapaleniu wątroby, żółtaczce.
Nerkowy
Przejściowe podwyższenie stężenia BUN lub kreatyniny, ostra niewydolność nerek.
Ośrodkowy układ nerwowy
Bóle głowy, zawroty głowy, drgawki.
Układ hemiczny i limfatyczny
Przejściowa trombocytopenia, leukopenia, neutropenia, wydłużenie czasu protrombinowego, podwyższony poziom LDH, pancytopenia, agranulocytoza i eozynofilia.
Nieprawidłowe testy laboratoryjne
Hiperbilirubinemia.
Inne działania niepożądane
Świąd narządów płciowych, zapalenie pochwy, kandydoza, martwica toksyczno-rozpływna naskórka.
Działania niepożądane zgłaszane dla leków z grupy cefalosporyn
Reakcje alergiczne, nadkażenie, zaburzenia czynności nerek, nefropatia toksyczna, zaburzenia czynności wątroby, w tym cholestaza, niedokrwistość aplastyczna, niedokrwistość hemolityczna, krwotok i zapalenie okrężnicy.
Kilka cefalosporyn powiązano z wywoływaniem drgawek, szczególnie u pacjentów z zaburzeniami czynności nerek, gdy dawka nie została zmniejszona [patrz DAWKOWANIE I SPOSÓB PODAWANIA Widzieć PRZEDAWKOWAĆ ]. Jeśli wystąpią drgawki związane z farmakoterapią, lek należy odstawić. Leczenie przeciwdrgawkowe można zastosować, jeśli jest to klinicznie wskazane.
INTERAKCJE Z LEKAMI
Karbamazepina
Po wprowadzeniu do obrotu zgłaszano podwyższony poziom karbamazepiny podczas jednoczesnego podawania cefiksymu. Monitorowanie leku może być pomocne w wykrywaniu zmian stężenia karbamazepiny w osoczu.
Warfaryna i antykoagulanty
Podczas jednoczesnego podawania cefiksymu zgłaszano wydłużenie czasu protrombinowego, z klinicznym krwawieniem lub bez niego.
Interakcje leków/testów laboratoryjnych
Fałszywie dodatnia reakcja na ketony w moczu może wystąpić w przypadku testów z użyciem nitroprusydku, ale nie w przypadku testów z użyciem nitrożelazicyjanku.
Podawanie cefiksymu może spowodować fałszywie dodatnią reakcję na glukozę w moczu przy użyciu Clinitest®, roztworu Benedicta lub roztworu Fehlinga. Zaleca się stosowanie testów glukozy opartych na enzymatycznych reakcjach oksydazy glukozy (takich jak Clinistix® lub TesTape®). Podczas leczenia innymi cefalosporynami zgłaszano fałszywie dodatni wynik bezpośredniego testu Coombsa; dlatego należy uznać, że pozytywny wynik testu Coombsa może być spowodowany lekiem.
OSTRZEŻENIA
Zawarte jako część ŚRODKI OSTROŻNOŚCI Sekcja.
ŚRODKI OSTROŻNOŚCI
Reakcje nadwrażliwości
Podczas stosowania cefiksymu zgłaszano reakcje anafilaktyczne/rzekomoanafilaktyczne (w tym wstrząs i zgony).
Przed rozpoczęciem leczenia preparatem SUPRAX należy przeprowadzić dokładne badanie w celu ustalenia, czy u pacjenta występowały w przeszłości reakcje nadwrażliwości na cefalosporyny, penicyliny lub inne leki. Jeśli ten produkt ma być podawany pacjentom wrażliwym na penicylinę, należy zachować ostrożność, ponieważ nadwrażliwość krzyżowa wśród leków przeciwbakteryjnych beta-laktamowych została wyraźnie udokumentowana i może wystąpić u do 10% pacjentów z alergią na penicylinę w wywiadzie. W przypadku wystąpienia reakcji alergicznej na SUPRAX 100mg należy odstawić lek.
Biegunka związana z Clostridium Difficile
Biegunkę związaną z Clostridium difficile (CDAD) zgłaszano po zastosowaniu prawie wszystkich środków przeciwbakteryjnych, w tym SUPRAX 200 mg, a jej nasilenie może wahać się od łagodnej biegunki do śmiertelnego zapalenia okrężnicy. Leczenie środkami przeciwbakteryjnymi zmienia normalną florę okrężnicy, prowadząc do przerostu C. difficile.
C. difficile wytwarza toksyny A i B, które przyczyniają się do rozwoju CDAD. Izolaty C. difficile wytwarzające hipertoksyny powodują zwiększoną zachorowalność i śmiertelność, ponieważ zakażenia te mogą być oporne na leczenie przeciwbakteryjne i mogą wymagać kolektomii. CDAD należy rozważyć u wszystkich pacjentów, u których po zastosowaniu leków przeciwbakteryjnych wystąpi biegunka. Konieczna jest staranna historia choroby, ponieważ donoszono, że CDAD występuje w ciągu dwóch miesięcy po podaniu leków przeciwbakteryjnych.
W przypadku podejrzenia lub potwierdzenia CDAD, może być konieczne przerwanie stosowania leków przeciwbakteryjnych, które nie są skierowane przeciwko C. difficile. Zgodnie ze wskazaniami klinicznymi należy wdrożyć odpowiednią gospodarkę wodno-elektrolitową, suplementację białka, leczenie przeciwbakteryjne C. difficile oraz ocenę chirurgiczną.
Dostosowanie dawki w niewydolności nerek
Dawkę preparatu SUPRAX 100 mg należy dostosować u pacjentów z zaburzeniami czynności nerek, a także poddawanych ciągłej ambulatoryjnej dializie otrzewnowej (CAPD) i hemodializie (HD). Pacjentów dializowanych należy uważnie monitorować [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Efekty koagulacji
Cefalosporyny, w tym SUPRAX 200mg, mogą wiązać się ze spadkiem aktywności protrombiny. Zagrożeni są pacjenci z zaburzeniami czynności nerek lub wątroby lub ze złym stanem odżywienia, a także pacjenci poddawani długotrwałej terapii przeciwdrobnoustrojowej oraz pacjenci uprzednio ustabilizowani na terapii przeciwzakrzepowej. U pacjentów z grupy ryzyka należy monitorować czas protrombinowy i podawać egzogenną witaminę K zgodnie ze wskazaniami.
Rozwój bakterii lekoopornych
Przepisywanie SUPRAX (cefiksymu) w przypadku braku potwierdzonego lub silnie podejrzewanego zakażenia bakteryjnego prawdopodobnie nie przyniesie korzyści pacjentowi i zwiększy ryzyko rozwoju bakterii lekoopornych.
Ryzyko u pacjentów z fenyloketonurią
Fenyloalanina może być szkodliwa dla pacjentów z fenyloketonurią (PKU). Suprax 200mg tabletki do żucia zawierają aspartam, źródło fenyloalaniny. Każda moc 100 mg, 150 mg i 200 mg zawiera odpowiednio 3,3 mg, 5 mg i 6,7 mg fenyloalaniny. Przed przepisaniem tabletek do żucia SUPRAX pacjentowi z PKU należy rozważyć łączną dzienną dawkę fenyloalaniny ze wszystkich źródeł, w tym tabletki do żucia SUPRAX 200 mg.
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Nie przeprowadzono badań na zwierzętach dotyczących całego okresu życia w celu oceny potencjału rakotwórczego. Cefiksym nie powodował mutacji punktowych w bakteriach lub komórkach ssaków, uszkodzeń DNA ani uszkodzeń chromosomów in vitro i nie wykazywał potencjału klastogennego in vivo w teście mikrojądrowym u myszy. U szczurów cefiksym w dawkach do 25 razy większych od dawki terapeutycznej dla dorosłych nie wpływał na płodność i zdolność rozrodczą szczurów.
Używaj w określonych populacjach
Ciąża
Ciąża Kategoria B
Badania nad reprodukcją przeprowadzono na myszach i szczurach przy dawkach do 40 razy większych od dawek stosowanych u ludzi i nie wykazały żadnych dowodów na szkodliwość cefiksymu dla płodu. Nie ma odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Ponieważ badania reprodukcji na zwierzętach nie zawsze pozwalają przewidzieć reakcję człowieka, lek ten powinien być stosowany w czasie ciąży tylko wtedy, gdy jest to bezwzględnie konieczne.
Praca i dostawa
Cefiksym nie był badany pod kątem stosowania podczas porodu i porodu. Leczenie należy podawać tylko wtedy, gdy jest to bezwzględnie konieczne.
Matki karmiące
Nie wiadomo, czy cefiksym przenika do mleka ludzkiego. Należy rozważyć czasowe przerwanie karmienia piersią podczas leczenia tym lekiem.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność cefiksymu u dzieci w wieku poniżej sześciu miesięcy nie zostały ustalone. Częstość występowania działań niepożądanych ze strony przewodu pokarmowego, w tym biegunki i luźnych stolców, u dzieci otrzymujących zawiesinę była porównywalna z częstością obserwowaną u dorosłych pacjentów otrzymujących tabletki.
Zastosowanie geriatryczne
Badania kliniczne nie obejmowały wystarczającej liczby osób w wieku 65 lat i starszych, aby ustalić, czy reagują inaczej niż osoby młodsze. Inne zgłoszone doświadczenia kliniczne nie wykazały różnic w odpowiedziach między pacjentami w podeszłym wieku i młodszymi. Badanie farmakokinetyczne u osób starszych wykazało różnice w parametrach farmakokinetycznych [patrz FARMAKOLOGIA KLINICZNA ]. Różnice te były niewielkie i nie wskazują na potrzebę dostosowania dawki leku u osób starszych.
Zaburzenia czynności nerek
Dawkę cefiksymu należy dostosować u pacjentów z zaburzeniami czynności nerek, a także u pacjentów poddawanych ciągłej ambulatoryjnej dializie otrzewnowej (CAPD) i hemodializie (HD). Pacjentów dializowanych należy uważnie monitorować [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
PRZEDAWKOWAĆ
Wskazane może być płukanie żołądka; w przeciwnym razie nie istnieje żadne specyficzne antidotum. Cefiksym nie jest usuwany w znaczących ilościach z krążenia za pomocą hemodializy lub dializy otrzewnowej. Działania niepożądane występujące u niewielkiej liczby zdrowych dorosłych ochotników otrzymujących pojedyncze dawki do 2 g cefiksymu nie różniły się od profilu obserwowanego u pacjentów leczonych zalecanymi dawkami.
PRZECIWWSKAZANIA
Suprax (cefiksym) jest przeciwwskazany u pacjentów z rozpoznaną alergią na cefiksym lub inne cefalosporyny.
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Cefiksym jest półsyntetycznym cefalosporynowym lekiem przeciwbakteryjnym [patrz Mikrobiologia ].
Farmakokinetyka
Tabletki do żucia SUPRAX 200 mg są biorównoważne zawiesinie doustnej.
Tabletki i zawiesina SUPRAX 200 mg, podawane doustnie, wchłaniają się w około 40% do 50%, niezależnie od tego, czy są podawane z jedzeniem, czy bez; jednak czas do maksymalnego wchłaniania wydłuża się o około 0,8 godziny przy podawaniu z pokarmem. Pojedyncza tabletka 200 mg cefiksymu powoduje średnie maksymalne stężenie w surowicy około 2 µg/ml (zakres od 1 do 4 µg/ml); pojedyncza tabletka 400 mg daje średnie stężenie maksymalne około 3,7 μg/ml (zakres od 1,3 do 7,7 μg/ml). Zawiesina doustna daje średnie maksymalne stężenia o około 25% do 50% wyższe niż tabletki podczas badania na normalnych dorosłych ochotnikach. Dwieście 400 mg dawki zawiesiny doustnej dają średnie maksymalne stężenia odpowiednio 3 µg/ml (zakres od 1 do 4,5 µg/ml) i 4,6 µg/ml (zakres od 1,9 do 7,7 µg/ml) podczas badania na zdrowych dorosłych ochotnikach . Pole pod krzywą czasu w funkcji stężenia (AUC) jest większe o około 10% do 25% w przypadku zawiesiny doustnej niż w przypadku tabletki po dawkach 100 do 400 mg, podczas badania na zdrowych dorosłych ochotnikach. Należy wziąć pod uwagę to zwiększone wchłanianie, jeśli tabletkę ma zastąpić zawiesina doustna. Ze względu na brak biorównoważności w leczeniu zapalenia ucha środkowego nie należy zastępować tabletek zawiesiną doustną [patrz DAWKOWANIE I SPOSÓB PODAWANIA ]. Nie przeprowadzono badań krzyżowych dotyczących tabletek i zawiesiny u dzieci.
Kapsułka 400 mg jest biorównoważna tabletce 400 mg na czczo. Jednak pokarm zmniejsza wchłanianie po podaniu kapsułki o około 15% w oparciu o AUC i 25% w oparciu o Cmax.
Maksymalne stężenie w surowicy występuje pomiędzy 2 a 6 godzinami po doustnym podaniu pojedynczej tabletki 200 mg, pojedynczej tabletki 400 mg lub 400 mg zawiesiny cefiksymu. Maksymalne stężenia w surowicy występują między 2 a 5 godzinami po jednorazowym podaniu 200 mg zawiesiny. Maksymalne stężenia w surowicy występują między 3 a 8 godzinami po doustnym podaniu pojedynczej kapsułki 400 mg.
Dystrybucja
Wiązanie z białkami surowicy jest niezależne od stężenia, z frakcją związaną około 65%. W badaniu z dawką wielokrotną, przeprowadzonym z preparatem badawczym, który jest mniej biodostępny niż tabletka lub zawiesina, stwierdzono niewielką kumulację leku w surowicy lub moczu po dawkowaniu przez 14 dni. Nie są dostępne odpowiednie dane dotyczące poziomów cefiksymu w płynie mózgowo-rdzeniowym.
Metabolizm i wydalanie
Nie ma dowodów na metabolizm cefiksymu in vivo. Około 50% wchłoniętej dawki jest wydalane w postaci niezmienionej z moczem w ciągu 24 godzin. W badaniach na zwierzętach zauważono, że cefiksym jest również wydalany z żółcią w ilości przekraczającej 10% podanej dawki. Okres półtrwania cefiksymu w surowicy u zdrowych osób jest niezależny od postaci dawkowania i wynosi średnio od 3 do 4 godzin, ale u niektórych zdrowych ochotników może wynosić do 9 godzin.
Specjalne populacje
Geriatria
Średnie AUC w stanie stacjonarnym u pacjentów w podeszłym wieku są o około 40% wyższe niż średnie AUC u innych zdrowych osób dorosłych. Różnice w parametrach farmakokinetycznych między 12 młodymi i 12 osobami w podeszłym wieku, którzy otrzymywali 400 mg cefiksymu raz na dobę przez 5 dni, podsumowano w następujący sposób:
Jednak wzrosty te nie były istotne klinicznie [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Zaburzenia czynności nerek
U osób z umiarkowanymi zaburzeniami czynności nerek (klirens kreatyniny od 20 do 40 ml/min) średni okres półtrwania cefiksymu w surowicy wydłuża się do 6,4 godziny. W ciężkich zaburzeniach czynności nerek (klirens kreatyniny od 5 do 20 ml/min) okres półtrwania wydłuża się średnio do 11,5 godziny. Lek nie jest znacząco usuwany z krwi przez hemodializę lub dializę otrzewnową. Jednak badanie wykazało, że przy dawkach 400 mg pacjenci poddawani hemodializie mają podobny profil krwi jak pacjenci z klirensem kreatyniny od 21 do 60 ml/min.
Mikrobiologia
Mechanizm akcji
Podobnie jak w przypadku innych cefalosporyn, działanie bakteriobójcze cefiksymu wynika z hamowania syntezy ściany komórkowej. Cefiksym jest stabilny w obecności niektórych enzymów beta-laktamaz. W rezultacie niektóre organizmy oporne na penicyliny i niektóre cefalosporyny ze względu na obecność betalaktamaz mogą być wrażliwe na cefiksym.
Opór
Oporność na cefiksym izolatów Haemophilus influenzae i Neisseria gonorrhoeae jest najczęściej związana ze zmianami w białkach wiążących penicylinę (PBP). Cefiksym może mieć ograniczoną aktywność wobec Enterobacteriaceae wytwarzających beta-laktamazy o rozszerzonym spektrum (ESBL). Pseudomonas spp., Enterococcus sp., szczepy paciorkowców grupy D, Listeria monocytogenes, większość szczepów gronkowców (w tym szczepy oporne na metycylinę), większość szczepów Enterobacter, większość szczepów Bacteroides fragilis i większość szczepów gatunków Clostridium jest oporna na cefiksym.
Aktywność przeciwbakteryjna
Wykazano, że cefiksym działa na większość izolatów następujących drobnoustrojów, zarówno in vitro, jak i w zakażeniach klinicznych [patrz WSKAZANIA ].
Bakterie Gram-dodatnie
Streptococcus pneumoniae Streptococcus pyogenes
Bakterie Gram-ujemne
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Dostępne są następujące dane in vitro, ale ich znaczenie kliniczne nie jest znane. Co najmniej 90 procent następujących bakterii wykazuje in vitro minimalne stężenie hamujące (MIC) mniejsze lub równe wartości granicznej wrażliwości dla cefiksymu wobec izolatów podobnego rodzaju lub grupy organizmów. Jednak skuteczność cefiksymu w leczeniu zakażeń klinicznych wywołanych przez te bakterie nie została ustalona w odpowiednich i dobrze kontrolowanych badaniach klinicznych.
Bakterie Gram-dodatnie
Streptococcus agalactiae
Bakterie Gram-ujemne
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Gatunek Providencia Gatunek Salmonella Gatunek Serratia marcescens Gatunek Shigella
Testy podatności
Szczegółowe informacje dotyczące kryteriów interpretacyjnych testu wrażliwości i powiązanych metod badawczych oraz standardów kontroli jakości uznanych przez FDA dla tego leku można znaleźć na stronie: https://www.fda.gov/STIC.
Studia kliniczne
Porównawcze badania kliniczne zapalenia ucha środkowego przeprowadzono u prawie 400 dzieci w wieku od 6 miesięcy do 10 lat. Streptococcus pneumoniae wyizolowano od 47% pacjentów, Haemophilus influenzae od 34%, Moraxella catarrhalis od 15% i S. pyogenes od 4%.
Całkowity odsetek odpowiedzi Streptococcus pneumoniae na cefiksym był o około 10% niższy, a Haemophilus influenzae lub Moraxella catarrhalis o około 7% wyższy (12% w przypadku włączenia beta-laktamazy izolatów H. influenzae) niż odsetek odpowiedzi tych drobnoustrojów na aktywne leki kontrolne.
badaniach tych pacjentów przydzielono losowo i leczono albo cefiksymem w dawkach 4 mg/kg dwa razy na dobę lub 8 mg/kg raz na dobę, albo lekiem porównawczym. U sześćdziesięciu dziewięciu do 70% pacjentów w każdej grupie ustąpiły oznaki i objawy zapalenia ucha środkowego podczas oceny 2 do 4 tygodni po leczeniu, ale utrzymujący się wysięk stwierdzono u 15% pacjentów. W ocenie po zakończeniu leczenia 17% pacjentów otrzymujących cefiksym i 14% pacjentów otrzymujących skuteczne leki porównawcze (18%, w tym pacjentów z Haemophilus influenzae opornym na lek kontrolny i którzy otrzymali kontrolny lek przeciwbakteryjny) uznano za chorych niepowodzenia leczenia. W okresie obserwacji trwającym od 2 do 4 tygodni, w sumie 30%-31% pacjentów miało oznaki niepowodzenia leczenia lub nawrotu choroby.
Wynik bakteriologiczny zapalenia ucha środkowego po dwóch do czterech tygodniach po terapii na podstawie powtórnego ucha środkowego
INFORMACJA O PACJENCIE
Poinformuj pacjentów, że leki przeciwbakteryjne, w tym cefiksym, powinny być stosowane wyłącznie w leczeniu zakażeń bakteryjnych. Nie leczą infekcji wirusowych (np. przeziębienia). Kiedy cefiksym jest przepisywany w celu leczenia infekcji bakteryjnej, należy poinformować pacjentów, że chociaż powszechne jest samopoczucie na początku leczenia, lek należy przyjmować dokładnie zgodnie z zaleceniami. Pomijanie dawek lub nieukończenie pełnego cyklu leczenia może: (1) zmniejszyć skuteczność natychmiastowego leczenia i (2) zwiększyć prawdopodobieństwo, że bakterie rozwiną oporność i nie będą mogły być wyleczone cefiksymem w postaci zawiesiny doustnej lub cefiksymem w postaci tabletek do żucia lub innych leki przeciwbakteryjne w przyszłości.
Należy poinformować pacjentów z fenyloketonurią, że tabletki do żucia SUPRAX 200 mg zawierają aspartam, źródło fenyloalaniny, w następujący sposób: Każda tabletka do żucia SUPRAX zawiera odpowiednio 3,3 mg, 5 mg i 6,7 mg fenyloalaniny na 100 mg, 150 mg i 200 mg mocy.
Poinformuj pacjentów, że biegunka jest częstym problemem powodowanym przez leki przeciwbakteryjne, który zwykle kończy się po odstawieniu leku przeciwbakteryjnego. Czasami po rozpoczęciu leczenia lekami przeciwbakteryjnymi u pacjentów mogą pojawić się wodniste i krwawe stolce (ze skurczami żołądka i gorączką lub bez), nawet po dwóch lub więcej miesiącach od przyjęcia ostatniej dawki leku przeciwbakteryjnego. W takim przypadku pacjenci powinni jak najszybciej skontaktować się z lekarzem.
