Actos 15mg, 30mg Pioglitazone Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Actos i jak jest używany?
Actos 15mg to lek na receptę stosowany w leczeniu objawów cukrzycy typu 2. Actos może być stosowany samodzielnie lub z innymi lekami.
Actos jest lekiem przeciwcukrzycowym, tiazolidynodionami.
Nie wiadomo, czy Actos 15 mg jest bezpieczny i skuteczny u dzieci.
Jakie są możliwe skutki uboczne Actosu 15mg?
Actos może powodować poważne skutki uboczne, w tym:
- duszność (szczególnie podczas leżenia),
- niezwykłe zmęczenie,
- obrzęk,
- szybki przyrost masy ciała,
- różowy lub czerwony mocz,
- bolesne lub utrudnione oddawanie moczu,
- nowa lub nasilająca się potrzeba oddania moczu,
- zmiany widzenia i
- nagły, niezwykły ból dłoni, ramienia lub stopy
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Actos to:
- ból głowy,
- ból mięśni i
- objawy przeziębienia (zatkany nos, ból zatok, kichanie, ból gardła)
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
To nie wszystkie możliwe skutki uboczne Actosu. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OSTRZEŻENIE
ZASTOWANA NIEWYDAJNOŚĆ SERCA
- Tiazolidynodiony, w tym ACTOS 15 mg, powodują lub nasilają zastoinową niewydolność serca u niektórych pacjentów [patrz OSTRZEŻENIA I ŚRODKI ].
- Po rozpoczęciu podawania ACTOS 30 mg i po zwiększeniu dawki należy uważnie monitorować pacjentów pod kątem oznak i objawów niewydolności serca (np. nadmiernego, szybkiego przyrostu masy ciała, duszności i (lub) obrzęku). Jeśli rozwinie się niewydolność serca, należy ją leczyć zgodnie z obowiązującymi standardami postępowania i rozważyć przerwanie lub zmniejszenie dawki ACTOS 15 mg.
- ACTOS nie jest zalecany u pacjentów z objawową niewydolnością serca.
- Rozpoczęcie ACTOS u pacjentów z rozpoznaną niewydolnością serca klasy III lub IV według New York Heart Association (NYHA) jest przeciwwskazane [patrz PRZECIWWSKAZANIA oraz OSTRZEŻENIA I ŚRODKI ].
OPIS
Tabletki ACTOS są tiazolidynodionem i agonistą receptora aktywowanego przez proliferatory peroksysomów (PPAR) gamma, który zawiera doustny lek przeciwcukrzycowy: pioglitazon.
Monochlorowodorek pioglitazonu [(±)-5-[[4-[2-(5-etylo-2-pirydynylo)etoksy]fenylo]metylo]-2,4-]tiazolidynodion zawiera jeden asymetryczny węgiel, a związek jest syntetyzowany i stosowany jako mieszanina racemiczna. Dwa enancjomery pioglitazonu ulegają interkonwersji in vivo. Nie stwierdzono różnic w aktywności farmakologicznej obu enancjomerów. Wzór strukturalny jest następujący:
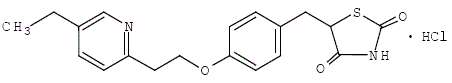
Chlorowodorek pioglitazonu jest bezwonnym białym krystalicznym proszkiem o wzorze cząsteczkowym C19H20N2O3S•HCl i masie cząsteczkowej 392,90 daltonów. Jest rozpuszczalny w N,Ndimetyloformamidzie, słabo rozpuszczalny w bezwodnym etanolu, bardzo słabo rozpuszczalny w acetonie i acetonitrylu, praktycznie nierozpuszczalny w wodzie i nierozpuszczalny w eterze.
ACTOS jest dostępny w postaci tabletki do podawania doustnego zawierającej 15 mg, 30 mg lub 45 mg pioglitazonu (jako bazy) w składzie z następującymi substancjami pomocniczymi: monohydrat laktozy 30 mg NF, hydroksypropyloceluloza NF, karboksymetyloceluloza NF wapnia i stearynian magnezu NF.
WSKAZANIA
Monoterapia i terapia skojarzona
ACTOS 30 mg jest wskazany jako dodatek do diety i ćwiczeń fizycznych w celu poprawy kontroli glikemii u dorosłych z cukrzycą typu 2 w wielu warunkach klinicznych [patrz Studia kliniczne ].
Ważne ograniczenia użytkowania
ACTOS 15mg działa przeciwhiperglikemicznie tylko w obecności insuliny endogennej. ACTOS 30 mg nie powinien być stosowany w leczeniu cukrzycy typu 1 ani cukrzycowej kwasicy ketonowej, ponieważ nie byłby skuteczny w takich warunkach.
Należy zachować ostrożność u pacjentów z chorobami wątroby [patrz OSTRZEŻENIA I ŚRODKI ].
DAWKOWANIE I SPOSÓB PODAWANIA
Zalecenia dla wszystkich pacjentów
ACTOS 15 mg należy przyjmować raz na dobę i można go przyjmować niezależnie od posiłków.
Zalecana dawka początkowa dla pacjentów bez zastoinowej niewydolności serca wynosi 15 mg lub 30 mg raz na dobę.
Zalecana dawka początkowa dla pacjentów z zastoinową niewydolnością serca (klasa I lub II wg NYHA) wynosi 15 mg raz na dobę.
Dawkę można stopniowo zwiększać o 15 mg do maksymalnie 45 mg raz na dobę w oparciu o odpowiedź glikemiczną określoną za pomocą HbA1c.
Po rozpoczęciu leczenia ACTOS 30 mg lub po zwiększeniu dawki należy uważnie monitorować pacjentów pod kątem działań niepożądanych związanych z zatrzymaniem płynów, takich jak przyrost masy ciała, obrzęk oraz objawy przedmiotowe i podmiotowe zastoinowej niewydolności serca [patrz PUDEŁKO OSTRZEŻENIE oraz OSTRZEŻENIA I ŚRODKI ].
Przed rozpoczęciem leczenia ACTOS należy wykonać testy wątrobowe (surowicze aminotransferazy alaninowe i asparaginianowe, fosfataza alkaliczna i stężenie bilirubiny całkowitej). Nie zaleca się rutynowego okresowego monitorowania testów wątrobowych podczas leczenia preparatem ACTOS 30 mg u pacjentów bez chorób wątroby. U pacjentów z nieprawidłowymi wynikami testów wątrobowych przed rozpoczęciem leczenia ACTOS lub u których stwierdzono nieprawidłowe wyniki testów wątrobowych podczas przyjmowania leku ACTOS należy postępować zgodnie z opisem w części Ostrzeżenia i środki ostrożności [patrz OSTRZEŻENIA I ŚRODKI oraz FARMAKOLOGIA KLINICZNA ].
Jednoczesne stosowanie z sekretagogiem insuliny lub insuliną
W przypadku wystąpienia hipoglikemii u pacjenta, któremu jednocześnie podawano ACTOS 30 mg i środek pobudzający wydzielanie insuliny (np. pochodną sulfonylomocznika), należy zmniejszyć dawkę tego środka pobudzającego wydzielanie insuliny.
W przypadku wystąpienia hipoglikemii u pacjenta, któremu jednocześnie podawano ACTOS 30 mg i insulinę, dawkę insuliny należy zmniejszyć o 10% do 25%. Dalsze modyfikacje dawki insuliny należy ustalać indywidualnie na podstawie odpowiedzi glikemicznej.
Jednoczesne stosowanie z silnymi inhibitorami CYP2C8
Jednoczesne podawanie preparatu ACTOS 30 mg i gemfibrozylu, silnego inhibitora CYP2C8, zwiększa około 3-krotnie ekspozycję na pioglitazon. Dlatego maksymalna zalecana dawka preparatu ACTOS wynosi 15 mg na dobę w przypadku stosowania w skojarzeniu z gemfibrozylem lub innymi silnymi inhibitorami CYP2C8 [patrz INTERAKCJE Z LEKAMI oraz FARMAKOLOGIA KLINICZNA ].
JAK DOSTARCZONE
Formy dawkowania i mocne strony
Okrągła tabletka zawiera następujący pioglitazon:
- 15 mg: biały do złamanej bieli, z wytłoczonym napisem „ACTOS” po jednej stronie i „15” po drugiej
- 30 mg: kolor biały do złamanej bieli, z wytłoczonym napisem „ACTOS” po jednej stronie i „30” po drugiej
- 45 mg: biały do złamanej bieli, z wytłoczonym napisem „ACTOS” po jednej stronie i „45” po drugiej
Składowania i stosowania
ACTOS jest dostępny w tabletkach 15 mg, 30 mg i 45 mg w następujący sposób:
Tabletka 15 mg : Białe lub prawie białe, okrągłe, wypukłe tabletki bez rowka dzielącego z napisem „ACTOS” po jednej stronie i „15” po drugiej stronie, dostępne w:
NDC 64764-151-04 Butelki 30 NDC 64764-151-05 Butelki 90 NDC 64764-151-06 Butelki 500
Tabletka 30 mg Białe lub prawie białe, okrągłe, płaskie tabletki bez rowka dzielącego z napisem „ACTOS” po jednej stronie i „30” po drugiej, dostępne w:
NDC 64764-301-14 Butelki 30 NDC 64764-301-15 Butelki 90 NDC 64764-301-16 Butelki 500
Tabletka 45 mg : Białe lub prawie białe, okrągłe, płaskie tabletki bez rowka dzielącego z napisem „ACTOS” po jednej stronie i „45” po drugiej, dostępne w:
NDC 64764-451-24 Butelki 30 NDC 64764-451-25 Butelki 90 NDC 64764-451-26 Butelki 500
Magazynowanie
Przechowywać w 25°C (77°F); dopuszczalne odchylenia do 15-30°C (59-86°F) [patrz Kontrolowana temperatura pokojowa USP]. Przechowywać pojemnik szczelnie zamknięty i chronić przed światłem, wilgocią i wilgocią.
Dystrybutor: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Wersja: grudzień 2017 r.
SKUTKI UBOCZNE
Następujące poważne działania niepożądane omówiono w innym miejscu na etykiecie:
- Zastoinowa niewydolność serca [patrz PUDEŁKO OSTRZEŻENIE oraz OSTRZEŻENIA I ŚRODKI ]
- Obrzęk [patrz OSTRZEŻENIA I ŚRODKI ]
- Złamania [patrz OSTRZEŻENIA I ŚRODKI ]
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
Ponad 8500 pacjentów z cukrzycą typu 2 leczono preparatem ACTOS w randomizowanych, podwójnie zaślepionych, kontrolowanych badaniach klinicznych, w tym 2605 pacjentów z cukrzycą typu 2 i chorobą makronaczyniową leczonych preparatem ACTOS 30 mg w badaniu klinicznym PROactive. W badaniach tych ponad 6000 pacjentów było leczonych preparatem ACTOS przez sześć miesięcy lub dłużej, ponad 4500 pacjentów leczono preparatem ACTOS 15 mg przez rok lub dłużej, a ponad 3000 pacjentów leczono preparatem ACTOS przez co najmniej dwa lata.
sześciu połączonych 16-26-tygodniowych badaniach z grupą kontrolną otrzymującą placebo w monoterapii i 16-24-tygodniowych badaniach terapii skojarzonej z leczeniem skojarzonym częstość rezygnacji z leczenia z powodu działań niepożądanych wynosiła 4,5% u pacjentów leczonych ACTOS 30 mg i 5,8% w przypadku leku porównawczego. leczonych pacjentów. Najczęstsze zdarzenia niepożądane prowadzące do odstawienia były związane z niewystarczającą kontrolą glikemii, chociaż częstość tych zdarzeń była mniejsza (1,5%) w przypadku ACTOS 30 mg niż w przypadku placebo (3,0%).
W badaniu PROactive częstość rezygnacji z leczenia z powodu zdarzeń niepożądanych wynosiła 9,0% u pacjentów leczonych preparatem ACTOS 30 mg i 7,7% u pacjentów otrzymujących placebo. Zastoinowa niewydolność serca była najczęstszym poważnym zdarzeniem niepożądanym prowadzącym do odstawienia, występującym u 1,3% pacjentów leczonych ACTOS 30 mg i 0,6% pacjentów otrzymujących placebo.
Częste zdarzenia niepożądane: 16-26-tygodniowe próby monoterapii
Podsumowanie częstości występowania i rodzaju częstych zdarzeń niepożądanych zgłoszonych w trzech połączonych 16-26-tygodniowych badaniach ACTOS z grupą kontrolną otrzymującą placebo w monoterapii przedstawiono w Tabeli 1. Zgłaszane terminy to te, które wystąpiły z częstością >5% i częściej u pacjentów leczonych ACTOS 15 mg niż u pacjentów otrzymujących placebo. Żadne z tych działań niepożądanych nie było związane z dawką ACTOS.
Częste zdarzenia niepożądane: 16-24-tygodniowe próby terapii skojarzonej w terapii skojarzonej
Podsumowanie ogólnej częstości występowania i rodzajów częstych zdarzeń niepożądanych zgłaszanych w badaniach dotyczących skojarzenia ACTOS z pochodną sulfonylomocznika przedstawiono w Tabeli 2. Zgłaszane terminy reprezentują te, które wystąpiły z częstością >5% i częściej przy najwyższej badanej grupie. dawka leku ACTOS.
Podsumowanie ogólnej częstości występowania i rodzajów częstych zdarzeń niepożądanych zgłaszanych w badaniach dotyczących skojarzenia ACTOS 30 mg z metforminą przedstawiono w Tabeli 3. Zgłaszane terminy reprezentują te, które wystąpiły z częstością >5% i częściej z najwyższą przetestowana dawka ACTOS.
W Tabeli 4 zestawiono częstość występowania i rodzaje częstych zdarzeń niepożądanych zgłaszanych w badaniach dotyczących skojarzenia ACTOS z insuliną. Zgłoszone terminy reprezentują te, które wystąpiły z częstością >5% i częściej przy najwyższej testowanej dawce ACTOS.
Podsumowanie ogólnej częstości występowania i rodzajów częstych zdarzeń niepożądanych zgłaszanych w badaniu PROactive przedstawiono w Tabeli 5. Zgłaszane terminy reprezentują te, które wystąpiły z częstością >5% i częściej u pacjentów leczonych preparatem ACTOS niż u pacjentów, którzy otrzymywał placebo.
Zastoinowa niewydolność serca
Podsumowanie częstości występowania zdarzeń niepożądanych związanych z zastoinową niewydolnością serca przedstawiono w Tabeli 6 dla badań skojarzonych z dodatek do badań z metforminą trwający od 16 do 24 tygodni. Żadne z wydarzeń nie było śmiertelne.
Pacjenci z cukrzycą typu 2 i wczesną zastoinową niewydolnością serca w klasie II lub III wg NYHA zostali losowo przydzieleni do 24-tygodniowego leczenia metodą podwójnie ślepej próby ACTOS 30 mg w dawkach dobowych od 30 mg do 45 mg (n=262) lub gliburydem w dawkach dobowych od 10 mg do 15 mg (n=256). Podsumowanie częstości występowania zdarzeń niepożądanych związanych z zastoinową niewydolnością serca zgłoszonych w tym badaniu przedstawiono w Tabeli 7.
Zdarzenia zastoinowej niewydolności serca prowadzące do hospitalizacji, które wystąpiły podczas badania PROactive, podsumowano w Tabeli 8.
Bezpieczeństwo sercowo-naczyniowe
badaniu PROactive 5238 pacjentów z cukrzycą typu 2 i chorobą makronaczyniową w wywiadzie zostało losowo przydzielonych do grupy ACTOS (N=2605), miareczkowanej na siłę do 45 mg na dobę lub placebo (N=2633) oprócz standardowego leczenia. Prawie wszyscy pacjenci (95%) otrzymywali leki sercowo-naczyniowe (beta-blokery, inhibitory ACE, blokery receptora angiotensyny II, blokery kanału wapniowego, azotany, diuretyki, aspirynę, statyny i fibraty). Wyjściowo średni wiek pacjentów wynosił 62 lata, średni czas trwania cukrzycy 9,5 roku, a średnia HbA1c wynosiła 8,1%. Średni czas obserwacji wyniósł 34,5 miesiąca. Głównym celem tego badania było zbadanie wpływu ACTOS na śmiertelność i zachorowalność na makroangiopatię u pacjentów z cukrzycą typu 2, którzy byli obarczeni wysokim ryzykiem wystąpienia makroangiopatii. Pierwszorzędową zmienną skuteczności był czas do pierwszego wystąpienia jakiegokolwiek zdarzenia w złożonym punkcie końcowym sercowo-naczyniowym, który obejmował zgon z jakiejkolwiek przyczyny, zawał mięśnia sercowego (MI) niezakończony zgonem, w tym niemy MI, udar, ostry zespół wieńcowy, interwencję kardiologiczną, w tym pomostowanie aortalno-wieńcowe lub interwencja przezskórna, amputacja dużej nogi powyżej kostki i operacja pomostowania lub rewaskularyzacja w nodze. Łącznie 514 (19,7%) pacjentów leczonych preparatem ACTOS 15 mg i 572 (21,7%) pacjentów otrzymujących placebo doświadczyło przynajmniej jednego zdarzenia z pierwszorzędowego złożonego punktu końcowego (współczynnik ryzyka 0,90; 95% przedział ufności: 0,80; 1,02; p=0,10 ).
Chociaż nie było statystycznie istotnej różnicy między ACTOS a placebo w trzyletniej częstości występowania pierwszego zdarzenia w tym zestawieniu, nie zaobserwowano wzrostu śmiertelności ani całkowitej liczby zdarzeń makronaczyniowych w przypadku ACTOS. Liczbę pierwszych wystąpień i łączną liczbę pojedynczych zdarzeń przyczyniających się do pierwszorzędowego złożonego punktu końcowego przedstawiono w Tabeli 9.
Przybranie na wadze
Przyrost masy ciała zależny od dawki występuje, gdy ACTOS 30 mg jest stosowany samodzielnie lub w połączeniu z innymi lekami przeciwcukrzycowymi. Mechanizm przybierania na wadze jest niejasny, ale prawdopodobnie obejmuje kombinację retencji płynów i gromadzenia tłuszczu.
W tabelach 10 i 11 podsumowano zmiany masy ciała po zastosowaniu ACTOS i placebo w trwających od 16 do 26 tygodni randomizowanych, podwójnie zaślepionych badaniach dotyczących monoterapii i trwających od 16 do 24 tygodni skojarzonych terapii skojarzonych oraz w badaniu PROactive.
Obrzęk
Obrzęki wywołane przyjmowaniem leku ACTOS ustępują po odstawieniu leku ACTOS. Obrzęk zwykle nie wymaga hospitalizacji, chyba że współistnieje zastoinowa niewydolność serca. Podsumowanie częstości i rodzajów obrzęków występujących w badaniach klinicznych preparatu ACTOS 30 mg przedstawiono w Tabeli 12.
Wpływ na wątrobę
Jak dotąd w bazie danych kontrolowanych badań klinicznych ACTOS nie ma dowodów na indukowaną hepatotoksyczność przez ACTOS. Jedno randomizowane, prowadzone metodą podwójnie ślepej próby 3-letnie badanie porównujące ACTOS 15 mg z gliburydem jako dodatek do terapii metforminą i insuliną zostało zaprojektowane specjalnie w celu oceny częstości występowania zwiększonej aktywności AlAT w surowicy ponad trzykrotność górnej granicy zakresu referencyjnego, mierzonej co osiem tygodni przez pierwsze 48 tygodni badania, a następnie co 12 tygodni. Łącznie 3/1051 (0,3%) pacjentów leczonych ACTOS i 9/1046 (0,9%) pacjentów leczonych gliburydem rozwinęło wartości AlAT przekraczające trzykrotnie górną granicę zakresu referencyjnego. Żaden z pacjentów leczonych preparatem ACTOS w bazie danych kontrolowanych badań klinicznych ACTOS do tej pory nie miał aktywności AlAT w surowicy przekraczającej trzykrotnie górną granicę zakresu kombinacja pozwalająca na przewidzenie potencjalnego ciężkiego polekowego uszkodzenia wątroby.
Hipoglikemia
W badaniach klinicznych ACTOS 15 mg zdarzenia niepożądane hipoglikemii zgłaszano na podstawie oceny klinicznej badaczy i nie wymagały potwierdzenia za pomocą badania stężenia glukozy z opuszki palca.
W 16-tygodniowym badaniu skojarzonym z pochodnymi sulfonylomocznika częstość występowania zgłoszonej hipoglikemii wyniosła 3,7% w grupie ACTOS 30 mg i 0,5% w grupie placebo. W 16-tygodniowym badaniu z dodawaniem insuliny częstość zgłaszanej hipoglikemii wynosiła 7,9% dla ACTOS 15 mg, 15,4% dla ACTOS 30 mg i 4,8% dla placebo.
Częstość występowania zgłoszonej hipoglikemii była wyższa w przypadku ACTOS 45 mg w porównaniu z ACTOS 30 mg zarówno w 24-tygodniowym badaniu skojarzenia z pochodną sulfonylomocznika (15,7% vs 13,4%), jak i w 24-tygodniowym badaniu skojarzenia z insuliną (47,8). % wobec 43,5%).
Trzech pacjentów w tych czterech badaniach było hospitalizowanych z powodu hipoglikemii. Wszyscy trzej pacjenci otrzymywali ACTOS 30 mg (0,9%) w 24-tygodniowej próbie leczenia skojarzonego z insuliną. Dodatkowych 14 pacjentów zgłosiło ciężką hipoglikemię (definiowaną jako powodująca znaczne zakłócenie zwykłych czynności pacjenta), która nie wymagała hospitalizacji. Pacjenci ci otrzymywali ACTOS 45 mg w skojarzeniu z sulfonylomocznikiem (n=2) lub ACTOS 30 mg lub 45 mg w skojarzeniu z insuliną (n=12).
Guzy pęcherza moczowego
W dwuletnim badaniu rakotwórczości w pęcherzu moczowym samców szczurów zaobserwowano nowotwory [patrz Toksykologia niekliniczna ]. Podczas trzyletniego badania klinicznego PROactive u 14 z 2605 (0,54%) pacjentów przydzielonych losowo do grupy ACTOS i u 5 z 2633 (0,19%) przydzielonych losowo do grupy placebo zdiagnozowano raka pęcherza moczowego. Po wykluczeniu pacjentów, u których ekspozycja na badany lek była krótsza niż jeden rok w momencie rozpoznania raka pęcherza moczowego, było 6 (0,23%) przypadków w grupie ACTOS 15 mg i dwa (0,08%) w grupie placebo. Po zakończeniu badania dużą podgrupę pacjentów obserwowano przez okres do 10 dodatkowych lat, z niewielką dodatkową ekspozycją na ACTOS. W ciągu 13 lat obserwacji PROactive i obserwacyjnej występowanie raka pęcherza moczowego nie różniło się między pacjentami przydzielonymi losowo do grupy ACTOS lub placebo (HR = 1,00; 95% CI: 0,59-1,72) [patrz OSTRZEŻENIA I ŚRODKI ].
Nieprawidłowości laboratoryjne
Efekty hematologiczne
ACTOS 15 mg może powodować zmniejszenie stężenia hemoglobiny i hematokrytu. W kontrolowanych placebo badaniach dotyczących monoterapii średnie wartości hemoglobiny spadły o 2% do 4% u pacjentów leczonych ACTOS w porównaniu ze średnią zmianą stężenia hemoglobiny od -1% do +1% u pacjentów otrzymujących placebo. Zmiany te występowały głównie w ciągu pierwszych 4 do 12 tygodni terapii i po tym czasie pozostawały względnie stałe. Zmiany te mogą być związane ze zwiększoną objętością osocza związaną z leczeniem preparatem ACTOS 30 mg i prawdopodobnie nie będą związane z jakimikolwiek klinicznie istotnymi skutkami hematologicznymi.
Fosfokinaza kreatynowa
Podczas określonego protokołem pomiaru stężenia fosfokinazy kreatynowej w surowicy (CPK) w badaniach klinicznych ACTOS 15 mg, pojedyncze zwiększenie CPK do ponad 10-krotności górnej granicy zakresu referencyjnego odnotowano u dziewięciu (0,2%) pacjentów leczonych ACTOS (wartości 2150 do 11400 j.m./l) i u pacjentów nie leczonych lekiem porównawczym. Sześciu z tych dziewięciu pacjentów nadal otrzymywało ACTOS 15 mg, u dwóch odnotowano wzrost CPK w ostatnim dniu dawkowania, a jeden pacjent odstawił ACTOS z powodu tego wzrostu. Te podwyższenia ustąpiły bez widocznych następstw klinicznych. Związek tych zdarzeń z terapią ACTOS 30 mg jest nieznany.
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane podczas stosowania produktu ACTOS po dopuszczeniu do obrotu. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, na ogół nie jest możliwe wiarygodne oszacowanie ich częstości ani ustalenie związku przyczynowego z ekspozycją na lek.
- Pojawienie się lub pogorszenie cukrzycowego obrzęku plamki z obniżoną ostrością wzroku [patrz OSTRZEŻENIA I ŚRODKI ].
- Śmiertelna i niezakończona zgonem niewydolność wątroby [patrz OSTRZEŻENIA I ŚRODKI ].
Po wprowadzeniu produktu do obrotu zgłaszano przypadki zastoinowej niewydolności serca u pacjentów leczonych preparatem ACTOS, zarówno z rozpoznaną wcześniej chorobą serca, jak i bez, oraz z jednoczesnym podawaniem insuliny lub bez.
W doświadczeniach po wprowadzeniu produktu do obrotu zgłaszano niezwykle szybkie przyrosty masy ciała oraz wzrosty przekraczające wartości zwykle obserwowane w badaniach klinicznych. Pacjenci, u których występuje taki wzrost, powinni być oceniani pod kątem gromadzenia się płynów i zdarzeń związanych z objętością, takich jak nadmierny obrzęk i zastoinowa niewydolność serca [patrz PUDEŁKO OSTRZEŻENIE oraz OSTRZEŻENIA I ŚRODKI ].
INTERAKCJE Z LEKAMI
Silne inhibitory CYP2C8
Inhibitor CYP2C8 (np. gemfibrozyl) znacząco zwiększa ekspozycję (obszar pod krzywą stężenia w surowicy-czas lub AUC) i okres półtrwania (t½) pioglitazonu. Dlatego maksymalna zalecana dawka preparatu ACTOS wynosi 15 mg na dobę, jeśli jest stosowany w skojarzeniu z gemfibrozylem lub innymi silnymi inhibitorami CYP2C8 [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ].
Induktory CYP2C8
Induktor CYP2C8 (np. ryfampicyna) może znacząco zmniejszyć ekspozycję (AUC) na pioglitazon. Dlatego też, jeśli induktor CYP2C8 zostanie uruchomiony lub zatrzymany podczas leczenia ACTOS 30 mg, mogą być konieczne zmiany w leczeniu cukrzycy w oparciu o odpowiedź kliniczną, bez przekraczania maksymalnej zalecanej dawki dobowej 45 mg dla ACTOS [patrz FARMAKOLOGIA KLINICZNA ].
Topiramat
Podczas jednoczesnego podawania pioglitazonu i topiramatu odnotowano zmniejszenie ekspozycji na pioglitazon i jego aktywne metabolity [patrz FARMAKOLOGIA KLINICZNA ]. Kliniczne znaczenie tego zmniejszenia jest nieznane; jednak, gdy ACTOS i topiramat są stosowane jednocześnie, należy monitorować pacjentów pod kątem odpowiedniej kontroli glikemii.
OSTRZEŻENIA
Zawarte jako część "ŚRODKI OSTROŻNOŚCI" Sekcja
ŚRODKI OSTROŻNOŚCI
Zastoinowa niewydolność serca
ACTOS 15 mg, podobnie jak inne tiazolidynodiony, może powodować zależne od dawki zatrzymanie płynów, gdy jest stosowany samodzielnie lub w połączeniu z innymi lekami przeciwcukrzycowymi i występuje najczęściej, gdy ACTOS 30 mg jest stosowany w skojarzeniu z insuliną. Zatrzymanie płynów może prowadzić do zastoinowej niewydolności serca lub ją zaostrzyć. Pacjentów należy obserwować pod kątem oznak i objawów zastoinowej niewydolności serca. Jeśli rozwinie się zastoinowa niewydolność serca, należy ją leczyć zgodnie z obowiązującymi standardami postępowania i rozważyć przerwanie lub zmniejszenie dawki ACTOS [patrz PUDEŁKO OSTRZEŻENIE , PRZECIWWSKAZANIA , oraz DZIAŁANIA NIEPOŻĄDANE ].
Hipoglikemia
Pacjenci otrzymujący ACTOS w skojarzeniu z insuliną lub innymi lekami przeciwcukrzycowymi (zwłaszcza pobudzającymi wydzielanie insuliny, takimi jak pochodne sulfonylomocznika) mogą być narażeni na ryzyko hipoglikemii. W celu zmniejszenia ryzyka hipoglikemii może być konieczne zmniejszenie dawki jednocześnie stosowanego leku przeciwcukrzycowego [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Wpływ na wątrobę
Po wprowadzeniu produktu do obrotu zgłaszano przypadki niewydolności wątroby zakończonej zgonem lub niezakończonej zgonem u pacjentów przyjmujących ACTOS 15 mg, chociaż doniesienia te nie zawierają wystarczających informacji niezbędnych do ustalenia prawdopodobnej przyczyny. Jak dotąd w bazie danych kontrolowanych badań klinicznych ACTOS 30 mg nie ma dowodów na hepatotoksyczność indukowaną lekiem [patrz DZIAŁANIA NIEPOŻĄDANE ].
Pacjenci z cukrzycą typu 2 mogą mieć stłuszczenie wątroby lub choroby serca z epizodyczną zastoinową niewydolnością serca, które mogą powodować nieprawidłowe wyniki testów wątrobowych, a także mogą mieć inne postacie choroby wątroby, z których wiele można leczyć lub kontrolować. Dlatego przed rozpoczęciem leczenia ACTOS zaleca się uzyskanie panelu testów wątrobowych (surowicza aminotransferaza alaninowa [ALT], aminotransferaza asparaginianowa [AST], fosfataza alkaliczna i bilirubina całkowita) oraz ocena stanu pacjenta. U pacjentów z nieprawidłowymi wynikami badań wątrobowych ACTOS 15 mg należy rozpoczynać ostrożnie.
Niezwłocznie mierz wyniki testów wątrobowych u pacjentów, którzy zgłaszają objawy mogące wskazywać na uszkodzenie wątroby, w tym zmęczenie, anoreksję, dyskomfort w prawym górnym odcinku brzucha, ciemny mocz lub żółtaczkę. W tym kontekście klinicznym, jeśli u pacjenta zostaną stwierdzone nieprawidłowe wyniki testów wątrobowych (AlAT przekracza 3-krotnie górną granicę zakresu referencyjnego), leczenie preparatem ACTOS 15 mg należy przerwać i przeprowadzić badanie w celu ustalenia prawdopodobnej przyczyny. Nie należy wznawiać leczenia ACTOS u tych pacjentów bez innego wyjaśnienia nieprawidłowych wyników testów wątrobowych.
Pacjenci, u których aktywność AlAT w surowicy przekracza trzykrotnie zakres referencyjny, a stężenie bilirubiny całkowitej w surowicy przekracza dwukrotność zakresu referencyjnego, bez alternatywnej etiologii, są narażeni na ryzyko ciężkiego polekowego uszkodzenia wątroby i nie należy wznawiać ich leczenia ACTOS. W przypadku pacjentów z mniejszym wzrostem aktywności AlAT lub bilirubiny w surowicy iz inną prawdopodobną przyczyną, leczenie preparatem ACTOS można stosować ostrożnie.
Guzy pęcherza moczowego
W dwuletnim badaniu rakotwórczości w pęcherzu moczowym samców szczurów zaobserwowano nowotwory [patrz Toksykologia niekliniczna ]. Ponadto podczas trzyletniego badania klinicznego PROactive u 14 z 2605 (0,54%) pacjentów zrandomizowanych do grupy ACTOS 15 mg i u 5 z 2633 (0,19%) zrandomizowanych do grupy placebo zdiagnozowano raka pęcherza moczowego. Po wykluczeniu pacjentów, u których ekspozycja na badany lek była krótsza niż jeden rok w momencie rozpoznania raka pęcherza moczowego, było 6 (0,23%) przypadków w grupie ACTOS 30 mg i dwa (0,08%) w grupie placebo. Po zakończeniu badania dużą podgrupę pacjentów obserwowano przez okres do 10 dodatkowych lat, z niewielką dodatkową ekspozycją na ACTOS. W ciągu 13 lat obserwacji PROactive i obserwacyjnej występowanie raka pęcherza moczowego nie różniło się między pacjentami przydzielonymi losowo do grupy otrzymującej ACTOS 30 mg lub placebo (HR = 1,00; [95% CI: 0,59-1,72]).
Ustalenia dotyczące ryzyka raka pęcherza moczowego u pacjentów narażonych na ACTOS różnią się w badaniach obserwacyjnych; niektórzy nie stwierdzili zwiększonego ryzyka raka pęcherza związanego z ACTOS 30mg, podczas gdy inni tak.
dużym prospektywnym, 10-letnim, obserwacyjnym badaniu kohortowym przeprowadzonym w Stanach Zjednoczonych nie stwierdzono statystycznie istotnego wzrostu ryzyka raka pęcherza moczowego u pacjentów z cukrzycą kiedykolwiek narażonych na ACTOS w porównaniu z osobami nigdy nie narażonymi na ACTOS (HR = 1,06 [95% CI 0,89-1,26 ]).
Retrospektywne badanie kohortowe przeprowadzone na podstawie danych z Wielkiej Brytanii wykazało statystycznie istotny związek między kiedykolwiek ekspozycją na ACTOS a rakiem pęcherza moczowego (HR: 1,63; [95% CI: 1,22-2,19]).
W niektórych badaniach, w tym w 10-letnim badaniu obserwacyjnym w USA, nie wykryto związku między skumulowaną dawką lub skumulowanym czasem ekspozycji na ACTOS 15 mg a rakiem pęcherza moczowego, ale stwierdzono je w innych. Niespójne ustalenia i ograniczenia nieodłącznie związane z tymi i innymi badaniami wykluczają jednoznaczną interpretację danych obserwacyjnych.
ACTOS może wiązać się ze wzrostem ryzyka guzów pęcherza moczowego. Nie ma wystarczających danych, aby ustalić, czy pioglitazon jest promotorem nowotworów pęcherza moczowego.
W związku z tym ACTOS nie powinien być stosowany u pacjentów z aktywnym rakiem pęcherza moczowego, a korzyści z kontroli glikemii w porównaniu z nieznanym ryzykiem nawrotu raka w przypadku ACTOS należy rozważyć u pacjentów z rakiem pęcherza w wywiadzie.
Obrzęk
W kontrolowanych badaniach klinicznych obrzęk zgłaszano częściej u pacjentów leczonych preparatem ACTOS 30 mg niż u pacjentów otrzymujących placebo i jest on zależny od dawki [patrz DZIAŁANIA NIEPOŻĄDANE ]. Z doświadczeń po wprowadzeniu leku do obrotu wynika, że zgłaszano pojawienie się lub nasilenie obrzęku.
ACTOS 15 mg należy stosować ostrożnie u pacjentów z obrzękami. Ponieważ tiazolidynodiony, w tym ACTOS, mogą powodować zatrzymanie płynów, co może nasilać lub prowadzić do zastoinowej niewydolności serca, ACTOS 30 mg należy stosować ostrożnie u pacjentów z ryzykiem zastoinowej niewydolności serca. Pacjentów leczonych preparatem ACTOS należy monitorować pod kątem przedmiotowych i podmiotowych objawów zastoinowej niewydolności serca [patrz PUDEŁKO OSTRZEŻENIE , Zastoinowa niewydolność serca oraz INFORMACJA O PACJENCIE ].
Złamania
PROactive (Prospective Pioglitazone Clinical Trial in Macrovascular Events) 5238 pacjentów z cukrzycą typu 2 i chorobą makronaczyniową w wywiadzie zostało losowo przydzielonych do grupy ACTOS (N=2605), z miareczkowaniem wymuszonym do 45 mg na dobę lub placebo (N=2633). oprócz standardowej opieki. W okresie obserwacji trwającym średnio 34,5 miesiąca częstość występowania złamań kości u kobiet wynosiła 5,1% (44/870) dla preparatu ACTOS 30 mg w porównaniu do 2,5% (23/905) dla placebo. Różnica ta została odnotowana po pierwszym roku leczenia i utrzymywała się w trakcie trwania badania. Większość złamań obserwowanych u kobiet to złamania pozakręgowe, w tym kończyny dolnej i dystalnej kończyny górnej. Nie zaobserwowano wzrostu częstości złamań u mężczyzn leczonych preparatem ACTOS (1,7%) w porównaniu z placebo (2,1%). W opiece nad pacjentami, zwłaszcza kobietami, leczonymi preparatem ACTOS należy brać pod uwagę ryzyko złamań i zwracać uwagę na ocenę i utrzymanie zdrowia kości zgodnie z obowiązującymi standardami opieki.
Obrzęk plamki żółtej
Po wprowadzeniu produktu do obrotu zgłaszano obrzęk plamki u pacjentów z cukrzycą, którzy przyjmowali ACTOS lub inny tiazolidynodion. Niektórzy pacjenci mieli niewyraźne widzenie lub pogorszenie ostrości wzroku, ale inni zostali zdiagnozowani podczas rutynowego badania okulistycznego.
Większość pacjentów miała obrzęki obwodowe w momencie rozpoznania obrzęku plamki. U niektórych pacjentów nastąpiła poprawa obrzęku plamki po odstawieniu tiazolidynodionu.
Pacjenci z cukrzycą powinni mieć regularne badania wzroku u okulisty zgodnie z obowiązującymi standardami opieki. Pacjenci z cukrzycą, którzy zgłaszają jakiekolwiek objawy wzrokowe, powinni być niezwłocznie skierowani do okulisty, niezależnie od stosowanych przez pacjenta leków lub innych objawów fizycznych [patrz DZIAŁANIA NIEPOŻĄDANE ].
Wyniki makronaczyniowe
Nie przeprowadzono badań klinicznych, które dostarczyłyby rozstrzygających dowodów na zmniejszenie ryzyka makronaczyniowego przy stosowaniu ACTOS.
Informacje dotyczące poradnictwa dla pacjentów
Zobacz zatwierdzone przez FDA oznakowanie pacjenta ( INFORMACJA O PACJENCIE ).
- Ważne jest, aby poinstruować pacjentów, aby przestrzegali zaleceń żywieniowych i regularnie poddawali się badaniom poziomu glukozy i hemoglobiny glikozylowanej. W okresach stresu, takich jak gorączka, uraz, infekcja lub zabieg chirurgiczny, zapotrzebowanie na leki może ulec zmianie, a pacjentom należy przypomnieć, aby niezwłocznie zasięgnęli porady lekarskiej.
- Pacjenci, u których podczas stosowania preparatu ACTOS wystąpi niezwykle szybki przyrost masy ciała lub obrzęk lub duszność lub inne objawy niewydolności serca, powinni niezwłocznie zgłosić te objawy lekarzowi.
- Należy poinformować pacjentów, aby niezwłocznie przerwali przyjmowanie leku ACTOS i niezwłocznie zasięgnęli porady lekarza, jeśli wystąpią niewyjaśnione nudności, wymioty, bóle brzucha, zmęczenie, jadłowstręt lub ciemne zabarwienie moczu, ponieważ objawy te mogą być spowodowane hepatotoksycznością.
- Należy poinformować pacjentów, aby niezwłocznie zgłaszali wszelkie objawy makroskopowego krwiomoczu lub innych objawów, takich jak dyzuria lub parcie na mocz, które rozwijają się lub nasilają podczas leczenia, ponieważ mogą one być spowodowane rakiem pęcherza moczowego.
- Należy poinformować pacjentów, aby przyjmowali ACTOS 15 mg raz na dobę. ACTOS 15 mg można przyjmować niezależnie od posiłków. W przypadku pominięcia dawki jednego dnia, następnego dnia nie należy jej podwajać.
- W przypadku stosowania terapii skojarzonej z insuliną lub innymi lekami przeciwcukrzycowymi należy wyjaśnić pacjentom i członkom ich rodzin ryzyko wystąpienia hipoglikemii, jej objawy i leczenie oraz stany predysponujące do jej rozwoju.
- Poinformuj pacjentki, że leczenie preparatem ACTOS 30 mg, podobnie jak inne tiazolidynodiony, może spowodować niezamierzoną ciążę u niektórych kobiet przed menopauzą bez jajeczkowania ze względu na jego wpływ na owulację [patrz Używaj w określonych populacjach ].
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Przeprowadzono dwuletnie badanie rakotwórczości u samców i samic szczurów przy dawkach doustnych do 63 mg/kg (około 14-krotność maksymalnej zalecanej doustnej dawki u ludzi wynoszącej 45 mg w przeliczeniu na mg/m2). Guzy polekowe nie były obserwowane w żadnym narządzie z wyjątkiem pęcherza moczowego samców szczurów. Łagodne i (lub) złośliwe nowotwory komórek przejściowych obserwowano u samców szczurów w dawce 4 mg/kg/dobę i powyżej (w przybliżeniu równej maksymalnej zalecanej doustnej dawce u ludzi w przeliczeniu na mg/m2). Jako mechanizm powstawania guzów pęcherza obserwowanego u samców szczurów postulowano kamienie moczowe z późniejszym podrażnieniem i hiperplazją. W 2009 roku zakończono dwuletnie badanie mechanistyczne na samcach szczurów wykorzystujące zakwaszanie pokarmowe w celu zmniejszenia powstawania kamieni. Zakwaszenie pokarmowe zmniejszyło się, ale nie zlikwidowało zmian przerostowych w pęcherzu. Obecność kamieni nasilała odpowiedź hiperplastyczną na pioglitazon, ale nie była uważana za główną przyczynę zmian hiperplastycznych.
Nie można wykluczyć znaczenia dla ludzi wyników badań pęcherza moczowego u samców szczura.
Przeprowadzono również dwuletnie badanie rakotwórczości u samców i samic myszy przy dawkach doustnych do 100 mg/kg/dobę (około 11-krotność maksymalnej zalecanej dawki doustnej u ludzi w przeliczeniu na mg/m2). W żadnym narządzie nie zaobserwowano guzów polekowych.
Chlorowodorek pioglitazonu nie wykazywał działania mutagennego w szeregu badań toksykologii genetycznej, w tym w teście bakteryjnym Amesa, teście mutacji genów do przodu w komórkach ssaków (CHO/HPRT i AS52/XPRT), teście cytogenetycznym in vitro z użyciem komórek CHL, teście nieplanowanej syntezy DNA oraz test mikrojądrowy in vivo.
Nie zaobserwowano niekorzystnego wpływu na płodność u samców i samic szczurów przy dawkach doustnych do 40 mg/kg chlorowodorku pioglitazonu na dobę przed oraz podczas krycia i ciąży (około dziewięciokrotność maksymalnej zalecanej dawki doustnej u ludzi w przeliczeniu na mg/m2).
Używaj w określonych populacjach
Ciąża
Podsumowanie ryzyka
Ograniczone dane dotyczące ACTOS u kobiet w ciąży nie są wystarczające do określenia związanego z lekiem ryzyka poważnych wad wrodzonych lub poronienia. Istnieje ryzyko dla matki i płodu związane ze źle kontrolowaną cukrzycą w ciąży [patrz Rozważania kliniczne ].
W badaniach na zwierzętach dotyczących reprodukcji nie zaobserwowano działań niepożądanych rozwojowych, gdy pioglitazon podawano ciężarnym szczurom i królikom podczas organogenezy w dawkach wynoszących odpowiednio do 5- i 35-krotności dawki klinicznej 45 mg, w zależności od powierzchni ciała [patrz Dane ].
Szacowane podstawowe ryzyko wystąpienia poważnych wad wrodzonych wynosi 6-10% u kobiet z cukrzycą przedciążową z HbA1c >7 i według doniesień sięga nawet 20-25% u kobiet z HbA1c >10. Szacowane podstawowe ryzyko poronienia dla wskazanej populacji jest nieznane. W ogólnej populacji USA szacowane podstawowe ryzyko poważnych wad wrodzonych i poronienia w klinicznie rozpoznanych ciążach wynosi odpowiednio 2-4% i 15-20%.
Rozważania kliniczne
Związane z chorobą ryzyko matki i/lub zarodka/płodu
Źle kontrolowana cukrzyca w ciąży zwiększa ryzyko wystąpienia cukrzycowej kwasicy ketonowej, stanu przedrzucawkowego, samoistnych poronień, porodów przedwczesnych, martwych porodów i powikłań porodowych. Źle kontrolowana cukrzyca zwiększa ryzyko wystąpienia u płodu poważnych wad wrodzonych, martwych urodzeń i zachorowalności na makrosomię.
Dane
Dane zwierząt
Pioglitazon podawany ciężarnym samicom szczurów podczas organogenezy w dawce 20 mg/kg (~5-krotność dawki klinicznej 45 mg) nie powodował działań niepożądanych, ale opóźniał poród i zmniejszał żywotność zarodka i płodu w dawkach 40 i 80 mg/kg lub ≥ 9-krotność dawki klinicznej 45 mg na powierzchnię ciała. U ciężarnych królików, którym podawano pioglitazon podczas organogenezy, nie zaobserwowano działań niepożądanych rozwojowych przy dawce 80 mg/kg (~35-krotność dawki klinicznej 45 mg), ale zmniejszyła się żywotność zarodka i płodu przy dawce 160 mg/kg lub ~69-krotność dawki klinicznej 45 mg dawki według powierzchni ciała. Gdy ciężarne samice szczurów otrzymywały pioglitazon w późnym okresie ciąży i laktacji, u potomstwa występowało opóźniony rozwój pourodzeniowy, przypisywany zmniejszeniu masy ciała, przy dawkach matczynych 10 mg/kg i większych lub ≥2 razy większych niż dawka kliniczna 45 mg na powierzchnię ciała.
Laktacja
Podsumowanie ryzyka
Brak informacji dotyczących obecności pioglitazonu w mleku ludzkim, wpływu na niemowlę karmione piersią lub wpływu na produkcję mleka. Pioglitazon jest obecny w mleku szczurów; jednak ze względu na specyficzne gatunkowo różnice w fizjologii laktacji dane na zwierzętach mogą nie przewidywać wiarygodnych poziomów leku w mleku ludzkim. Należy wziąć pod uwagę korzyści rozwojowe i zdrowotne wynikające z karmienia piersią, a także kliniczne zapotrzebowanie matki na ACTOS 15 mg oraz wszelkie potencjalne niekorzystne skutki stosowania ACTOS 30 mg na niemowlę karmione piersią lub związane z tym schorzeniem matki.
Kobiety i mężczyźni o potencjale rozrodczym
Omów możliwość niezamierzonej ciąży u kobiet przed menopauzą, ponieważ leczenie preparatem ACTOS, podobnie jak inne tiazolidynodiony, może powodować owulację u niektórych kobiet bez jajeczkowania.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność ACTOS u dzieci nie zostały ustalone.
ACTOS 15 mg nie jest zalecany do stosowania u dzieci ze względu na działania niepożądane obserwowane u dorosłych, w tym zatrzymanie płynów i zastoinową niewydolność serca, złamania i guzy pęcherza moczowego [patrz OSTRZEŻENIA I ŚRODKI ].
Zastosowanie geriatryczne
W sumie 92 pacjentów (15,2%) leczonych preparatem ACTOS w trzech połączonych 16-26-tygodniowych badaniach kontrolowanych placebo z podwójnie ślepą próbą i monoterapią było w wieku ≥65 lat, a dwóch pacjentów (0,3%) było w wieku ≥75 lat. W dwóch połączonych badaniach trwających od 16 do 24 tygodni leczenia sulfonylomocznikiem 201 pacjentów (18,7%) leczonych preparatem ACTOS 30 mg było w wieku ≥65 lat, a 19 (1,8%) miało ≥75 lat. W dwóch połączonych badaniach dotyczących leczenia metforminą trwających od 16 do 24 tygodni 155 pacjentów (15,5%) leczonych preparatem ACTOS miało ≥65 lat, a 19 (1,9%) miało ≥75 lat. W dwóch połączonych badaniach dotyczących leczenia insuliną trwających od 16 do 24 tygodni 272 pacjentów (25,4%) leczonych preparatem ACTOS miało ≥65 lat, a 22 (2,1%) miało ≥75 lat.
W badaniu PROactive 1068 pacjentów (41,0%) leczonych preparatem ACTOS było w wieku ≥65 lat, a 42 (1,6%) miało ≥75 lat.
badaniach farmakokinetycznych pioglitazonu nie zaobserwowano istotnych różnic w parametrach farmakokinetycznych pomiędzy pacjentami w podeszłym wieku i młodszymi [patrz FARMAKOLOGIA KLINICZNA ].
Chociaż doświadczenia kliniczne nie wykazały różnic w skuteczności i bezpieczeństwie między pacjentami w podeszłym wieku (≥65 lat) i młodszymi, wnioski te są ograniczone przez małą liczebność próby pacjentów w wieku ≥75 lat.
PRZEDAWKOWAĆ
W kontrolowanych badaniach klinicznych zgłoszono jeden przypadek przedawkowania preparatu ACTOS 30 mg. Mężczyzna przyjmował 120 mg dziennie przez cztery dni, a następnie 180 mg dziennie przez siedem dni. Pacjentka zaprzeczyła jakimkolwiek objawom klinicznym w tym okresie.
W przypadku przedawkowania należy rozpocząć odpowiednie leczenie wspomagające zgodnie z objawami klinicznymi i objawami klinicznymi pacjenta.
PRZECIWWSKAZANIA
- Rozpoczęcie leczenia u pacjentów z ustaloną niewydolnością serca klasy III lub IV wg NYHA [patrz PUDEŁKO OSTRZEŻENIE ].
- Stosowanie u pacjentów ze stwierdzoną nadwrażliwością na pioglitazon lub jakikolwiek inny składnik preparatu ACTOS.
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
ACTOS 15 mg jest tiazolidynodionem, którego mechanizm działania zależy od obecności insuliny. ACTOS zmniejsza insulinooporność na obwodzie iw wątrobie, powodując zwiększenie wydalania glukozy zależnej od insuliny i zmniejszenie wydzielania glukozy przez wątrobę. Pioglitazon nie pobudza wydzielania insuliny. Pioglitazon jest agonistą receptora gamma aktywowanego przez proliferatory peroksysomów (PPAR?). Receptory PPAR znajdują się w tkankach ważnych dla działania insuliny, takich jak tkanka tłuszczowa, mięśnie szkieletowe i wątroba. Aktywacja PPAR? Receptory jądrowe modulują transkrypcję wielu genów reagujących na insulinę zaangażowanych w kontrolę metabolizmu glukozy i lipidów.
zwierzęcych modelach cukrzycy pioglitazon zmniejsza hiperglikemię, hiperinsulinemię i hipertriglicerydemię charakterystyczne dla stanów insulinoopornych, takich jak cukrzyca typu 2. Zmiany metaboliczne wywoływane przez pioglitazon powodują zwiększoną reaktywność tkanek insulinozależnych i są obserwowane w wielu zwierzęcych modelach insulinooporności.
Ponieważ pioglitazon wzmacnia działanie krążącej insuliny (poprzez zmniejszenie insulinooporności), nie obniża poziomu glukozy we krwi w modelach zwierzęcych, które nie posiadają insuliny endogennej.
Farmakodynamika
Badania kliniczne wykazują, że ACTOS 15 mg poprawia wrażliwość na insulinę u pacjentów z insulinoopornością. ACTOS zwiększa odpowiedź komórek na insulinę, zwiększa wydalanie glukozy zależnej od insuliny i poprawia wrażliwość wątroby na insulinę. U pacjentów z cukrzycą typu 2 zmniejszona insulinooporność wywołana przez ACTOS skutkuje niższymi stężeniami glukozy w osoczu, niższymi stężeniami insuliny w osoczu i niższymi wartościami HbA1c. W kontrolowanych badaniach klinicznych ACTOS miał addytywny wpływ na kontrolę glikemii, gdy był stosowany w skojarzeniu z pochodną sulfonylomocznika, metforminą lub insuliną [patrz Studia kliniczne ].
Pacjenci z zaburzeniami lipidowymi byli włączani do badań klinicznych z ACTOS. Ogólnie rzecz biorąc, pacjenci leczeni 15 mg ACTOS mieli średnie spadki triglicerydów w surowicy, średnie wzrosty cholesterolu HDL i brak spójnych średnich zmian cholesterolu LDL i całkowitego. Nie ma jednoznacznych dowodów na korzyść makronaczyniową z ACTOS [patrz OSTRZEŻENIA I ŚRODKI oraz DZIAŁANIA NIEPOŻĄDANE ].
26-tygodniowym, kontrolowanym placebo badaniu monoterapii z różnymi dawkami, średnie stężenie triglicerydów w surowicy zmniejszyło się w grupach otrzymujących 15 mg, 30 mg i 45 mg ACTOS 15 mg w porównaniu ze średnim wzrostem w grupie placebo. Średni cholesterol HDL wzrósł w większym stopniu u pacjentów leczonych ACTOS 30 mg niż u pacjentów otrzymujących placebo. Nie było spójnych różnic dla LDL i cholesterolu całkowitego u pacjentów leczonych preparatem ACTOS w porównaniu z placebo (patrz Tabela 14).
W dwóch innych badaniach dotyczących monoterapii (16 tygodni i 24 tygodnie) oraz w badaniach terapii skojarzonej pochodną sulfonylomocznika (16 tygodni i 24 tygodnie), metforminą (16 tygodni i 24 tygodnie) lub insuliną (16 tygodni i 24 tygodnie) wyniki były na ogół zgodne z powyższymi danymi.
Farmakokinetyka
Po podawaniu raz na dobę preparatu ACTOS 15 mg, stężenie w surowicy zarówno pioglitazonu, jak i jego głównych czynnych metabolitów, M-III (ketopochodna pioglitazonu) i M-IV (hydroksypochodna pioglitazonu) w surowicy jest osiągane w ciągu siedmiu dni. W stanie stacjonarnym M-III i M-IV osiągają stężenia w surowicy równe lub większe niż pioglitazon. W stanie stacjonarnym, zarówno u zdrowych ochotników, jak i pacjentów z cukrzycą typu 2, pioglitazon stanowi około 30% do 50% maksymalnego całkowitego stężenia pioglitazonu w surowicy (pioglitazon plus aktywne metabolity) i 20% do 25% całkowitego AUC.
Cmax, AUC i minimalne stężenia w surowicy (Cmin) dla pioglitazonu oraz M-III i M-IV wzrastały proporcjonalnie do podawanych dawek 15 mg i 30 mg na dobę.
Wchłanianie
Po podaniu doustnym pioglitazonu Tmax pioglitazonu wynosił dwie godziny. Pokarm opóźnia Tmax do trzech do czterech godzin, ale nie zmienia stopnia wchłaniania (AUC).
Dystrybucja
Średnia pozorna objętość dystrybucji (Vd/F) pioglitazonu po podaniu pojedynczej dawki wynosi 0,63 ± 0,41 (średnia ± SD) l/kg masy ciała. Pioglitazon w znacznym stopniu (>99%) wiąże się z białkami surowicy ludzkiej, głównie z albuminą surowicy. Pioglitazon wiąże się również z innymi białkami surowicy, ale z mniejszym powinowactwem. M-III i M-IV są również silnie związane (>98%) z albuminą surowicy.
Metabolizm
Pioglitazon jest intensywnie metabolizowany przez hydroksylację i utlenianie; metabolity również częściowo przekształcają się w koniugaty glukuronidowe lub siarczanowe. Metabolity M-III i M-IV są głównymi aktywnymi metabolitami krążącymi u ludzi.
Dane z badań in vitro wskazują, że w metabolizmie pioglitazonu bierze udział wiele izoform CYP, w tym CYP2C8 i, w mniejszym stopniu, CYP3A4, z dodatkowym udziałem różnych innych izoform, w tym głównie pozawątrobowego CYP1A1. Badanie in vivo pioglitazonu w skojarzeniu z gemfibrozylem, silnym inhibitorem CYP2C8, wykazało, że pioglitazon jest substratem CYP2C8 [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz INTERAKCJE Z LEKAMI ]. Stosunek 6β-hydroksykortyzolu do kortyzolu w moczu mierzony u pacjentów leczonych preparatem ACTOS 30 mg wykazał, że pioglitazon nie jest silnym induktorem enzymów CYP3A4.
Wydalanie i eliminacja
Po podaniu doustnym około 15% do 30% dawki pioglitazonu jest wydalane z moczem. Wydalanie pioglitazonu przez nerki jest znikome, a lek jest wydalany głównie w postaci metabolitów i ich koniugatów. Przypuszcza się, że większość dawki doustnej jest wydalana z żółcią w postaci niezmienionej lub w postaci metabolitów i wydalana z kałem.
Średni okres półtrwania w surowicy (t1/2) pioglitazonu i jego metabolitów (M-III i M-IV) wynosi odpowiednio od trzech do siedmiu godzin i od 16 do 24 godzin. Pioglitazon ma pozorny klirens CL/F, obliczony na pięć do siedmiu l/h.
Zaburzenia czynności nerek
Okres półtrwania pioglitazonu, M-III i M-IV w surowicy w fazie eliminacji pozostaje niezmieniony u pacjentów z umiarkowanymi (klirens kreatyniny [CLcr] 30 do 50 ml/min) i ciężkimi (CLcr
Niewydolność wątroby
W porównaniu ze zdrowymi osobami z grupy kontrolnej, osoby z zaburzeniami czynności wątroby (stopień B/C Child-Turcotte-Pugh) mają około 45% zmniejszenie średniego Cmax pioglitazonu i całkowitego pioglitazonu (pioglitazon, M-III i M-IV), ale bez zmiany średnie wartości AUC. Dlatego nie ma konieczności dostosowania dawki u pacjentów z zaburzeniami czynności wątroby.
Istnieją doniesienia po wprowadzeniu leku do obrotu o niewydolności wątroby związanej z ACTOS, a badania kliniczne generalnie wykluczały pacjentów, u których aktywność AlAT w surowicy przekraczała 2,5-krotnie górną granicę zakresu referencyjnego. Należy zachować ostrożność u pacjentów z chorobami wątroby [patrz OSTRZEŻENIA I ŚRODKI ].
Pacjenci geriatryczni
U zdrowych osób w podeszłym wieku Cmax pioglitazonu nie różniło się znacząco, ale wartości AUC były o około 21% wyższe niż u osób młodszych. Średni t1/2 pioglitazonu był również wydłużony u osób starszych (około dziesięciu godzin) w porównaniu z osobami młodszymi (około siedmiu godzin). Zmiany te nie były na tyle istotne, aby można je było uznać za klinicznie istotne.
Pacjenci pediatryczni
Nie ustalono bezpieczeństwa i skuteczności pioglitazonu u dzieci i młodzieży. ACTOS 15 mg nie jest zalecany do stosowania u dzieci [patrz Używaj w określonych populacjach ].
Płeć
Średnie wartości Cmax i AUC pioglitazonu były zwiększone o 20% do 60% u kobiet w porównaniu z mężczyznami. W kontrolowanych badaniach klinicznych spadki HbA1c w stosunku do wartości wyjściowych były na ogół większe u kobiet niż u mężczyzn (średnia średnia różnica w HbA1c 0,5%). Ponieważ terapia powinna być zindywidualizowana dla każdego pacjenta w celu uzyskania kontroli glikemii, nie zaleca się dostosowywania dawki wyłącznie ze względu na płeć.
Pochodzenie etniczne
Dane farmakokinetyczne dla różnych grup etnicznych nie są dostępne.
Interakcje między lekami
Toksykologia i/lub farmakologia zwierząt
Powiększenie serca zaobserwowano u myszy (100 mg/kg), szczurów (4 mg/kg i więcej) i psów (3 mg/kg) leczonych doustnie chlorowodorkiem pioglitazonu (około 11, 1 i 2 razy więcej niż zalecana doustna dawka dla ludzi). odpowiednio dla myszy, szczurów i psów, w przeliczeniu na mg/m2). W rocznym badaniu na szczurach wczesny zgon związany z lekiem z powodu widocznej dysfunkcji serca wystąpił po podaniu doustnym dawki 160 mg/kg/dobę (około 35-krotność maksymalnej zalecanej dawki doustnej u ludzi w przeliczeniu na mg/m2). Powiększenie serca zaobserwowano w 13-tygodniowym badaniu na małpach przy dawkach doustnych 8,9 mg/kg i większych (około czterokrotność maksymalnej zalecanej dawki doustnej u ludzi w przeliczeniu na mg/m2), ale nie w 52-tygodniowym badaniu z zastosowaniem dawek doustnych do 32 mg/kg (około 13-krotność maksymalnej zalecanej dawki doustnej dla ludzi w przeliczeniu na mg/m2).
Studia kliniczne
Monoterapia
Przeprowadzono trzy randomizowane, podwójnie zaślepione, kontrolowane placebo badania, trwające od 16 do 26 tygodni, w celu oceny stosowania ACTOS w monoterapii u pacjentów z cukrzycą typu 2. W badaniach tych oceniano ACTOS 15 mg w dawkach do 45 mg lub placebo raz na dobę u łącznie 865 pacjentów.
W 26-tygodniowym badaniu z zastosowaniem różnych dawek monoterapii 408 pacjentów z cukrzycą typu 2 przydzielono losowo do grupy otrzymującej 7,5 mg, 15 mg, 30 mg lub 45 mg ACTOS lub placebo raz na dobę. Terapię jakimkolwiek wcześniejszym lekiem przeciwcukrzycowym przerwano na osiem tygodni przed okresem podwójnie ślepej próby. Leczenie 15 mg, 30 mg i 45 mg ACTOS 30 mg powodowało statystycznie istotną poprawę HbA1c i stężenia glukozy w osoczu na czczo (FPG) w punkcie końcowym w porównaniu z placebo (patrz Ryc. 1, Tabela 17).
Rycina 1 przedstawia przebieg czasowy zmian HbA1c w tym 26-tygodniowym badaniu.
Rycina 1. Średnia zmiana wartości HbA1c w stosunku do wartości wyjściowej w 26-tygodniowym badaniu z zastosowaniem placebo w kontrolowanym zakresie dawki (Obserwowane wartości)
24-tygodniowym kontrolowanym placebo badaniu monoterapii 260 pacjentów z cukrzycą typu 2 przydzielono losowo do jednej z dwóch grup leczenia ACTOS z wymuszonym miareczkowaniem lub do grupy placebo z próbnym miareczkowaniem. Terapię jakimkolwiek wcześniejszym lekiem przeciwcukrzycowym przerwano sześć tygodni przed okresem podwójnie ślepej próby. W jednej grupie leczonej preparatem ACTOS 15 mg pacjenci otrzymywali początkową dawkę 7,5 mg raz na dobę. Po czterech tygodniach dawkę zwiększono do 15 mg raz dziennie, a po kolejnych czterech tygodniach dawkę zwiększono do 30 mg raz dziennie przez pozostałą część badania (16 tygodni). W drugiej grupie leczonej preparatem ACTOS pacjenci otrzymywali początkową dawkę 15 mg raz na dobę i byli stopniowo zwiększani do 30 mg raz na dobę i 45 mg raz na dobę w podobny sposób. Leczenie ACTOS 15 mg, jak opisano, spowodowało statystycznie istotną poprawę HbA1c i FPG w punkcie końcowym w porównaniu z placebo (patrz Tabela 18).
16-tygodniowym badaniu dotyczącym monoterapii 197 pacjentów z cukrzycą typu 2 przydzielono losowo do leczenia 30 mg ACTOS lub placebo raz na dobę. Terapię jakimkolwiek wcześniejszym lekiem przeciwcukrzycowym przerwano sześć tygodni przed okresem podwójnie ślepej próby. Leczenie 30 mg ACTOS spowodowało statystycznie istotną poprawę HbA1c i FPG w punkcie końcowym w porównaniu z placebo (patrz Tabela 19).
Terapia skojarzona
Przeprowadzono trzy 16-tygodniowe, randomizowane, podwójnie zaślepione, kontrolowane placebo badania kliniczne w celu oceny wpływu ACTOS (15 mg i/lub 30 mg) na kontrolę glikemii u pacjentów z cukrzycą typu 2, którzy byli niedostatecznie kontrolowani (HbA1c ≥8 %) pomimo aktualnego leczenia pochodną sulfonylomocznika, metforminą lub insuliną. Ponadto przeprowadzono trzy 24-tygodniowe randomizowane, podwójnie zaślepione badania kliniczne w celu oceny wpływu ACTOS 30 mg w porównaniu z ACTOS 45 mg na kontrolę glikemii u pacjentów z cukrzycą typu 2, którzy byli niewystarczająco kontrolowani (HbA1c ≥8%) pomimo aktualnego terapia sulfonylomocznikiem, metforminą lub insuliną. Wcześniejsze leczenie cukrzycy mogło być monoterapią lub terapią skojarzoną.
Dodatek do prób sulfonylomocznika
Przeprowadzono dwa badania kliniczne preparatu ACTOS w połączeniu z sulfonylomocznikiem. Oba badania obejmowały pacjentów z cukrzycą typu 2, którzy otrzymywali dowolną dawkę pochodnej sulfonylomocznika, samodzielnie lub w skojarzeniu z innym lekiem przeciwcukrzycowym. Wszystkie inne leki przeciwcukrzycowe odstawiono co najmniej trzy tygodnie przed rozpoczęciem leczenia w ramach badania.
W pierwszym badaniu 560 pacjentów zostało losowo przydzielonych do grupy otrzymującej 15 mg lub 30 mg preparatu ACTOS 30 mg lub placebo raz na dobę przez 16 tygodni dodatkowo do dotychczasowego schematu leczenia pochodnymi sulfonylomocznika. Leczenie ACTOS jako skojarzeniem z sulfonylomocznikiem spowodowało statystycznie istotną poprawę HbA1c i FPG w punkcie końcowym w porównaniu z skojarzeniem placebo z sulfonylomocznikiem (patrz Tabela 20).
drugim badaniu 702 pacjentów zostało losowo przydzielonych do grupy otrzymującej 30 mg lub 45 mg preparatu ACTOS raz na dobę przez 24 tygodnie oprócz dotychczasowego schematu leczenia pochodnymi sulfonylomocznika. Średnie zmniejszenie HbA1c w stosunku do wartości wyjściowej w 24. tygodniu wyniosło 1,6% dla dawki 30 mg i 1,7% dla dawki 45 mg (patrz Tabela 21). Średnie zmniejszenie FPG w stosunku do wartości wyjściowej w 24. tygodniu wynosiło 52 mg/dl dla dawki 30 mg i 56 mg/dl dla dawki 45 mg.
Efekt terapeutyczny preparatu ACTOS w skojarzeniu z pochodną sulfonylomocznika obserwowano u pacjentów niezależnie od dawki sulfonylomocznika.
Dodatek do testów metforminy
Przeprowadzono dwa badania kliniczne z preparatem ACTOS 30 mg w skojarzeniu z metforminą. Oba badania obejmowały pacjentów z cukrzycą typu 2, którzy przyjmowali dowolną dawkę metforminy, samodzielnie lub w skojarzeniu z innym lekiem przeciwcukrzycowym. Wszystkie inne leki przeciwcukrzycowe odstawiono co najmniej trzy tygodnie przed rozpoczęciem leczenia w ramach badania.
pierwszym badaniu 328 pacjentów zostało losowo przydzielonych do grupy otrzymującej 30 mg ACTOS lub placebo raz na dobę przez 16 tygodni dodatkowo do aktualnego schematu leczenia metforminą. Leczenie ACTOS 30 mg jako skojarzenie z metforminą spowodowało statystycznie istotną poprawę HbA1c i FPG w punkcie końcowym w porównaniu z skojarzeniem placebo z metforminą (patrz Tabela 22).
W drugim badaniu 827 pacjentów zostało losowo przydzielonych do grupy otrzymującej 30 mg lub 45 mg preparatu ACTOS 30 mg raz na dobę przez 24 tygodnie oprócz aktualnego schematu leczenia metforminą. Średnie zmniejszenie HbA1c w stosunku do wartości wyjściowej w 24. tygodniu wyniosło 0,8% dla dawki 30 mg i 1,0% dla dawki 45 mg (patrz Tabela 23). Średnie zmniejszenie FPG w stosunku do wartości wyjściowej w 24. tygodniu wynosiło 38 mg/dl dla dawki 30 mg i 51 mg/dl dla dawki 45 mg.
Efekt terapeutyczny preparatu ACTOS w skojarzeniu z metforminą obserwowano u pacjentów niezależnie od dawki metforminy.
Dodatek do prób insulinowych
Przeprowadzono dwa badania kliniczne preparatu ACTOS 15 mg w skojarzeniu z insuliną. Oba badania obejmowały pacjentów z cukrzycą typu 2 przyjmujących insulinę w monoterapii lub w skojarzeniu z innym lekiem przeciwcukrzycowym. Wszystkie inne leki przeciwcukrzycowe zostały odstawione przed rozpoczęciem leczenia w ramach badania. W pierwszym badaniu 566 pacjentów przydzielono losowo do grupy otrzymującej 15 mg lub 30 mg preparatu ACTOS 15 mg lub placebo raz na dobę przez 16 tygodni oprócz schematu leczenia insuliną. Leczenie ACTOS 30 mg jako skojarzenie z insuliną spowodowało statystycznie istotną poprawę HbA1c i FPG w punkcie końcowym w porównaniu z skojarzeniem placebo z insuliną (patrz Tabela 24). Średnia dzienna dawka insuliny wyjściowa w każdej grupie leczenia wynosiła około 70 jednostek. U większości pacjentów (75% ogółem, 86% leczonych placebo, 77% leczonych ACTOS 15 mg i 61% leczonych ACTOS 30 mg) nie wystąpiła zmiana dobowej dawki insuliny od wizyty początkowej do końcowej wizyty w ramach badania. Średnia zmiana w stosunku do wartości początkowej dawki dobowej insuliny (w tym pacjentów bez modyfikacji dawki insuliny) wyniosła -3 jednostki u pacjentów leczonych ACTOS 15 mg, -8 jednostek u pacjentów leczonych ACTOS 30 mg i -1 jednostka u pacjentów leczone placebo.
drugim badaniu 690 pacjentów otrzymujących średnio 60 jednostek insuliny na dobę zostało losowo przydzielonych do grupy otrzymującej 30 mg lub 45 mg ACTOS raz na dobę przez 24 tygodnie jako dodatek do dotychczasowego schematu insulinoterapii. Średnie zmniejszenie w stosunku do wartości wyjściowej w 24. tygodniu HbA1c wyniosło 1,2% dla dawki 30 mg i 1,5% dla dawki 45 mg. Średnie zmniejszenie FPG w stosunku do wartości wyjściowej w 24. tygodniu wynosiło 32 mg/dl dla dawki 30 mg i 46 mg/dl dla dawki 45 mg (patrz Tabela 25). Średnia dzienna dawka insuliny na początku badania w obu leczonych grupach wynosiła około 70 jednostek. U większości pacjentów (55% ogółem, 58% leczonych ACTOS 30 mg i 52% leczonych ACTOS 45 mg) nie wystąpiła zmiana dobowej dawki insuliny od wizyty początkowej do ostatniej wizyty w ramach badania. Średnia zmiana w stosunku do wartości wyjściowej dawki dobowej insuliny (w tym pacjentów bez modyfikacji dawki insuliny) wyniosła -5 jednostek u pacjentów leczonych ACTOS 30 mg i -8 jednostek u pacjentów leczonych ACTOS 45 mg.
Efekt terapeutyczny preparatu ACTOS w skojarzeniu z insuliną obserwowano u pacjentów niezależnie od dawki insuliny.
INFORMACJA O PACJENCIE
ACTOS (ak-TOS) (pioglitazon) Tabletki
Przeczytaj uważnie ten Przewodnik po lekach przed rozpoczęciem przyjmowania ACTOS 15 mg i za każdym razem, gdy otrzymujesz uzupełnienie. Mogą pojawić się nowe informacje. Ta informacja nie zastępuje rozmowy z lekarzem na temat swojego stanu zdrowia lub leczenia. W przypadku jakichkolwiek pytań dotyczących ACTOS należy zwrócić się do lekarza lub farmaceuty.
Jakie są najważniejsze informacje, które powinienem wiedzieć o ACTOS?
ACTOS może powodować poważne skutki uboczne, w tym nową lub gorszą niewydolność serca.
- ACTOS 15 mg może powodować zatrzymanie przez organizm dodatkowej ilości płynów (zatrzymanie płynów), co prowadzi do obrzęku (obrzęku) i przyrostu masy ciała. Dodatkowy płyn ustrojowy może pogorszyć niektóre problemy z sercem lub prowadzić do niewydolności serca. Niewydolność serca oznacza, że serce nie pompuje krwi wystarczająco dobrze
- Nie należy stosować leku ACTOS, jeśli u pacjenta występuje ciężka niewydolność serca
- Jeśli u pacjenta występuje niewydolność serca z objawami (takimi jak duszność lub obrzęk), nawet jeśli objawy te nie są ciężkie, ACTOS może nie być dla niego odpowiedni
Zadzwoń do lekarza natychmiast, jeśli masz którekolwiek z poniższych:
- obrzęk lub zatrzymanie płynów, szczególnie w kostkach lub nogach
- duszność lub trudności w oddychaniu, zwłaszcza w pozycji leżącej
- niezwykle szybki przyrost wagi
- niezwykłe zmęczenie
ACTOS może powodować inne poważne skutki uboczne. Zobacz „Jakie są możliwe skutki uboczne ACTOS?”
Co to jest ACTOS?
ACTOS 15mg to lek na receptę stosowany w połączeniu z dietą i ćwiczeniami w celu poprawy kontroli poziomu cukru we krwi (glukozy) u osób dorosłych z cukrzycą typu 2. ACTOS to lek przeciwcukrzycowy o nazwie pioglitazon, który można przyjmować samodzielnie lub z innymi lekami przeciwcukrzycowymi.
Nie wiadomo, czy ACTOS jest bezpieczny i skuteczny u dzieci w wieku poniżej 18 lat. ACTOS nie jest zalecany do stosowania u dzieci.
ACTOS nie jest przeznaczony dla osób z cukrzycą typu 1.
ACTOS 30mg nie jest przeznaczony dla osób z cukrzycową kwasicą ketonową (podwyższone stężenie ketonów we krwi lub moczu).
Kto nie powinien brać ACTOS?
Zobacz „Jakie są najważniejsze informacje, które powinienem wiedzieć o ACTOS 15mg?”
Nie należy przyjmować leku ACTOS 15 mg, jeśli:
- mieć ciężką niewydolność serca
- jesteś uczulony na którykolwiek ze składników preparatu ACTOS. Pełna lista składników preparatu ACTOS znajduje się na końcu niniejszego Przewodnika po lekach
Przed rozpoczęciem stosowania leku ACTOS należy porozmawiać z lekarzem, jeśli u pacjenta występuje którykolwiek z tych stanów.
O czym powinienem powiedzieć lekarzowi przed zażyciem ACTOS 30mg?
Przed zastosowaniem leku ACTOS należy poinformować lekarza, jeśli:
- mieć niewydolność serca
- chorujesz na cukrzycę typu 1 („młodzieńczą”) lub miałeś cukrzycową kwasicę ketonową
- cierpisz na cukrzycową chorobę oczu, która powoduje obrzęk tylnej części oka (obrzęk plamki żółtej)
- masz problemy z wątrobą
- masz lub miałeś raka pęcherza moczowego;
- są w ciąży lub planują zajść w ciążę. Nie wiadomo, czy ACTOS 15 mg może zaszkodzić nienarodzonemu dziecku. Jeśli jesteś w ciąży lub planujesz zajść w ciążę, porozmawiaj z lekarzem o najlepszym sposobie kontrolowania poziomu glukozy we krwi podczas ciąży
- jesteś kobietą przed menopauzą (przed „zmianą życia”), która nie miesiączkuje regularnie lub w ogóle. ACTOS 30mg może zwiększyć prawdopodobieństwo zajścia w ciążę. Porozmawiaj ze swoim lekarzem o możliwościach antykoncepcji podczas przyjmowania leku ACTOS. Należy natychmiast poinformować lekarza, jeśli pacjentka zajdzie w ciążę podczas przyjmowania leku ACTOS
- karmisz piersią lub planujesz karmić piersią. Nie wiadomo, czy ACTOS przenika do mleka i czy może zaszkodzić dziecku. Porozmawiaj z lekarzem o najlepszym sposobie kontrolowania poziomu glukozy we krwi podczas karmienia piersią
Poinformuj lekarza o wszystkich przyjmowanych lekach w tym leki na receptę i bez recepty, witaminy i suplementy ziołowe.
ACTOS 30 mg i niektóre inne leki mogą na siebie wzajemnie wpływać. Może być konieczna zmiana dawki leku ACTOS 15 mg lub niektórych innych leków.
Poznaj leki, które przyjmujesz. Zachowaj listę swoich leków i pokaż ją swojemu lekarzowi i farmaceucie przed rozpoczęciem przyjmowania nowego leku. Poinformują Cię, czy można przyjmować ACTOS 15 mg z innymi lekami.
Jak powinienem przyjmować ACTOS 15mg?
- Lek ACTOS 15 mg należy przyjmować zgodnie z zaleceniami lekarza
- Lekarz może zmienić dawkę leku ACTOS. Nie należy zmieniać dawki leku ACTOS, chyba że tak zaleci lekarz:
- ACTOS może być przepisywany samodzielnie lub z innymi lekami przeciwcukrzycowymi. Będzie to zależeć od tego, jak dobrze kontrolowany jest poziom cukru we krwi
- Lek ACTOS 15 mg należy przyjmować raz dziennie, z posiłkiem lub bez
- W przypadku pominięcia dawki leku ACTOS 15 mg, następną dawkę należy przyjąć zgodnie z zaleceniami lekarza, chyba że lekarz zaleci inaczej. Nie należy przyjmować dwóch dawek jednorazowo następnego dnia
- przypadku zażycia zbyt dużej dawki leku ACTOS należy natychmiast skontaktować się z lekarzem lub udać się na pogotowie ratunkowe najbliższego szpitala
- Jeśli organizm jest pod wpływem stresu, na przykład z powodu gorączki, infekcji, wypadku lub zabiegu chirurgicznego, może być konieczna zmiana dawki leków przeciwcukrzycowych. Natychmiast zadzwoń do lekarza
- Pozostań na diecie i programach ćwiczeń oraz regularnie sprawdzaj poziom cukru we krwi podczas przyjmowania ACTOS
- Lekarz powinien wykonać pewne badania krwi przed rozpoczęciem i podczas przyjmowania leku ACTOS
- Lekarz powinien również wykonać badanie hemoglobiny A1C, aby sprawdzić, jak dobrze kontroluje się poziom cukru we krwi za pomocą ACTOS
- Lekarz powinien regularnie sprawdzać oczy podczas przyjmowania leku ACTOS
Jakie są możliwe skutki uboczne ACTOS?
ACTOS może powodować poważne skutki uboczne, w tym:
- Zobacz „Jakie są najważniejsze informacje, które powinienem wiedzieć o ACTOS?”
- niski poziom cukru we krwi (hipoglikemia). Może się to zdarzyć, jeśli pomijasz posiłki, stosujesz również inny lek obniżający poziom cukru we krwi lub masz pewne problemy zdrowotne. Jeśli poziom cukru we krwi jest zbyt niski, mogą wystąpić zawroty głowy, zawroty głowy, drżenie lub głód. Zadzwoń do lekarza, jeśli niski poziom cukru we krwi stanowi dla Ciebie problem
- problemy z wątrobą. Zadzwoń do lekarza od razu, jeśli masz:
- nudności lub wymioty
- ból brzucha
- niezwykłe lub niewyjaśnione zmęczenie
- utrata apetytu
- ciemny mocz
- zażółcenie skóry lub białek oczu
- rak pęcherza. Podczas przyjmowania leku ACTOS może wystąpić zwiększone ryzyko zachorowania na raka pęcherza moczowego. Nie należy przyjmować leku ACTOS 15 mg w przypadku leczenia raka pęcherza moczowego. Należy natychmiast poinformować lekarza, jeśli wystąpi którykolwiek z następujących objawów raka pęcherza moczowego:
- krew lub czerwone zabarwienie moczu
- zwiększona potrzeba oddawania moczu
- ból podczas oddawania moczu
- złamane kości (złamania). Zwykle w dłoni, ramieniu lub stopie u kobiet. Porozmawiaj ze swoim lekarzem, aby uzyskać poradę, jak zachować zdrowe kości.
- cukrzycowa choroba oczu z obrzękiem tylnej części oka (obrzęk plamki żółtej). Należy natychmiast poinformować lekarza, jeśli wystąpią jakiekolwiek zmiany w widzeniu. Twój lekarz powinien regularnie sprawdzać oczy
- uwolnienie komórki jajowej z jajnika u kobiety (owulacja) prowadzące do ciąży. Owulacja może wystąpić, gdy kobiety przed menopauzą, które nie mają regularnych miesiączek, przyjmują ACTOS. Może to zwiększyć Twoje szanse na zajście w ciążę
- objawy przeziębienia (infekcja górnych dróg oddechowych)
- ból głowy
- infekcja zatok
- ból w mięśniach
- ból gardła
Najczęstsze działania niepożądane ACTOS to:
Należy poinformować lekarza, jeśli wystąpią jakiekolwiek objawy niepożądane, które Cię niepokoją lub które nie ustępują.
To nie wszystkie skutki uboczne ACTOS. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Jak przechowywać ACTOS 15mg?
- Przechowywać ACTOS 15mg w temperaturze od 68 do 77 °F (20 °C do 25 °C). Przechowywać ACTOS w oryginalnym opakowaniu i chronić przed światłem
- Trzymaj butelkę ACTOS szczelnie zamkniętą i utrzymuj tabletki w stanie suchym
- Przechowuj ACTOS i wszystkie leki w miejscu niedostępnym dla dzieci
Ogólne informacje o bezpiecznym i skutecznym stosowaniu ACTOS
Leki są czasami przepisywane do celów innych niż wymienione w Przewodniku po lekach. Nie należy stosować leku ACTOS w przypadku schorzenia, na które nie został przepisany. Nie podawaj ACTOS innym osobom, nawet jeśli mają takie same objawy jak ty. Może im to zaszkodzić.
Niniejszy przewodnik po lekach podsumowuje najważniejsze informacje o ACTOS. Jeśli chcesz uzyskać więcej informacji, porozmawiaj ze swoim lekarzem. Możesz poprosić swojego lekarza lub farmaceutę o informacje na temat ACTOS, które są przeznaczone dla pracowników służby zdrowia. Aby uzyskać więcej informacji, odwiedź stronę www.actos.com lub zadzwoń pod numer 1-877-825-3327.
Jakie są składniki preparatu ACTOS 15mg?
Składnik aktywny: pioglitazon Składniki nieaktywne: monohydrat laktozy 15 mg, hydroksypropyloceluloza, wapń karboksymetylocelulozy i stearynian magnezu
Ten przewodnik po lekach został zatwierdzony przez amerykańską Agencję ds. Żywności i Leków.
