Amaryl 1mg, 2mg, 4mg Glimepiride Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Amaryl 1mg i jak się go stosuje?
Amaryl 4mg to lek na receptę stosowany w leczeniu objawów cukrzycy typu 2. Amaryl 4mg może być stosowany samodzielnie lub z innymi lekami.
Amaryl 2mg należy do klasy leków przeciwcukrzycowych, sulfonylomoczników.
Nie wiadomo, czy Amaryl jest bezpieczny i skuteczny u dzieci.
Jakie są możliwe skutki uboczne Amaryl?
Amaryl może powodować poważne działania niepożądane, w tym:
- blada lub pożółkła skóra,
- ciemny kolor moczu,
- dezorientacja,
- słabość i
- gorączka
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze działania niepożądane Amaryl obejmują:
- ból głowy,
- zawroty głowy,
- słabość,
- nudności i
- niski poziom cukru we krwi
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Amaryl. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OPIS
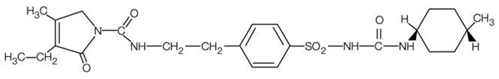
AMARYL jest doustną sulfonylomocznikiem, która zawiera substancję czynną glimepiryd. Chemicznie glimepiryd jest identyfikowany jako 1-[[p-[2-(3-etylo-4-metylo-2-okso-3-pirolino-1-karboksyamido)etylo]fenylo]sulfonylo]-3-(trans-4- metylocykloheksylo)mocznik (C24H34N4O5S) o masie cząsteczkowej 490,62. Glimepiryd jest białym do żółtawobiałego, krystalicznym proszkiem bez zapachu lub praktycznie bez zapachu i jest praktycznie nierozpuszczalny w wodzie. Wzór strukturalny to:
Tabletki AMARYL zawierają substancję czynną glimepiryd oraz następujące składniki nieaktywne: laktozę (uwodnioną), glikolan sodowy skrobi, powidon, celulozę mikrokrystaliczną i stearynian magnezu. Ponadto tabletki AMARYL 1 mg zawierają czerwień żelazową, tabletki AMARYL 2 mg zawierają lak aluminiowy żelazowy żółty i FD&C Blue #2, a tabletki AMARYL 4 mg zawierają lak aluminiowy FD&C Blue #2.
WSKAZANIA
AMARYL 2 mg jest wskazany jako dodatek do diety i ćwiczeń fizycznych w celu poprawy kontroli glikemii u osób dorosłych z cukrzycą typu 2 [patrz Studia kliniczne ].
Ważne ograniczenia użytkowania
AMARYL nie powinien być stosowany w leczeniu cukrzycy typu 1 lub cukrzycowej kwasicy ketonowej, ponieważ nie byłby skuteczny w tych warunkach.
DAWKOWANIE I SPOSÓB PODAWANIA
Zalecane dawkowanie
AMARYL 1mg należy podawać ze śniadaniem lub pierwszym głównym posiłkiem dnia.
Zalecana dawka początkowa leku AMARYL wynosi 1 mg lub 2 mg raz na dobę. Pacjenci ze zwiększonym ryzykiem hipoglikemii (np. osoby w podeszłym wieku lub pacjenci z zaburzeniami czynności nerek) powinni rozpocząć od 1 mg raz na dobę [patrz OSTRZEŻENIA I ŚRODKI oraz Stosowanie w określonych populacjach ].
Po osiągnięciu dobowej dawki 2 mg, dalsze zwiększanie dawki można zwiększać o 1 mg lub 2 mg w zależności od odpowiedzi glikemicznej pacjenta. Wzmocnienie nie powinno występować częściej niż co 1-2 tygodnie. U pacjentów ze zwiększonym ryzykiem hipoglikemii zaleca się konserwatywny schemat dostosowywania dawki [patrz OSTRZEŻENIA I ŚRODKI oraz Stosowanie w określonych populacjach ].
Maksymalna zalecana dawka to 8 mg raz na dobę.
Pacjenci przechodzący na AMARYL 1 mg z pochodnych sulfonylomocznika o dłuższym okresie półtrwania (np. chlorpropamid) mogą wykazywać nakładające się działanie leku przez 1-2 tygodnie i powinni być odpowiednio monitorowani pod kątem hipoglikemii.
Gdy kolesewelam jest podawany jednocześnie z glimepirydem, maksymalne stężenie w osoczu i całkowita ekspozycja na glimepiryd są zmniejszone. Dlatego AMARYL 2 mg należy podawać co najmniej 4 godziny przed kolesewelamem.
JAK DOSTARCZONE
Formy dawkowania i mocne strony
AMARYL 4mg ma postać tabletek:
- 1 mg (różowa, płaska, podłużna, z naciętymi bokami na podwójnej ćwiartce, z nadrukiem „AMA RYL” po jednej stronie)
- 2 mg (zielona, płaska, podłużna, z naciętymi bokami w podwójnej ćwiartce, z nadrukiem „AMA RYL” po jednej stronie)
- 4 mg (niebieska, płaska, podłużna, z naciętymi bokami w podwójnej dwudzielnej, z nadrukiem „AMA RYL” po jednej stronie)
Składowania i stosowania
AMARYLA tabletki są dostępne w następujących mocach i wielkościach opakowań:
1 mg (różowe, spłaszczone, podłużne z naciętymi bokami w podwójnej bis, z nadrukiem „AMA RYL” z jednej strony) w butelkach po 100 ( NDC 0039-0221-10)
2 mg (zielone, spłaszczone, podłużne z naciętymi bokami w podwójnej bis, z nadrukiem „AMA RYL” z jednej strony) w butelkach po 100 ( NDC 0039-0222-10)
4 mg (niebieskie, spłaszczone, podłużne z karbowanymi bokami w podwójnej bis, z nadrukiem „AMA RYL” z jednej strony) w butelkach po 100 ( NDC 0039-0223-10)
Przechowywać w 25°C (77°F); wycieczki dozwolone do 20 - 25°C (68 - 77°F) (patrz Temperatura pokojowa kontrolowana przez USP ).
Dozować w dobrze zamkniętych pojemnikach z zamknięciami bezpieczeństwa.
Sanofi- Aventis US LLC, Bridgewater, NJ 08807, A SANOFI COMPANY. Zmieniono grudzień 2016
SKUTKI UBOCZNE
Następujące poważne działania niepożądane omówiono bardziej szczegółowo poniżej oraz w innych miejscach na etykiecie:
- Hipoglikemia [patrz OSTRZEŻENIA I ŚRODKI ]
- Niedokrwistość hemolityczna [patrz OSTRZEŻENIA I ŚRODKI ]
W badaniach klinicznych najczęstszymi działaniami niepożądanymi produktu AMARYL 4 mg były hipoglikemia, zawroty głowy, osłabienie, ból głowy i nudności.
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
kontrolowanych badaniach klinicznych około 2800 pacjentów z cukrzycą typu 2 leczono preparatem AMARYL 4 mg. W tych badaniach około 1700 pacjentów było leczonych AMARYL przez co najmniej 1 rok.
W tabeli 1 podsumowano zdarzenia niepożądane, inne niż hipoglikemia, które zgłoszono w 11 zbiorczych badaniach kontrolowanych placebo, niezależnie od tego, czy uznano je za prawdopodobnie lub prawdopodobnie związane z badanym lekiem. Czas trwania leczenia wynosił od 13 tygodni do 12 miesięcy. Zgłaszane terminy reprezentują te, które wystąpiły z częstością ≥ 5% wśród pacjentów leczonych AMARYL i częściej niż u pacjentów otrzymujących placebo.
Hipoglikemia
W randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniu monoterapii trwającym 14 tygodni, pacjenci już leczeni pochodnymi sulfonylomocznika przeszli 3-tygodniowy okres wypłukiwania, a następnie zostali losowo przydzieleni do grupy AMARYL 1 mg, 4 mg, 8 mg lub placebo. Pacjenci przydzieleni losowo do grupy otrzymującej AMARYL 4 mg lub 8 mg przechodzili wymuszone miareczkowanie od dawki początkowej 1 mg do tych dawek końcowych, zgodnie z tolerancją [patrz Studia kliniczne ]. Ogólna częstość występowania możliwej hipoglikemii (zdefiniowana na podstawie obecności co najmniej jednego objawu, który według badacza może być związany z hipoglikemią; jednoczesny pomiar stężenia glukozy nie był wymagany) wynosiła 4% dla AMARYL 1 mg, 17% dla AMARYL 4 mg, 16 % dla AMARYL 8 mg i 0% dla placebo. Wszystkie te zdarzenia były leczone samemu.
W randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniu monoterapii trwającym 22 tygodnie, pacjenci otrzymywali dawkę początkową wynoszącą 1 mg AMARYL lub placebo na dobę. Dawkę AMARYL 2 mg miareczkowano do docelowego poziomu glukozy w osoczu na czczo 90-150 mg/dl. Końcowe dawki dobowe AMARYL 2 mg wynosiły 1, 2, 3, 4, 6 lub 8 mg [patrz Studia kliniczne ]. Ogólna częstość występowania możliwej hipoglikemii (jak zdefiniowano powyżej dla 14-tygodniowego badania) dla AMARYL w porównaniu z placebo wynosiła 19,7% w porównaniu z 3,2%. Wszystkie te wydarzenia były traktowane przez samych siebie.
Przybranie na wadze: AMARYL, podobnie jak wszystkie pochodne sulfonylomocznika, może powodować przyrost masy ciała [patrz Studia kliniczne ].
Reakcje alergiczne: badaniach klinicznych reakcje alergiczne, takie jak świąd, rumień, pokrzywka oraz wykwity odropodobne lub grudkowo-plamkowe występowały u mniej niż 1% pacjentów leczonych AMARYL. Mogą one ustąpić pomimo kontynuowania leczenia AMARYL. Istnieją doniesienia po wprowadzeniu do obrotu o poważniejszych reakcjach alergicznych (np. duszność, niedociśnienie, wstrząs) [patrz OSTRZEŻENIA I ŚRODKI ].
Testy laboratoryjne
Podwyższona aminotransferaza alaninowa w surowicy (ALT): W 11 połączonych badaniach z grupą kontrolną placebo dotyczącą AMARYL, 1,9% pacjentów leczonych AMARYL i 0,8% pacjentów otrzymujących placebo rozwinęło aktywność AlAT w surowicy ponad 2-krotnie wyższą od górnej granicy zakresu referencyjnego.
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane podczas stosowania produktu AMARYL po dopuszczeniu do obrotu. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek.
- Ciężkie reakcje nadwrażliwości, w tym anafilaksja, obrzęk naczynioruchowy i zespół Stevensa-Johnsona [patrz OSTRZEŻENIA I ŚRODKI ]
- Niedokrwistość hemolityczna u pacjentów z niedoborem G6PD i bez niego [patrz OSTRZEŻENIA I ŚRODKI ]
- Zaburzenia czynności wątroby (np. z cholestazą i żółtaczką), a także zapalenie wątroby, które może prowadzić do niewydolności wątroby.
- Porfiria skórna późna, reakcje nadwrażliwości na światło i alergiczne zapalenie naczyń
- Leukopenia, agranulocytoza, niedokrwistość aplastyczna i pancytopenia
- Małopłytkowość (w tym ciężkie przypadki z liczbą płytek poniżej 10 000/μl) i plamica małopłytkowa
- Reakcje na porfirię wątrobową i reakcje podobne do disulfiramu
- Hiponatremia i zespół nieprawidłowego wydzielania hormonu antydiuretycznego (SIADH), najczęściej u pacjentów przyjmujących inne leki lub ze schorzeniami, o których wiadomo, że powodują hiponatremię lub zwiększają wydzielanie hormonu antydiuretycznego
- Dysgeuzja
- Łysienie
INTERAKCJE Z LEKAMI
Leki wpływające na metabolizm glukozy
Wiele leków wpływa na metabolizm glukozy i może wymagać dostosowania dawki produktu AMARYL 4 mg, a szczególnie ścisłego monitorowania pod kątem hipoglikemii lub pogorszenia kontroli glikemii.
Poniżej przedstawiono przykłady leków, które mogą nasilać działanie hipoglikemizujące sulfonylomoczników, w tym AMARYL 2 mg, zwiększając podatność i/lub nasilenie hipoglikemii: doustne leki przeciwcukrzycowe, octan pramlintydu, insulina, inhibitory konwertazy angiotensyny (ACE), Antagoniści receptora H2, fibraty, propoksyfen, pentoksyfilina, analogi somatostatyny, sterydy anaboliczne i androgeny, cyklofosfamid, fenyramidol, guanetydyna, flukonazol, sulfinpirazon, tetracykliny, klarytromycyna, dizopiramid, chinolony i fluoksetyna, które są silnie związane z białkami niesteroidowe leki przeciwzapalne, salicylany, sulfonamidy, chloramfenikol, kumaryny, probenecyd i inhibitory monoaminooksydazy. Gdy te leki są podawane pacjentowi otrzymującemu AMARYL, należy ściśle monitorować pacjenta pod kątem hipoglikemii. Po odstawieniu tych leków pacjentowi otrzymującemu AMARYL 2 mg należy uważnie monitorować pacjenta pod kątem pogorszenia kontroli glikemii.
Poniżej przedstawiono przykłady leków, które mogą zmniejszać działanie sulfonylomoczników, w tym AMARYL, zmniejszające stężenie glukozy, prowadząc do pogorszenia kontroli glikemii: danazol, glukagon, somatropina, inhibitory proteazy, atypowe leki przeciwpsychotyczne (np. olanzapina i klozapina), barbiturany, diazoksyd, środki przeczyszczające ryfampicyna, tiazydy i inne leki moczopędne, kortykosteroidy, fenotiazyny, hormony tarczycy, estrogeny, doustne środki antykoncepcyjne, fenytoina, kwas nikotynowy, sympatykomimetyki (np. epinefryna, albuterol, terbutalina) i izoniazyd. Gdy te leki są podawane pacjentowi otrzymującemu AMARYL 2 mg, należy uważnie monitorować pacjenta pod kątem pogorszenia kontroli glikemii. Po odstawieniu tych leków pacjentowi otrzymującemu AMARYL 2 mg należy uważnie monitorować pacjenta pod kątem hipoglikemii.
Beta-adrenolityki, klonidyna i rezerpina mogą prowadzić do nasilenia lub osłabienia działania obniżającego stężenie glukozy przez AMARYL.
Zarówno ostre, jak i przewlekłe spożywanie alkoholu może w nieprzewidywalny sposób nasilać lub osłabiać działanie obniżające stężenie glukozy 1 mg AMARYL.
Objawy hipoglikemii mogą być zmniejszone lub nieobecne u pacjentów przyjmujących leki sympatykolityczne, takie jak beta-adrenolityki, klonidyna, guanetydyna i rezerpina.
Mikonazol
Zgłaszano potencjalną interakcję między doustnym mikonazolem a pochodnymi sulfonylomocznika, prowadzącą do ciężkiej hipoglikemii. Nie wiadomo, czy ta interakcja występuje również z innymi postaciami dawkowania mikonazolu.
Interakcje cytochromu P450 2C9
Może wystąpić interakcja między glimepirydem a inhibitorami (np. flukonazolem) i induktorami (np. ryfampicyną) cytochromu P450 2C9. Flukonazol może hamować metabolizm glimepirydu, powodując zwiększenie stężenia glimepirydu w osoczu, co może prowadzić do hipoglikemii. Ryfampicyna może indukować metabolizm glimepirydu, powodując zmniejszenie stężenia glimepirydu w osoczu, co może prowadzić do pogorszenia kontroli glikemii.
Jednoczesne podawanie kolesewelamu
Kolesewelam może zmniejszać maksymalne stężenie w osoczu i całkowitą ekspozycję na glimepiryd, gdy oba są podawane jednocześnie. Jednak wchłanianie nie zmniejsza się, gdy glimepiryd jest podawany 4 godziny przed kolesewelamem. Dlatego AMARYL należy podawać co najmniej 4 godziny przed kolesewelamem.
OSTRZEŻENIA
Zawarte jako część ŚRODKI OSTROŻNOŚCI Sekcja.
ŚRODKI OSTROŻNOŚCI
Hipoglikemia
Wszystkie pochodne sulfonylomocznika, w tym AMARYL, mogą powodować ciężką hipoglikemię [patrz DZIAŁANIA NIEPOŻĄDANE ]. Zdolność pacjenta do koncentracji i reagowania może być osłabiona w wyniku hipoglikemii. Te upośledzenia mogą stanowić ryzyko w sytuacjach, w których te zdolności są szczególnie ważne, takich jak prowadzenie pojazdów lub obsługiwanie innych maszyn. Ciężka hipoglikemia może prowadzić do utraty przytomności lub drgawek i może skutkować czasowym lub trwałym upośledzeniem funkcji mózgu lub śmiercią.
Pacjenci muszą być przeszkoleni w zakresie rozpoznawania i leczenia hipoglikemii. Należy zachować ostrożność podczas rozpoczynania i zwiększania dawki produktu AMARYL 2 mg u pacjentów, którzy mogą być predysponowani do hipoglikemii (np. osoby starsze, pacjenci z zaburzeniami czynności nerek, pacjenci przyjmujący inne leki przeciwcukrzycowe). Szczególnie podatni na hipoglikemizujące działanie leków hipoglikemizujących są pacjenci osłabieni lub niedożywieni, a także pacjenci z zaburzeniami czynności nadnerczy, przysadki lub wątroby. Hipoglikemia jest również bardziej prawdopodobna, gdy spożycie kalorii jest niedostateczne, po ciężkim lub długotrwałym wysiłku fizycznym lub po spożyciu alkoholu.
Wczesne objawy ostrzegawcze hipoglikemii mogą być różne lub mniej nasilone u pacjentów z neuropatią autonomiczną, w podeszłym wieku oraz u pacjentów przyjmujących leki blokujące receptory beta-adrenergiczne lub inne leki sympatykolityczne. Sytuacje te mogą skutkować ciężką hipoglikemią, zanim pacjent zda sobie sprawę z hipoglikemii.
Reakcje nadwrażliwości
Po wprowadzeniu produktu do obrotu zgłaszano reakcje nadwrażliwości u pacjentów leczonych AMARYL, w tym ciężkie reakcje, takie jak anafilaksja, obrzęk naczynioruchowy i zespół Stevensa-Johnsona. W przypadku podejrzenia reakcji nadwrażliwości należy niezwłocznie odstawić AMARYL, ocenić inne potencjalne przyczyny reakcji i wdrożyć alternatywne leczenie cukrzycy.
Niedokrwistość hemolityczna
Sulfonylomoczniki mogą powodować niedokrwistość hemolityczną u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej (G6PD). Ponieważ AMARYL 4 mg jest pochodną sulfonylomocznika, należy zachować ostrożność u pacjentów z niedoborem G6PD i rozważyć zastosowanie alternatywy bez sulfonylomocznika. Istnieją również doniesienia po wprowadzeniu do obrotu o niedokrwistości hemolitycznej u pacjentów otrzymujących AMARYL 1 mg, u których nie rozpoznano niedoboru G6PD [patrz DZIAŁANIA NIEPOŻĄDANE ].
Zwiększone ryzyko zgonu z przyczyn sercowo-naczyniowych dzięki sulfonylomocznikom
Istnieją doniesienia, że podawanie doustnych leków hipoglikemizujących wiąże się ze zwiększoną śmiertelnością sercowo-naczyniową w porównaniu z leczeniem samą dietą lub dietą z insuliną. To ostrzeżenie jest oparte na badaniu przeprowadzonym przez University Group Diabetes Program (UGDP), długoterminowe, prospektywne badanie kliniczne mające na celu ocenę skuteczności leków hipoglikemizujących w zapobieganiu lub opóźnianiu powikłań naczyniowych u pacjentów z insulinoniezależną chorobą. cukrzyca. W badaniu wzięło udział 823 pacjentów, którzy zostali losowo przypisani do jednej z czterech grup terapeutycznych UGDP poinformowali, że u pacjentów leczonych przez 5 do 8 lat dietą oraz stałą dawką tolbutamidu (1,5 grama dziennie) śmiertelność z przyczyn sercowo-naczyniowych wynosiła około 2 i pół raza pacjentów leczonych samą dietą. Nie zaobserwowano istotnego wzrostu śmiertelności całkowitej, ale zaprzestano stosowania tolbutamidu ze względu na wzrost śmiertelności z przyczyn sercowo-naczyniowych, co ograniczyło możliwość wykazania przez badanie wzrostu śmiertelności ogólnej. Pomimo kontrowersji dotyczących interpretacji tych wyników, wyniki badania UGDP stanowią odpowiednią podstawę do tego ostrzeżenia. Pacjent powinien zostać poinformowany o potencjalnych zagrożeniach i korzyściach związanych ze stosowaniem produktu AMARYL 4 mg oraz o alternatywnych metodach leczenia. Chociaż w tym badaniu uwzględniono tylko jeden lek z grupy pochodnych sulfonylomocznika (tolbutamid), z punktu widzenia bezpieczeństwa rozsądne jest rozważenie, że ostrzeżenie to może również dotyczyć innych doustnych leków hipoglikemizujących z tej klasy, ze względu na ich bliskie podobieństwo w sposobie działanie i struktura chemiczna.
Wyniki makronaczyniowe
Nie przeprowadzono badań klinicznych, które wykazałyby rozstrzygające dowody na zmniejszenie ryzyka makronaczyniowego podczas stosowania produktu AMARYL lub jakiegokolwiek innego leku przeciwcukrzycowego.
Toksykologia niekliniczna
Karcynogeneza, mutageneza i upośledzenie płodności
Badania na szczurach przy dawkach do 5000 części na milion (ppm) w pełnoporcjowej paszy (około 340-krotność maksymalnej zalecanej dawki dla człowieka, w oparciu o powierzchnię) przez 30 miesięcy nie wykazały dowodów na karcynogenezę. U myszy podawanie glimepirydu przez 24 miesiące powodowało wzrost tworzenia łagodnego gruczolaka trzustki, który był zależny od dawki i uważany za wynik przewlekłej stymulacji trzustki. Nie zaobserwowano tworzenia gruczolaków u myszy przy dawce 320 ppm w paszy pełnoporcjowej lub 46-54 mg/kg masy ciała/dzień. Jest to około 35-krotność maksymalnej zalecanej przez ludzi dawki 8 mg raz na dobę w oparciu o powierzchnię.
Glimepiryd nie wykazał działania mutagennego w szeregu badań mutagenności in vitro i in vivo (test Amesa, mutacja komórek somatycznych, aberracja chromosomowa, nieplanowana synteza DNA i test mikrojądrowy u myszy).
Nie stwierdzono wpływu glimepirydu na płodność samców myszy u zwierząt narażonych na dawki do 2500 mg/kg masy ciała (> 1700 razy większa od maksymalnej zalecanej dawki u ludzi w oparciu o powierzchnię). Glimepiryd nie miał wpływu na płodność samców i samic szczurów, którym podawano do 4000 mg/kg masy ciała (około 4000 razy większa od maksymalnej zalecanej dawki u ludzi w oparciu o powierzchnię).
Używaj w określonych populacjach
Ciąża
Ciąża Kategoria C
Nie ma odpowiednich i dobrze kontrolowanych badań nad AMARYL 2 mg u kobiet w ciąży. W badaniach na zwierzętach nie zaobserwowano zwiększenia liczby wad wrodzonych, ale wzrost śmiertelności płodów wystąpił u szczurów i królików po dawkach glimepirydu 50-krotności (szczury) i 0,1-krotności (króliki) maksymalnej zalecanej dawki u ludzi (na podstawie powierzchni ciała). Uważa się, że ta toksyczność dla płodu, obserwowana tylko przy dawkach wywołujących hipoglikemię matki, jest bezpośrednio związana z farmakologicznym (hipoglikemicznym) działaniem glimepirydu i była podobnie obserwowana w przypadku innych pochodnych sulfonylomocznika. AMARYL powinien być stosowany w okresie ciąży tylko wtedy, gdy potencjalna korzyść przewyższa potencjalne ryzyko dla płodu. Ponieważ dane sugerują, że nieprawidłowe stężenie glukozy we krwi w czasie ciąży wiąże się z większą częstością występowania wad wrodzonych, leczenie cukrzycy podczas ciąży powinno utrzymywać stężenie glukozy we krwi jak najbliżej normy.
Efekty nieteratogenne
noworodków urodzonych przez matki otrzymujące sulfonylomocznik w momencie porodu opisywano przedłużającą się ciężką hipoglikemię (4 do 10 dni).
Matki karmiące
Nie wiadomo, czy AMARYL 1 mg przenika do mleka ludzkiego. Podczas badań przed- i pourodzeniowych na szczurach, znaczące stężenia glimepirydu były obecne w mleku matki i surowicy młodych. Potomstwo szczurów narażone na wysoki poziom glimepirydu podczas ciąży i laktacji rozwinęło deformacje szkieletu polegające na skracaniu, pogrubianiu i zginaniu kości ramiennej w okresie poporodowym. Te deformacje szkieletu zostały określone jako wynik karmienia matek narażonych na działanie glimepirydu. Na podstawie tych danych na zwierzętach oraz potencjalnej hipoglikemii u karmionego niemowlęcia należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać podawanie produktu AMARYL 2 mg, biorąc pod uwagę znaczenie produktu AMARYL dla matki.
Zastosowanie pediatryczne
Farmakokinetykę, skuteczność i bezpieczeństwo produktu AMARYL 4 mg oceniano u dzieci z cukrzycą typu 2, jak opisano poniżej. AMARYL 4 mg nie jest zalecany u dzieci ze względu na niekorzystny wpływ na masę ciała i hipoglikemię.
Farmakokinetykę pojedynczej dawki 1 mg AMARYL oceniano u 30 pacjentów z cukrzycą typu 2 (mężczyźni = 7; kobiety = 23) w wieku od 10 do 17 lat. Średnie (± SD) AUC (339±203 ng·h/ml), Cmax (102±48 ng/ml) i t½ (3,1±1,7 godziny) dla glimepirydu były porównywalne z danymi historycznymi dotyczącymi dorosłych (AUC (0-ostatni ) 315±96 ng·h/ml, Cmax 103±34 ng/ml i t½ 5,3±4,1 godziny).
Bezpieczeństwo i skuteczność AMARYL u dzieci oceniano w 24-tygodniowym badaniu z pojedynczą ślepą próbą, w którym zrandomizowano 272 pacjentów (8-17 lat) z cukrzycą typu 2 do grupy AMARYL (n=135) lub metforminy (n=137). ). Do udziału kwalifikowali się zarówno pacjenci dotychczas nieleczeni (leczeni wyłącznie dietą i ćwiczeniami przez co najmniej 2 tygodnie przed randomizacją), jak i pacjenci wcześniej leczeni (ci wcześniej leczeni lub obecnie leczeni innymi doustnymi lekami przeciwcukrzycowymi przez co najmniej 3 miesiące). Pacjenci, którzy otrzymywali doustne leki przeciwcukrzycowe w momencie włączenia do badania, odstawili te leki przed randomizacją bez okresu wypłukiwania. AMARYL rozpoczęto od dawki 1 mg, a następnie zwiększono dawkę do 2, 4 lub 8 mg (średnia ostatnia dawka 4 mg) do tygodnia 12., w celu osiągnięcia samodzielnie monitorowanego stężenia glukozy we krwi z opuszki palca na czczo
Po 24 tygodniach ogólna średnia różnica w leczeniu HbA1c pomiędzy AMARYL 4 mg i metforminą wyniosła 0,2%, na korzyść metforminy (95% przedział ufności -0,3% do +0,6%). W oparciu o te wyniki, badanie nie spełniło swojego głównego celu, jakim było wykazanie podobnego obniżenia HbA1c przy zastosowaniu AMARYL 4 mg w porównaniu z metforminą.
Profil działań niepożądanych u dzieci i młodzieży leczonych AMARYL 2 mg był podobny do obserwowanego u dorosłych [patrz DZIAŁANIA NIEPOŻĄDANE ].
Incydenty hipoglikemii udokumentowane wartościami glukozy we krwi
Zastosowanie geriatryczne
badaniach klinicznych produktu AMARYL 2 mg 1053 z 3491 pacjentów (30%) było w wieku > 65 lat. Nie zaobserwowano ogólnych różnic w bezpieczeństwie lub skuteczności między tymi pacjentami a młodszymi pacjentami, ale nie można wykluczyć większej wrażliwości niektórych starszych osób.
Nie stwierdzono istotnych różnic w farmakokinetyce glimepirydu pomiędzy pacjentami z cukrzycą typu 2 ≤ 65 lat (n=49) i >65 lat (n=42) [patrz FARMAKOLOGIA KLINICZNA ].
Glimepiryd jest w znacznym stopniu wydalany przez nerki. Pacjenci w podeszłym wieku są bardziej narażeni na zaburzenia czynności nerek. Ponadto hipoglikemia może być trudna do rozpoznania u osób starszych [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz OSTRZEŻENIA I ŚRODKI ]. Należy zachować ostrożność podczas rozpoczynania AMARYL i zwiększania dawki AMARYL 1 mg w tej populacji pacjentów.
Zaburzenia czynności nerek
Aby zminimalizować ryzyko hipoglikemii, zalecana dawka początkowa AMARYL wynosi 1 mg na dobę u wszystkich pacjentów z cukrzycą typu 2 i zaburzeniami czynności nerek [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz OSTRZEŻENIA I ŚRODKI ].
Przeprowadzono badanie z wielokrotnym dostosowaniem dawki u 16 pacjentów z cukrzycą typu 2 i zaburzeniami czynności nerek, stosując dawki od 1 mg do 8 mg na dobę przez 3 miesiące. Wyjściowy klirens kreatyniny wahał się od 10-60 ml/min. Farmakokinetykę AMARYL oceniano w badaniu miareczkowania dawek wielokrotnych, a wyniki były zgodne z wynikami obserwowanymi u pacjentów włączonych do badania z pojedynczą dawką. W obu badaniach względny całkowity klirens AMARYL wzrastał, gdy czynność nerek była zaburzona. Oba badania wykazały również, że eliminacja dwóch głównych metabolitów była zmniejszona u pacjentów z zaburzeniami czynności nerek [patrz FARMAKOLOGIA KLINICZNA ].
PRZEDAWKOWAĆ
Przedawkowanie AMARYL 2 mg, podobnie jak w przypadku innych pochodnych sulfonylomocznika, może wywołać ciężką hipoglikemię. Łagodne epizody hipoglikemii można leczyć doustną glukozą. Ciężkie reakcje hipoglikemiczne stanowią nagłe przypadki medyczne wymagające natychmiastowego leczenia. Ciężką hipoglikemię ze śpiączką, drgawkami lub zaburzeniami neurologicznymi można leczyć glukagonem lub dożylnie glukozą. Konieczna może być ciągła obserwacja i dodatkowe spożycie węglowodanów, ponieważ hipoglikemia może nawrócić po widocznym wyzdrowieniu klinicznym [patrz OSTRZEŻENIA I ŚRODKI ].
PRZECIWWSKAZANIA
AMARYL jest przeciwwskazany u pacjentów z reakcją nadwrażliwości w wywiadzie na:
- Glimepiryd lub którykolwiek ze składników produktu [patrz OSTRZEŻENIA I ŚRODKI ].
Pochodne sulfonamidów: U pacjentów, u których wystąpiła reakcja alergiczna na pochodne sulfonamidów, może wystąpić reakcja alergiczna na AMARYL. Nie należy stosować leku AMARYL 4mg u pacjentów, u których w wywiadzie wystąpiła reakcja alergiczna na pochodne sulfonamidów.
Zgłaszane reakcje nadwrażliwości obejmują wykwity skórne ze świądem lub bez, a także bardziej poważne reakcje (np. anafilaksja, obrzęk naczynioruchowy, zespół Stevensa-Johnsona, duszność) [patrz OSTRZEŻENIA I ŚRODKI oraz DZIAŁANIA NIEPOŻĄDANE ].
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Glimepiryd przede wszystkim obniża poziom glukozy we krwi poprzez stymulację uwalniania insuliny z komórek beta trzustki. Sulfonylomoczniki wiążą się z receptorem sulfonylomocznika w błonie komórkowej komórek beta trzustki, co prowadzi do zamknięcia kanału potasowego wrażliwego na ATP, stymulując w ten sposób uwalnianie insuliny.
Farmakodynamika
U osób zdrowych czas do osiągnięcia maksymalnego efektu (minimalnego stężenia glukozy we krwi) wynosił około 2-3 godziny po podaniu pojedynczej dawki doustnej AMARYL. W badaniach klinicznych oceniano wpływ AMARYL na HbA1c, glikemię na czczo i glikemię poposiłkową [patrz Studia kliniczne ].
Farmakokinetyka
Wchłanianie
Badania z pojedynczymi doustnymi dawkami glimepirydu u zdrowych osób oraz z wielokrotnymi doustnymi dawkami u pacjentów z cukrzycą typu 2 wykazały maksymalne stężenie leku (Cmax) 2 do 3 godzin po podaniu. Gdy glimepiryd podawano z posiłkami, średnie Cmax i AUC (pole pod krzywą) zmniejszyły się odpowiednio o 8% i 9%.
Glimepiryd nie kumuluje się w surowicy po wielokrotnym podaniu. Farmakokinetyka glimepirydu nie różni się między osobami zdrowymi a pacjentami z cukrzycą typu 2. Klirens glimepirydu po podaniu doustnym nie zmienia się w zakresie dawek od 1 mg do 8 mg, co wskazuje na liniową farmakokinetykę.
U zdrowych osób zmienność wewnątrz- i międzyosobnicza parametrów farmakokinetycznych glimepirydu wynosiła odpowiednio 15-23% i 24-29%.
Dystrybucja
Po podaniu dożylnym zdrowym osobom objętość dystrybucji (Vd) wynosiła 8,8 l (113 ml/kg), a całkowity klirens (CL) wynosił 47,8 ml/min. Wiązanie z białkami było większe niż 99,5%.
Metabolizm
Glimepiryd jest całkowicie metabolizowany na drodze biotransformacji oksydacyjnej po podaniu dożylnym lub doustnym. Głównymi metabolitami są pochodna hydroksymetylowa cykloheksylu (M1) i pochodna karboksylowa (M2). Cytochrom P450 2C9 bierze udział w biotransformacji glimepirydu do M1. M1 jest dalej metabolizowany do M2 przez jeden lub kilka enzymów cytozolowych. M2 jest nieaktywny. U zwierząt M1 posiada około jedną trzecią aktywności farmakologicznej glimepirydu, ale nie jest jasne, czy M1 ma klinicznie istotny wpływ na stężenie glukozy we krwi u ludzi.
Wydalanie
Po podaniu doustnym 14C-glimepirydu trzem zdrowym mężczyznom około 60% całkowitej radioaktywności odzyskano w moczu w ciągu 7 dni. M1 i M2 odpowiadały za 80-90% radioaktywności odzyskanej w moczu. Stosunek M1 do M2 w moczu wynosił około 3:2 u dwóch osób i 4:1 u jednego pacjenta. Około 40% całkowitej radioaktywności odzyskano w kale. M1 i M2 stanowiły około 70% (stosunek M1 do M2 wynosił 1:3) radioaktywności odzyskanej z kału. Żaden lek macierzysty nie został odzyskany z moczu lub kału. Po podaniu dożylnym u pacjentów nie zaobserwowano znaczącego wydalania z żółcią glimepirydu ani jego metabolitu M1.
Pacjenci geriatryczni
Porównanie farmakokinetyki glimepirydu u pacjentów z cukrzycą typu 2 w wieku ≤ 65 lat i > 65 lat oceniano w badaniu z zastosowaniem wielokrotnych dawek produktu AMARYL w dawce 6 mg na dobę. Nie było istotnych różnic w farmakokinetyce glimepirydu między dwiema grupami wiekowymi. Średnia wartość AUC w stanie stacjonarnym u starszych pacjentów była o około 13% niższa niż u młodszych pacjentów; średni klirens skorygowany o masę ciała u starszych pacjentów był o około 11% wyższy niż u młodszych pacjentów.
Płeć
Nie było różnic między mężczyznami i kobietami w farmakokinetyce glimepirydu po dostosowaniu ze względu na różnice w masie ciała.
Wyścig
Nie przeprowadzono badań oceniających wpływ rasy na farmakokinetykę glimepirydu, ale w badaniach kontrolowanych placebo, którym podawano AMARYL 2 mg u pacjentów z cukrzycą typu 2, zmniejszenie HbA było porównywalne u osób rasy kaukaskiej (n = 536), rasy czarnej (n = 63). i Latynosi (n = 63).
Zaburzenia czynności nerek
otwartym badaniu z pojedynczą dawką AMARYL 3 mg podawano pacjentom z łagodnymi, umiarkowanymi i ciężkimi zaburzeniami czynności nerek, ocenianymi na podstawie klirensu kreatyniny (CLcr): Grupa I składała się z 5 pacjentów z łagodnymi zaburzeniami czynności nerek (CLcr > 50 ml/min). ), grupa II składała się z 3 pacjentów z umiarkowaną niewydolnością nerek (CLcr = 20-50 ml/min), a grupa III składała się z 7 pacjentów z ciężkimi zaburzeniami czynności nerek (CLcr
Niewydolność wątroby
Nie wiadomo, czy zaburzenia czynności wątroby mają wpływ na farmakokinetykę produktu AMARYL w dawce 1 mg, ponieważ farmakokinetyka produktu AMARYL w dawce 1 mg nie została odpowiednio oceniona u pacjentów z zaburzeniami czynności wątroby.
Pacjenci otyli
Farmakokinetykę glimepirydu i jego metabolitów mierzono w badaniu z pojedynczą dawką z udziałem 28 pacjentów z cukrzycą typu 2, którzy mieli prawidłową masę ciała lub byli chorobliwie otyli. Podczas gdy tmax, klirens i objętość dystrybucji glimepirydu u pacjentów chorobliwie otyłych były podobne do tych w grupie z prawidłową masą ciała, chorobliwie otyli mieli niższe Cmax i AUC niż ci z prawidłową masą ciała. Średnie wartości Cmax, AUC0-24, AUC0-∞ glimepirydu u pacjentów zdrowych i chorobliwie otyłych wynosiły 547 ± 218 ng/ml vs. 410 ± 124 ng/ml, 3210 ± 1030 godzin·ng/ml vs. 2820 ± 1110 godziny·ng/ml i 4000 ± 1320 godzin·ng/ml vs. odpowiednio 3280 ± 1360 godzin·ng/ml.
Interakcje leków
Aspiryna: randomizowanym, podwójnie zaślepionym, dwuokresowym, krzyżowym badaniu zdrowym osobom podawano placebo lub 1 gram aspiryny trzy razy dziennie przez całkowity okres leczenia wynoszący 5 dni. W dniu 4 każdego okresu badania podawano pojedynczą dawkę 1 mg produktu AMARYL 4 mg. Dawki AMARYL 4 mg były oddzielone 14-dniowym okresem wypłukiwania. Jednoczesne podawanie aspiryny i AMARYL 4 mg spowodowało 34% zmniejszenie średniego AUC glimepirydu i 4% zmniejszenie średniego Cmax glimepirydu.
Kolesewelam: Jednoczesne podawanie kolesewelamu i glimepirydu powodowało zmniejszenie AUC0-∞ i Cmax glimepirydu odpowiednio o 18% i 8%. Gdy glimepiryd podawano 4 godziny przed kolesewelamem, nie było istotnej zmiany AUC0-∞ i Cmax glimepirydu, odpowiednio -6% i 3% [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz INTERAKCJE Z LEKAMI ].
Cymetydyna i ranitydyna: randomizowanym, otwartym, 3-kierunkowym badaniu krzyżowym zdrowe osoby otrzymywały pojedynczą dawkę 4 mg samego AMARYL, AMARYL z ranitydyną (150 mg dwa razy na dobę przez 4 dni; AMARYL 2 mg podawano w 3. dniu) lub AMARYL 2 mg z cymetydyną (800 mg dziennie przez 4 dni; AMARYL podawano w 3 dniu). Jednoczesne podawanie cymetydyny lub ranitydyny z pojedynczą dawką doustną 4 mg AMARYL 4 mg nie wpływało znacząco na wchłanianie i rozmieszczenie glimepirydu.
Propranolol: randomizowanym, podwójnie zaślepionym, dwuokresowym, naprzemiennym badaniu zdrowym osobom podawano placebo lub propranolol w dawce 40 mg trzy razy dziennie przez łączny okres leczenia wynoszący 5 dni. W dniu 4 lub w każdym okresie badania podawano pojedynczą dawkę 2 mg produktu AMARYL 4 mg. Dawki AMARYL 4 mg były oddzielone 14-dniowym okresem wypłukiwania. Jednoczesne podawanie propranololu i AMARYL w dawce 1 mg istotnie zwiększało Cmax, AUC i T½ glimepirydu odpowiednio o 23%, 22% i 15% oraz zmniejszało CL/f glimepirydu o 18%. Odzyskiwanie M1 i M2 z moczu nie uległo zmianie.
Warfaryna: otwartym, dwukierunkowym, krzyżowym badaniu zdrowi otrzymywali 4 mg AMARYL 2 mg na dobę przez 10 dni. Pojedyncze dawki 25 mg warfaryny podawano 6 dni przed rozpoczęciem podawania AMARYL iw 4 dniu podawania AMARYL. Jednoczesne podawanie AMARYL nie zmieniało farmakokinetyki enancjomerów R- i S-warfaryny. Nie zaobserwowano zmian w wiązaniu warfaryny z białkami osocza. AMARYL 1 mg powodował statystycznie istotne zmniejszenie odpowiedzi farmakodynamicznej na warfarynę. Zmniejszenie średniego pola powierzchni pod krzywą czasu protrombinowego (PT) i maksymalnych wartości PT podczas leczenia AMARYL wyniosło odpowiednio 3,3% i 9,9% i jest mało prawdopodobne, aby miało znaczenie kliniczne.
Studia kliniczne
Monoterapia
14-tygodniowym, wieloośrodkowym, randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniu oceniającym bezpieczeństwo i skuteczność monoterapii AMARYL w dawce 1 mg wzięło udział łącznie 304 pacjentów z cukrzycą typu 2 leczonych już pochodnymi sulfonylomocznika. Pacjenci przerwali leczenie pochodnymi sulfonylomocznika, a następnie weszli w 3-tygodniowy okres wypłukiwania placebo, po którym nastąpiła randomizacja do 1 z 4 grup leczenia: placebo (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) i AMARYL 8 mg (n=76). Wszyscy pacjenci przydzieleni losowo do grupy AMARYL 4 mg rozpoczęli leczenie od 1 mg na dobę. Pacjenci przydzieleni losowo do grupy AMARYL 4 mg lub 8 mg mieli ślepe, wymuszone zwiększanie dawki AMARYL 2 mg w odstępach tygodniowych, najpierw do 4 mg, a następnie do 8 mg, o ile dawka była tolerowana, aż do osiągnięcia dawki randomizowanej. Pacjenci przydzieleni losowo do dawki 4 mg osiągnęli przypisaną dawkę w 2. tygodniu. Pacjenci przydzieleni losowo do grupy otrzymującej 8 mg osiągnęli przypisaną dawkę w 3. tygodniu. Po osiągnięciu randomizowanego poziomu dawki pacjenci mieli utrzymać tę dawkę do 14. tygodnia. Około 66% pacjentów otrzymujących placebo ukończyło badanie w porównaniu z 81% pacjentów leczonych glimepirydem w dawce 1 mg i 92% pacjentów leczonych glimepirydem w dawce 4 mg lub 8 mg. W porównaniu z placebo, leczenie AMARYL 1 mg, 4 mg i 8 mg na dobę zapewniło statystycznie istotną poprawę HbA1c w porównaniu z placebo (Tabela 3).
wieloośrodkowej, , podwójnie ślepa, kontrolowana placebo próba miareczkowania dawki. Dawka początkowa AMARYL wynosiła 1 mg na dobę i była zwiększana lub zmniejszana w odstępach dwutygodniowych do docelowej wartości FPG 90-150 mg/dl. W laboratorium analizowano poziomy glukozy we krwi zarówno dla FPG, jak i PPG. Po 10 tygodniach dostosowywania dawki pacjenci utrzymywali optymalną dawkę (1, 2, 3, 4, 6 lub 8 mg) przez pozostałe 12 tygodni badania. Leczenie 2 mg AMARYL zapewniło statystycznie istotną poprawę HbA1c i FPG w porównaniu z placebo (Tabela 4).
INFORMACJA O PACJENCIE
Poinformuj pacjentów o tym, jak ważne jest przestrzeganie zaleceń dietetycznych, regularny program ćwiczeń i regularne badanie stężenia glukozy we krwi.
Poinformuj pacjentów o potencjalnych skutkach ubocznych AMARYL 1 mg, w tym hipoglikemii i przybieraniu na wadze.
Wyjaśnij objawy i leczenie hipoglikemii, a także stany predysponujące do hipoglikemii. Należy poinformować pacjentów, że w wyniku hipoglikemii może dojść do upośledzenia zdolności koncentracji i reagowania. Może to stanowić zagrożenie w sytuacjach, w których te umiejętności są szczególnie ważne, takich jak prowadzenie pojazdów lub obsługiwanie innych maszyn.
Pacjentkom z cukrzycą należy doradzić, aby poinformowały swojego lekarza, jeśli są w ciąży, rozważają ciążę, karmią piersią lub rozważają karmienie piersią.
