Micardis 20mg, 40mg, 80mg Telmisartan Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Micardis 40mg i jak się go stosuje?
Micardis to lek na receptę stosowany w leczeniu objawów wysokiego ciśnienia krwi (nadciśnienia) oraz w celu zmniejszenia ryzyka chorób układu krążenia, takich jak udar i zawał serca. Micardis 20mg może być stosowany samodzielnie lub z innymi lekami.
Micardis 80mg należy do klasy leków zwanych ARB.
Nie wiadomo, czy Micardis jest bezpieczny i skuteczny u dzieci w wieku poniżej 18 lat.
Jakie są możliwe skutki uboczne Micardis?
Micardis 80mg może powodować poważne skutki uboczne, w tym:
- zawroty,
- obrzęk,
- szybki przyrost masy ciała,
- mdłości,
- słabość,
- mrowienie uczucie,
- ból w klatce piersiowej,
- nieregularne bicie serca i
- utrata ruchu
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Micardis to:
- zatkany nos,
- ból zatok,
- ból pleców i
- biegunka
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Micardisa. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OSTRZEŻENIE
TOKSYCZNOŚĆ PŁODU
- W przypadku wykrycia ciąży należy jak najszybciej odstawić MICARDIS 40 mg [patrz OSTRZEŻENIA I ŚRODKI oraz Używaj w określonych populacjach ].
- Leki działające bezpośrednio na układ renina-angiotensyna mogą powodować obrażenia i śmierć rozwijającego się płodu [patrz OSTRZEŻENIA I ŚRODKI oraz Używaj w określonych populacjach ].
OPIS
MICARDIS 40mg jest anon-peptydowym antagonistą receptora angiotensyny II (typ AT1).
Telmisartan jest chemicznie opisany jako 4'-[(1,4'-dimetylo-2'-propylo[2,6'-bi-1H-benzimidazol]-1'-ilo)metyl kwas ]-[1,1'-bifenylo]-2-karboksylowy. Jego wzór empiryczny to C33H30N4O2, jego masa cząsteczkowa to 514,63, a wzór strukturalny to:
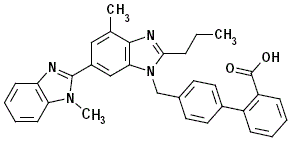
Telmisartan jest ciałem stałym o barwie białej do lekko żółtawej. Jest praktycznie nierozpuszczalny w wodzie iw zakresie pH od 3 do 9, słabo rozpuszczalny w mocnym kwasie (z wyjątkiem nierozpuszczalnego w kwasie solnym) i rozpuszczalny w mocnej zasadzie.
MICARDIS 20mg jest dostępny w postaci tabletek do podawania doustnego, zawierających 20 mg, 40 mg lub 80 mg telmisartanu. Tabletki zawierają następujące nieaktywne składniki: wodorotlenek sodu, megluminę, powidon, sorbitol i stearynian magnezu. Tabletki MICARDIS są higroskopijne i wymagają ochrony przed wilgocią.
WSKAZANIA
MICARDIS HCT (telmisartan i hydrochlorotiazyd) jest wskazany w leczeniu nadciśnienia tętniczego, w celu obniżenia ciśnienia krwi. Obniżenie ciśnienia krwi zmniejsza ryzyko śmiertelnych i niezakończonych zgonem zdarzeń sercowo-naczyniowych, głównie udarów i zawałów mięśnia sercowego. Korzyści te zaobserwowano w kontrolowanych badaniach leków przeciwnadciśnieniowych z wielu różnych klas farmakologicznych, w tym klas, do których ten lek zasadniczo należy. Nie ma kontrolowanych badań wykazujących zmniejszenie ryzyka przy stosowaniu preparatu MICARDIS HCT.
Kontrola wysokiego ciśnienia krwi powinna być częścią kompleksowego zarządzania ryzykiem sercowo-naczyniowym, w tym, w stosownych przypadkach, kontroli lipidów, leczenia cukrzycy, leczenia przeciwzakrzepowego, zaprzestania palenia, ćwiczeń i ograniczonego spożycia sodu. Wielu pacjentów będzie wymagało więcej niż jednego leku, aby osiągnąć cele dotyczące ciśnienia krwi. Aby uzyskać szczegółowe porady dotyczące celów i zarządzania, zobacz opublikowane wytyczne, takie jak wytyczne Wspólnego Narodowego Komitetu ds. Zapobiegania, Wykrywania, Oceny i Leczenia Wysokiego Ciśnienia Krwi (JNC) w ramach National High Blood Pressure Education Program.
randomizowanych kontrolowanych badaniach klinicznych wykazano, że liczne leki przeciwnadciśnieniowe z różnych klas farmakologicznych i o różnych mechanizmach działania zmniejszają chorobowość i śmiertelność sercowo-naczyniową, i można wywnioskować, że jest to obniżenie ciśnienia krwi, a nie jakaś inna właściwość farmakologiczna leki, które są w dużej mierze odpowiedzialne za te korzyści. Największą i najbardziej spójną korzyścią dla sercowo-naczyniowych punktów końcowych było zmniejszenie ryzyka udaru mózgu, ale regularnie obserwowano również zmniejszenie zawału mięśnia sercowego i śmiertelności z przyczyn sercowo-naczyniowych.
Podwyższone ciśnienie skurczowe lub rozkurczowe powoduje zwiększone ryzyko sercowo-naczyniowe, a bezwzględny wzrost ryzyka na mmHg jest większy przy wyższym ciśnieniu krwi, tak że nawet niewielkie zmniejszenie ciężkiego nadciśnienia może przynieść znaczne korzyści. Zmniejszenie względnego ryzyka wynikającego z obniżenia ciśnienia krwi jest podobne w populacjach o różnym ryzyku bezwzględnym, więc bezwzględna korzyść jest większa u pacjentów z wyższym ryzykiem niezależnie od nadciśnienia tętniczego (na przykład pacjenci z cukrzycą lub hiperlipidemią) i takich pacjentów można oczekiwać aby skorzystać z bardziej agresywnego leczenia w celu obniżenia ciśnienia krwi.
Niektóre leki przeciwnadciśnieniowe mają mniejszy wpływ na ciśnienie krwi (jako monoterapia) u pacjentów rasy czarnej, a wiele leków przeciwnadciśnieniowych ma dodatkowe zatwierdzone wskazania i działania (np. na dusznicę bolesną, niewydolność serca lub cukrzycową chorobę nerek). Te rozważania mogą kierować wyborem terapii [patrz Studia kliniczne ].
MICARDIS 40 mg HCT nie jest wskazany do początkowego leczenia nadciśnienia tętniczego [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
MICARDIS HCT może być stosowany samodzielnie lub w połączeniu z innymi lekami przeciwnadciśnieniowymi.
DAWKOWANIE I SPOSÓB PODAWANIA
Informacje o dawkowaniu
Rozpocząć leczenie pacjenta, u którego ciśnienie krwi nie jest odpowiednio kontrolowane za pomocą monoterapii telmisartanem 80 mg na MICARDIS 40 mg HCT, 80 mg/12,5 mg raz na dobę. W razie potrzeby dawkę można zwiększyć do 160 mg/25 mg po 2 do 4 tygodniach.
Rozpocząć leczenie pacjenta, którego ciśnienie krwi nie jest odpowiednio kontrolowane przez podawanie 25 mg hydrochlorotiazydu raz na dobę lub jest kontrolowane, ale u którego występuje hipokaliemia przy takim schemacie leczenia MICARDIS HCT 80 mg/12,5 mg raz na dobę. W razie potrzeby dawkę można zwiększyć do 160 mg/25 mg po 2 do 4 tygodniach.
Pacjenci z miareczkowaniem do poszczególnych składników (telmisartan i hydrochlorotiazyd) mogą zamiast tego otrzymać odpowiednią dawkę preparatu MICARDIS 20 mg HCT.
MICARDIS 20 mg HCT może być podawany z innymi lekami przeciwnadciśnieniowymi.
Dostosowanie dawki w przypadku niewydolności wątroby
Pacjentów z zaburzeniami obturacji dróg żółciowych lub niewydolnością wątroby należy rozpocząć pod ścisłą kontrolą lekarską, stosując połączenie 40 mg/12,5 mg. MICARDIS 40 mg HCT tabletki nie są zalecane u pacjentów z ciężkimi zaburzeniami czynności wątroby [patrz Używaj w określonych populacjach oraz FARMAKOLOGIA KLINICZNA ].
Ważne instrukcje administracyjne
Tabletek MICARDIS HCT należy wyjmować z blistrów dopiero bezpośrednio przed podaniem.
JAK DOSTARCZONE
Formy dawkowania i mocne strony
- 40 mg/12,5 mg, czerwono-białe tabletki oznaczone logo Boehringer Ingelheim i H4
- 80 mg/12,5 mg, czerwono-białe tabletki oznaczone logo Boehringer Ingelheim i H8
- 80 mg/25 mg, żółto-białe tabletki oznaczone logo Boehringer Ingelheim i H9
Składowania i stosowania
MICARDIS 20 mg HCT jest dostępny w trzech mocach w postaci dwuwypukłych, dwuwarstwowych, podłużnych, niepowlekanych tabletek zawierających telmisartan i hydrochlorotiazyd:
- Tabletka 40 mg/12,5 mg: czerwony i biały (może zawierać czerwone plamki) oznaczony symbolem firmy Boehringer Ingelheim i H4; pojedynczo zamknięte blistry w kartonikach po 30 tabletek jako 3 x 10 kart ( NDC 0597-0043-37)
- Tabletka 80 mg/12,5 mg: czerwony i biały (może zawierać czerwone plamki) oznaczony symbolem firmy Boehringer Ingelheim i H8; pojedynczo zamknięte blistry w kartonikach po 30 tabletek jako 3 x 10 kart ( NDC 0597-0044-37)
- Tabletka 80 mg/25 mg: żółte i białe (mogą zawierać żółte plamki) oznaczone symbolem firmy Boehringer Ingelheim i H9; pojedynczo zamknięte blistry w kartonikach po 30 tabletek jako 3 x 10 kart ( NDC 0597-0042-37)
Magazynowanie
Przechowywać w 25°C (77°F); dozwolone wycieczki do 15°C-30°C (59°F-86°F) [patrz Kontrolowana temperatura pomieszczenia USP]. Tabletek należy wyjmować z blistrów dopiero bezpośrednio przed podaniem.
Dystrybutor: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Aktualizacja: październik 2018 r.
SKUTKI UBOCZNE
Następujące działania niepożądane omówiono w innym miejscu na etykiecie:
- Niedociśnienie [patrz OSTRZEŻENIA I ŚRODKI ]
- Upośledzenie nerek [patrz OSTRZEŻENIA I ŚRODKI ]
- Elektrolity i zaburzenia metaboliczne [patrz OSTRZEŻENIA I ŚRODKI ]
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
Bezpieczeństwo MICARDIS HCT oceniono u ponad 1700 pacjentów, w tym 716 leczonych z powodu nadciśnienia tętniczego przez ponad 6 miesięcy i 420 przez ponad 1 rok. Działania niepożądane były ograniczone do tych, które były wcześniej zgłaszane podczas stosowania telmisartanu i (lub) hydrochlorotiazydu.
W Tabeli 1 przedstawiono działania niepożądane występujące z częstością ≥2% u pacjentów leczonych telmisartanem/hydrochlorotiazydem i częściej niż u pacjentów otrzymujących placebo [patrz Studia kliniczne ].
Inne działania niepożądane obserwowane dla telmisartanu/hydrochlorotiazydu to: ból (w tym pleców i brzucha), niestrawność, rumień, wymioty, zapalenie oskrzeli i zapalenie gardła.
Działania niepożądane występowały w przybliżeniu z taką samą częstością u mężczyzn i kobiet, starszych i młodszych pacjentów oraz pacjentów rasy czarnej i innej niż czarna.
Telmisartan
Inne zdarzenia niepożądane, które zostały zgłoszone podczas stosowania telmisartanu, wymieniono poniżej:
Autonomiczny układ nerwowy: impotencja, zwiększone pocenie się, uderzenia gorąca
Ciało jako całość: alergia, gorączka, ból nóg, ból w klatce piersiowej
Układ sercowo-naczyniowy: kołatanie serca, dławica piersiowa, nieprawidłowe zapisy EKG, nadciśnienie, obrzęki obwodowe
Ośrodkowy układ nerwowy: bezsenność, senność, migrena, parestezje, mimowolne skurcze mięśni, niedoczulica
Przewód pokarmowy: wzdęcia, zaparcia, zapalenie żołądka, suchość w ustach, hemoroidy, refluks żołądkowo-przełykowy, ból zęba
wątrobowo-żółciowy: podwyższenie aktywności enzymów wątrobowych lub stężenia bilirubiny w surowicy
Metaboliczny: dna moczanowa, hipercholesterolemia, cukrzyca
Układ mięśniowo-szkieletowy: zapalenie stawów, bóle stawów, skurcze nóg, bóle mięśni
Psychiatryczny: lęk, depresja, nerwowość
Mechanizm oporu: infekcja, ropień, zapalenie ucha środkowego
Oddechowy: astma, nieżyt nosa, duszność, krwawienie z nosa
Skóra: zapalenie skóry, egzema, świąd
Moczowy: częstość oddawania moczu, zapalenie pęcherza moczowego
Naczyniowy: zaburzenia naczyniowo-mózgowe
Zmysły specjalne: zaburzenia widzenia, zapalenie spojówek, szum w uszach, ból ucha
Hydrochlorotiazyd
Inne zdarzenia niepożądane, które zostały zgłoszone podczas stosowania hydrochlorotiazydu, wymieniono poniżej:
Ciało jako całość: słabość
Trawienny: zapalenie trzustki, żółtaczka (wewnątrzwątrobowa żółtaczka cholestatyczna), zapalenie sialadenitis, skurcze, podrażnienie żołądka
Hematologiczny: niedokrwistość aplastyczna, agranulocytoza, leukopenia, niedokrwistość hemolityczna, małopłytkowość
Nadwrażliwość: plamica, nadwrażliwość na światło, pokrzywka, martwicze zapalenie naczyń (zapalenie naczyń i zapalenie naczyń skóry), gorączka, niewydolność oddechowa, w tym zapalenie płuc i obrzęk płuc, reakcje anafilaktyczne
Metaboliczny: hiperglikemia, glikozuria
Układ mięśniowo-szkieletowy: skurcz mięśnia
Układ nerwowy/psychiatryczny: niepokój
Nerkowy: śródmiąższowe zapalenie nerek
Skóra: rumień wielopostaciowy, w tym zespół Stevensa-Johnsona, złuszczające zapalenie skóry, w tym toksyczna nekroliza naskórka
Zmysły specjalne: przejściowe niewyraźne widzenie, ksantopsja
Wyniki laboratorium klinicznego
Kreatynina, Azot Mocznikowy we Krwi (BUN)
kontrolowanych badaniach klinicznych obserwowano zwiększenie stężenia BUN (≥11,2 mg/dl) i kreatyniny w surowicy (≥0,5 mg/dl) odpowiednio u 2,8% i 1,4% pacjentów z pierwotnym nadciśnieniem tętniczym leczonych tabletkami MICARDIS 80 mg HCT. Żaden pacjent nie przerwał leczenia MICARDIS 80 mg HCT tabletki z powodu wzrostu stężenia BUN lub kreatyniny [patrz OSTRZEŻENIA I ŚRODKI ].
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane podczas stosowania produktu MICARDIS HCT po dopuszczeniu do obrotu. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek.
Zaburzenia krwi i układu chłonnego: eozynofilia
Zaburzenia serca: migotanie przedsionków, zastoinowa niewydolność serca, zawał mięśnia sercowego, tachykardia, bradykardia
Zaburzenia ucha i labiryntu: zawrót głowy
Ogólne Zaburzenia i Warunki Miejsca Administracji: astenia, obrzęki
wątrobowo-żółciowy: Nieprawidłowa czynność wątroby/zaburzenia wątroby
Zaburzenia układu immunologicznego: reakcja anafilaktyczna
Infekcje i infestacje: zakażenie dróg moczowych
Dochodzenia: zwiększony CPK
Zaburzenia metabolizmu i odżywiania: hipoglikemia (u pacjentów z cukrzycą)
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: ból ścięgna (w tym zapalenie ścięgna, zapalenie pochewki ścięgna), rabdomioliza
Zaburzenia układu nerwowego: omdlenie, ból głowy
Zaburzenia nerek i dróg moczowych: niewydolność nerek, zaburzenia czynności nerek, w tym ostra niewydolność nerek
Zaburzenia układu rozrodczego i piersi: zaburzenie erekcji
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: kaszel
Zaburzenia skóry i tkanki podskórnej: wysypka polekowa (toksyczne wykwity skórne najczęściej zgłaszane jako toksykoderma, wysypka i pokrzywka), obrzęk naczynioruchowy (ze zgonem)
Zaburzenia naczyniowe: niedociśnienie ortostatyczne
INTERAKCJE Z LEKAMI
Środki zwiększające poziom potasu w surowicy
Jednoczesne podawanie telmisartanu z innymi lekami zwiększającymi stężenie potasu w surowicy może powodować hiperkaliemię. U takich pacjentów należy monitorować stężenie potasu w surowicy.
Lit
Podczas jednoczesnego stosowania tiazydowych leków moczopędnych lub antagonistów receptora angiotensyny II, w tym telmisartanu, zgłaszano zwiększenie stężenia litu w surowicy i toksyczność litu. Monitoruj poziom litu u pacjentów otrzymujących MICARDIS 80 mg HCT i lit.
Niesteroidowe środki przeciwzapalne, w tym selektywne inhibitory cyklooksygenów E-2
Telmisartan
Niesteroidowe leki przeciwzapalne, w tym selektywne inhibitory cyklooksygenazy-2 (inhibitory COX-2): u pacjentów w podeszłym wieku, odwodnionych (w tym leczonych diuretykami) lub z zaburzeniami czynności nerek, jednoczesne podawanie NLPZ, w tym selektywne inhibitory COX-2 z ARB, w tym telmisartan, mogą powodować pogorszenie czynności nerek, w tym możliwą ostrą niewydolność nerek. Efekty te są zwykle odwracalne. Działanie przeciwnadciśnieniowe ARB może być osłabione przez NLPZ. Dlatego należy okresowo monitorować czynność nerek i ciśnienie tętnicze u pacjentów otrzymujących MICARDIS 40 mg HCT i NLPZ.
Hydrochlorotiazyd
Podawanie niesteroidowego środka przeciwzapalnego, w tym selektywnego inhibitora COX2, może zmniejszyć działanie moczopędne, natriuretyczne i przeciwnadciśnieniowe leków moczopędnych. Dlatego w przypadku jednoczesnego stosowania preparatu MICARDIS HCT i niesteroidowych leków przeciwzapalnych, w tym selektywnych inhibitorów COX2, należy uważnie obserwować, czy uzyskuje się pożądane działanie leku moczopędnego.
Podwójna blokada układu renina-angiotensy w aldosteronie i zmiany funkcji nerek
Podwójna blokada układu renina-angiotensyna-aldosteron (RAS) za pomocą antagonistów angiotensyny, inhibitorów ACE lub aliskirenu wiąże się ze zwiększonym ryzykiem niedociśnienia, hiperkaliemii i niewydolności nerek. Do badania ONTARGET włączono 25 620 pacjentów w wieku ≥ 55 lat z miażdżycą lub cukrzycą z uszkodzeniem końcowych narządów, przydzielono ich losowo do grupy obejmującej wyłącznie telmisartan (ARB), ramipryl (inhibitor ACE) lub ich skojarzenie, a mediana ich obserwacji wynosiła 56 miesięcy. . Pacjenci, którzy otrzymywali kombinację ARB i inhibitora ACE nie odnieśli żadnych dodatkowych korzyści (brak dodatkowego zmniejszenia ryzyka zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego, udaru mózgu lub hospitalizacji z powodu niewydolności serca) w porównaniu z monoterapią ARB lub monoterapią inhibitorem ACE, ale doświadczyli zwiększonego częstość występowania dysfunkcji nerek (np. ostra niewydolność nerek) w porównaniu z grupami monoterapii.
Ogólnie należy unikać łącznego stosowania inhibitorów RAS. Ściśle monitoruj ciśnienie krwi, czynność nerek i elektrolity u pacjentów stosujących MICARDIS 40 mg HCT i inne leki wpływające na układ RAS.
Nie należy podawać aliskirenu jednocześnie z produktem MICARDIS HCT u pacjentów z cukrzycą. Należy unikać jednoczesnego stosowania aliskirenu z MICARDIS HCT u pacjentów z zaburzeniami czynności nerek (GFR
Digoksyna
Podczas jednoczesnego podawania telmisartanu z digoksyną zaobserwowano wzrost mediany maksymalnego stężenia digoksyny w osoczu (49%) i stężenia minimalnego (20%). Monitorować poziom digoksyny u pacjentów przyjmujących jednocześnie MICARDIS 40 mg HCT i digoksynę.
Leki przeciwcukrzycowe (środki doustne i insulina)
Może być konieczne dostosowanie dawki leków przeciwcukrzycowych, gdy są one podawane jednocześnie z hydrochlorotiazydem.
Żywice z kolestyraminy i kolestypolu
Wchłanianie hydrochlorotiazydu jest osłabione w obecności żywic anionowymiennych. Rozłożyć dawkowanie hydrochlorotiazydu i żywicy tak, aby hydrochlorotiazyd był podawany co najmniej 4 godziny przed lub 4 do 6 godzin po podaniu żywicy.
OSTRZEŻENIA
Zawarte jako część "ŚRODKI OSTROŻNOŚCI" Sekcja
ŚRODKI OSTROŻNOŚCI
Toksyczność płodu
Telmisartan
Stosowanie leków działających na układ renina-angiotensyna w drugim i trzecim trymestrze ciąży zmniejsza czynność nerek płodu oraz zwiększa śmiertelność i śmiertelność płodu i noworodka. Powstałe małowodzie może być związane z hipoplazją płuc płodu i deformacjami szkieletu. Potencjalne działania niepożądane u noworodków obejmują hipoplazję czaszki, bezmocz, niedociśnienie, niewydolność nerek i zgon. W przypadku wykrycia ciąży należy jak najszybciej odstawić lek MICARDIS HCT.
Hydrochlorotiazyd
Tiazydy przenikają przez barierę łożyskową i pojawiają się we krwi pępowinowej. Działania niepożądane obejmują żółtaczkę płodu lub noworodka i małopłytkowość [patrz Używaj w określonych populacjach ].
Niedociśnienie u pacjentów z niedoborem objętości lub soli
pacjentów z aktywowanym układem renina-angiotensyna, takich jak pacjenci odwodnieni lub z niedoborem soli (np. leczeni dużymi dawkami leków moczopędnych), po rozpoczęciu leczenia produktem MICARDIS HCT może wystąpić objawowe niedociśnienie. Prawidłowa objętość lub niedobór soli przed podaniem MICARDIS 80 mg HCT.
Upośledzona funkcja nerek
Zmiany w czynności nerek, w tym ostra niewydolność nerek, mogą być spowodowane lekami hamującymi układ reninangiotensyny i lekami moczopędnymi. Pacjenci, których czynność nerek może częściowo zależeć od aktywności układu renina-angiotensyna (np. pacjenci ze zwężeniem tętnicy nerkowej, przewlekłą chorobą nerek, ciężką zastoinową niewydolnością serca lub niedoborem objętości) mogą być szczególnie narażeni na rozwój skąpomoczu, postępującej azotemii , lub ostra niewydolność nerek po podaniu preparatu MICARDIS HCT. U tych pacjentów należy okresowo monitorować czynność nerek. Należy rozważyć wstrzymanie lub przerwanie leczenia u pacjentów, u których wystąpiło klinicznie istotne pogorszenie czynności nerek po podaniu produktu MICARDIS HCT.
Elektrolity i zaburzenia metaboliczne
Leki, w tym telmisartan, które hamują układ renina-angiotensyna, mogą powodować hiperkaliemię, szczególnie u pacjentów z niewydolnością nerek, cukrzycą lub w skojarzeniu z innymi antagonistami receptora angiotensyny lub inhibitorami ACE oraz jednoczesne stosowanie innych leków zwiększających stężenie potasu w surowicy [patrz INTERAKCJE Z LEKAMI ].
Hydrochlorotiazyd może powodować hipokaliemię i hiponatremię. Wykazano, że tiazydy zwiększają wydalanie magnezu z moczem; może to spowodować hipomagnezemię. Hipomagnezemia może prowadzić do hipokaliemii, która może być trudna do leczenia pomimo niedoboru potasu. Okresowo monitoruj elektrolity w surowicy.
W kontrolowanych badaniach z zastosowaniem leczenia skojarzonego telmisartan/hydrochlorotiazyd u żadnego pacjenta, któremu podawano 40 mg/12,5 mg, 80 mg/12,5 mg lub 80 mg/25 mg, nie wystąpił spadek stężenia potasu ≥1,4 mEq/l i u żadnego pacjenta nie wystąpiła hiperkaliemia.
Hydrochlorotiazyd zmniejsza wydalanie wapnia z moczem i może powodować zwiększenie stężenia wapnia w surowicy.
Hydrochlorotiazyd może zmieniać tolerancję glukozy i podwyższać poziom cholesterolu i trójglicerydów w surowicy.
U niektórych pacjentów leczonych tiazydami może wystąpić hiperurykemia lub dna moczanowa. Ponieważ telmisartan zmniejsza stężenie kwasu moczowego, telmisartan w połączeniu z hydrochlorotiazydem łagodzi hiperurykemię wywołaną przez leki moczopędne.
Reakcja nadwrażliwości
Hydrochlorotiazyd
Reakcje nadwrażliwości na hydrochlorotiazyd mogą wystąpić u pacjentów z alergią lub astmą oskrzelową w wywiadzie lub bez, ale są bardziej prawdopodobne u pacjentów z takim wywiadem [patrz PRZECIWWSKAZANIA ].
Ostra krótkowzroczność i wtórna jaskra zamykającego się kąta
Hydrochlorotiazyd, sulfonamid, może wywołać reakcję idiosynkratyczną, prowadzącą do ostrej przemijającej krótkowzroczności i ostrej jaskry zamykającego się kąta. Objawy obejmują ostry początek zmniejszonej ostrości wzroku lub ból oczu i zwykle pojawiają się w ciągu kilku godzin lub tygodni od rozpoczęcia leczenia. Nieleczona jaskra ostra zamykającego się kąta może prowadzić do trwałej utraty wzroku. Podstawowym leczeniem jest jak najszybsze odstawienie hydrochlorotiazydu. Konieczne może być rozważenie natychmiastowego leczenia medycznego lub chirurgicznego, jeśli ciśnienie wewnątrzgałkowe pozostaje niekontrolowane. Czynniki ryzyka rozwoju ostrej jaskry zamykającego się kąta mogą obejmować alergię na sulfonamidy lub penicylinę w wywiadzie.
Toczeń rumieniowaty układowy
Istnieją doniesienia, że diuretyki tiazydowe powodują zaostrzenie lub aktywację tocznia rumieniowatego układowego.
Pacjenci po sympatektomii
Działanie przeciwnadciśnieniowe hydrochlorotiazydu może być nasilone u pacjentów po sympatektomii.
Informacje dotyczące poradnictwa dla pacjentów
Poinformuj pacjenta, aby przeczytał zatwierdzone przez FDA oznakowanie pacjenta ( INFORMACJA O PACJENCIE ).
Ciąża
Poinformuj pacjentki w wieku rozrodczym o konsekwencjach narażenia na MICARDIS 40 mg HCT podczas ciąży. Omów możliwości leczenia z kobietami planującymi ciążę. Powiedz pacjentkom, aby jak najszybciej zgłaszali ciążę swoim lekarzom [patrz OSTRZEŻENIA I ŚRODKI oraz Używaj w określonych populacjach ].
Laktacja
Doradzić kobietom karmiącym piersią, aby nie karmiły piersią podczas leczenia lekiem MICARDIS HCT [patrz Używaj w określonych populacjach ].
Objawowe niedociśnienie i omdlenia
Poinformuj pacjentów, że mogą wystąpić zawroty głowy, zwłaszcza w pierwszych dniach terapii, i zgłoś to swojemu lekarzowi. Poinformuj pacjentów, że niewystarczające spożycie płynów, nadmierne pocenie się, biegunka lub wymioty mogą prowadzić do nadmiernego spadku ciśnienia krwi, z takimi samymi konsekwencjami, jak zawroty głowy i możliwe omdlenia. Poradź pacjentom, aby skontaktowali się z lekarzem w przypadku wystąpienia omdlenia [patrz OSTRZEŻENIA I ŚRODKI ].
Suplementy potasu
Poradź pacjentom, aby nie stosowali suplementów potasu lub substytutów soli zawierających potas bez konsultacji z lekarzem przepisującym lek [patrz OSTRZEŻENIA I ŚRODKI oraz INTERAKCJE Z LEKAMI ].
Ostra krótkowzroczność i wtórna jaskra zamykającego się kąta
Należy doradzić pacjentom, aby zaprzestali leczenia MICARDIS 80 mg HCT i natychmiast zgłosili się do lekarza, jeśli wystąpią objawy ostrej krótkowzroczności lub wtórnej jaskry zamykającego się kąta [patrz OSTRZEŻENIA I ŚRODKI ].
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Telmisartan i hydrochlorotiazyd
Nie przeprowadzono badań rakotwórczości, mutagenności ani płodności w przypadku połączenia telmisartanu i hydrochlorotiazydu.
Telmisartan
Nie było dowodów na działanie rakotwórcze po podaniu telmisartanu w diecie myszom i szczurom przez okres do 2 lat. Najwyższe dawki podawane myszom (1000 mg/kg/dzień) i szczurom (100 mg/kg/dzień) w przeliczeniu na mg/m2 wynoszą odpowiednio około 59 i 13-krotność maksymalnej zalecanej dawki dla ludzi (MRHD) telmisartan. Wykazano, że te same dawki zapewniają średnią ogólnoustrojową ekspozycję na telmisartan odpowiednio >100 razy i >25 razy niż ogólnoustrojowa ekspozycja u ludzi otrzymujących MRHD telmisartanu (80 mg/dobę).
Testy genotoksyczności nie wykazały żadnych skutków związanych z telmisartanem ani na poziomie genu, ani chromosomu. Testy te obejmowały testy mutagenności bakteryjnej na Salmonelli i E. coli (Ames), test mutacji genowych na komórkach V79 chomika chińskiego, test cytogenetyczny na ludzkich limfocytach oraz test mikrojądrowy u myszy.
Nie stwierdzono żadnego wpływu leku na reprodukcję samców i samic szczurów przy dawce 100 mg/kg/dobę (najwyższa podana dawka), około 13-krotności, w przeliczeniu na mg/m2, MRHD telmisartanu. Ta dawka u szczurów powodowała, że średnia ekspozycja ogólnoustrojowa (AUC telmisartanu określona w 6. dniu ciąży) była co najmniej 50-krotnie większa od średniej ekspozycji ogólnoustrojowej u ludzi przy MRHD (80 mg/dobę).
Hydrochlorotiazyd
Dwuletnie badania żywieniowe na myszach i szczurach przeprowadzone pod auspicjami Narodowego Programu Toksykologicznego (NTP) nie ujawniły dowodów na rakotwórczy potencjał hydrochlorotiazydu u samic myszy (w dawkach do około 600 mg/kg/dobę) lub u samców oraz samice szczurów (w dawkach do około 100 mg/kg/dobę). Jednak NTP znalazł niejednoznaczne dowody na hepatokarcynogenność u samców myszy.
Hydrochlorotiazyd nie wykazywał działania genotoksycznego in vitro w teście mutagenności Amesa szczepów Salmonella typhimurium TA 98, TA 100, TA 1535, TA 1537 i TA 1538 oraz w teście aberracji chromosomowych na jajniku chomika chińskiego (CHO) ani w testach in vivo z zastosowaniem chromosomy komórek zarodkowych myszy, chromosomy szpiku kostnego chomika chińskiego i sprzężony z płcią gen recesywnej cechy letalnej Drosophila. Pozytywne wyniki testu uzyskano w teście in vitro CHO Sister Chromatid Exchange (klastogenność), w teście z komórkami chłoniaka myszy (mutagenność) oraz w teście bez dysjunkcji Aspergillus nidulans.
Hydrochlorotiazyd nie miał niekorzystnego wpływu na płodność myszy i szczurów obu płci w badaniach, w których gatunki te były narażone poprzez dietę na dawki odpowiednio do 100 i 4 mg/kg przed kryciem i przez cały okres ciąży.
Używaj w określonych populacjach
Ciąża
Podsumowanie ryzyka
MICARDIS HCT podawany kobietom w ciąży może powodować uszkodzenie płodu. Stosowanie leków działających na układ renina-angiotensyna w drugim i trzecim trymestrze ciąży zmniejsza czynność nerek płodu oraz zwiększa śmiertelność i śmiertelność płodu i noworodka (patrz Rozważania kliniczne ). W większości badań epidemiologicznych oceniających nieprawidłowości płodu po ekspozycji na leki hipotensyjne w pierwszym trymestrze nie odróżniano leków wpływających na układ renina-angiotensyna od innych leków hipotensyjnych. Badania na szczurach i królikach z telmisartanem wykazały działanie toksyczne na płód tylko w dawkach toksycznych dla matki (patrz Dane ). W przypadku wykrycia ciąży należy jak najszybciej odstawić lek MICARDIS HCT.
Szacowane ryzyko tła poważnych wad wrodzonych i poronienia dla wskazanej populacji jest nieznane. Wszystkie ciąże wiążą się z ryzykiem wady wrodzonej, utraty lub innych niekorzystnych skutków. W ogólnej populacji Stanów Zjednoczonych szacowane podstawowe ryzyko poważnych wad wrodzonych i poronienia w klinicznie rozpoznanych ciążach wynosi odpowiednio 2% do 4% i 15% do 20%.
Rozważania kliniczne
Związane z chorobą ryzyko dla matki i/lub zarodka/płodu
Nadciśnienie w ciąży zwiększa ryzyko wystąpienia u matki stanu przedrzucawkowego, cukrzycy ciążowej, przedwczesnego porodu i powikłań porodowych (np. konieczności cięcia cesarskiego i krwotoku poporodowego). Nadciśnienie zwiększa ryzyko zahamowania wzrostu płodu i zgonu wewnątrzmacicznego u płodu. Kobiety w ciąży z nadciśnieniem powinny być dokładnie monitorowane i odpowiednio leczone.
Działania niepożądane dotyczące płodu/noworodka
Telmisartan
Stosowanie leków działających na RAS w drugim i trzecim trymestrze ciąży może powodować: małowodzie, zaburzenia czynności nerek płodu prowadzące do bezmoczu i niewydolności nerek, hipoplazję płuc płodu, deformacje szkieletu, w tym hipoplazję czaszki, niedociśnienie i śmierć . W nietypowym przypadku, gdy nie ma odpowiedniej alternatywy dla terapii lekami wpływającymi na układ renina-angiotensyna dla konkretnego pacjenta, należy uprzedzić matkę o potencjalnym ryzyku dla płodu.
U pacjentek przyjmujących MICARDIS HCT w ciąży należy wykonywać seryjne badania ultrasonograficzne w celu oceny środowiska wewnątrzowodniowego. Testy płodu mogą być odpowiednie w zależności od tygodnia ciąży. W przypadku zaobserwowania małowodzia należy odstawić MICARDIS HCT, chyba że uzna się to za ratujące życie dla matki. Pacjenci i lekarze powinni być jednak świadomi, że małowodzie może pojawić się dopiero po nieodwracalnym uszkodzeniu płodu.
Uważnie obserwuj niemowlęta z historią ekspozycji in utero na MICARDIS 20 mg HCT pod kątem niedociśnienia, skąpomoczu i hiperkaliemii. W przypadku wystąpienia skąpomoczu lub niedociśnienia należy wspomóc ciśnienie krwi i perfuzję nerek. Transfuzje wymienne lub dializy mogą być konieczne jako środek odwrócenia niedociśnienia i zastąpienia czynności nerek [patrz Używaj w określonych populacjach ].
Hydrochlorotiazyd
Tiazydy przenikają przez łożysko, a stosowanie tiazydów w czasie ciąży wiąże się z ryzykiem żółtaczki płodowej lub noworodkowej, trombocytopenii i możliwych innych działań niepożądanych, które wystąpiły u dorosłych.
Dane
Dane zwierząt
MICARDIS 40mg HCT
Badanie toksyczności rozwojowej przeprowadzono na szczurach, którym podawano dawki telmisartanu/hydrochlorotiazydu 3,2/1,0, 15/4,7, 50/15,6 i 0/15,6 mg/kg/dobę. Chociaż dwie kombinacje wyższych dawek wydawały się być bardziej toksyczne (znaczny spadek przyrostu masy ciała) dla matek niż każdy z leków osobno, nie stwierdzono wzrostu toksyczności dla rozwijających się zarodków.
Telmisartan
Nie zaobserwowano działania teratogennego, gdy telmisartan podawano ciężarnym szczurom w dawkach doustnych do 50 mg/kg/dobę oraz ciężarnym królikom w dawkach doustnych do 45 mg/kg/dobę. U królików śmiertelność zarodków związana z toksycznością matczyną (zmniejszony przyrost masy ciała i spożycie pokarmu) obserwowano po podaniu 45 mg/kg/dobę (około 12-krotność maksymalnej zalecanej dawki u ludzi [MRHD] wynoszącej 80 mg w przeliczeniu na mg/m2). U szczurów zaobserwowano, że toksyczne dla matki (zmniejszony przyrost masy ciała i spożycie pokarmu) dawki telmisartanu 15 mg/kg/dobę (około 1,9-krotność MRHD w przeliczeniu na mg/m2), podawane w późnym okresie ciąży i laktacji, powodowały działania niepożądane u noworodków, w tym zmniejszona żywotność, niska masa urodzeniowa, opóźnione dojrzewanie i zmniejszony przyrost masy ciała. Dawki, przy których nie obserwuje się szkodliwego działania na rozwój szczurów i królików, odpowiednio 5 i 15 mg/kg/dobę, wynoszą odpowiednio około 0,64 i 3,7 razy w przeliczeniu na mg/m2 MRHD telmisartanu (80 mg/dobę). ).
Hydrochlorotiazyd
Badania, w których hydrochlorotiazyd podawano ciężarnym myszom i szczurom w odpowiednich okresach głównej organogenezy w dawkach odpowiednio do 3000 i 1000 mg/kg/dobę (około 600 i 400 razy większych od MRHD), nie dostarczyły dowodów na szkodliwość dla płodu .
Tiazydy mogą przenikać przez łożysko, a stężenia osiągane w żyle pępowinowej zbliżają się do stężeń w osoczu matki. Hydrochlorotiazyd, podobnie jak inne leki moczopędne, może powodować hipoperfuzję łożyska. Gromadzi się w płynie owodniowym, osiągając stężenia do 19 razy większe niż w osoczu żyły pępowinowej. Stosowanie tiazydów w czasie ciąży wiąże się z ryzykiem wystąpienia żółtaczki lub małopłytkowości płodu lub noworodka. Ponieważ nie zapobiegają ani nie zmieniają przebiegu gestozy EPH (obrzęk, białkomocz, nadciśnienie) (stan przedrzucawkowy), leki te nie powinny być stosowane w leczeniu nadciśnienia tętniczego u kobiet w ciąży. Należy unikać stosowania hydrochlorotiazydu w innych wskazaniach (np. chorobach serca) w ciąży.
Laktacja
Podsumowanie ryzyka
Brak informacji dotyczących obecności preparatu MICARDIS 20 mg HCT lub telmisartanu w mleku ludzkim, wpływu na niemowlę karmione piersią lub wpływu na produkcję mleka. Ograniczone opublikowane badania donoszą, że hydrochlorotiazyd jest obecny w mleku ludzkim. Jednak nie ma wystarczających informacji, aby określić wpływ hydrochlorotiazydu na niemowlę karmione piersią lub wpływ hydrochlorotiazydu na produkcję mleka. Telmisartan jest obecny w mleku karmiących szczurów. (Widzieć Dane ). Ze względu na możliwość wystąpienia ciężkich działań niepożądanych u karmionego piersią niemowlęcia, w tym niedociśnienia, hiperkaliemii i zaburzenia czynności nerek, kobietom karmiącym zaleca się, aby nie karmiła piersią podczas leczenia produktem MICARDIS HCT.
Dane
Telmisartan był obecny w mleku karmiących samic szczurów w stężeniu 1,5 do 2 razy większym niż w osoczu od 4 do 8 godzin po podaniu.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność MICARDIS HCT u dzieci nie zostały ustalone.
Noworodki z historią ekspozycji w macicy na MICARDIS HCT
W przypadku wystąpienia skąpomoczu lub niedociśnienia należy wspomóc ciśnienie krwi i perfuzję nerek. Transfuzje wymienne lub dializy mogą być wymagane jako sposób odwrócenia niedociśnienia i/lub zastąpienia zaburzeń czynności nerek.
Zastosowanie geriatryczne
kontrolowanych badaniach klinicznych (n=1017) około 20% pacjentów leczonych telmisartanem/hydrochlorotiazydem było w wieku 65 lat lub starszych, a 5% było w wieku 75 lat lub starszych. Nie zaobserwowano ogólnych różnic w skuteczności i bezpieczeństwie stosowania telmisartanu/hydrochlorotiazydu u tych pacjentów w porównaniu z młodszymi pacjentami. Inne odnotowane doświadczenia kliniczne nie wykazały różnic w odpowiedziach między pacjentami w podeszłym wieku i młodszymi, ale nie można wykluczyć większej wrażliwości niektórych osób starszych. Ogólnie rzecz biorąc, dobór dawki u pacjentów w podeszłym wieku powinien być ostrożny, zwykle zaczynając od dolnej granicy zakresu dawkowania, co odzwierciedla większą częstość pogorszenia czynności wątroby, nerek lub serca oraz współistniejących chorób lub innych leków.
Stosowanie u pacjentów z niewydolnością wątroby
Pacjenci z zaburzeniami obturacji dróg żółciowych lub niewydolnością wątroby powinni rozpocząć leczenie pod ścisłą kontrolą lekarską, stosując połączenie 40 mg/12,5 mg.
Telmisartan
Ponieważ większość telmisartanu jest wydalana z żółcią, można oczekiwać, że pacjenci z zaburzeniami obturacji dróg żółciowych lub niewydolnością wątroby będą mieli zmniejszony klirens i wyższe stężenie we krwi.
Hydrochlorotiazyd
Niewielkie zmiany równowagi wodno-elektrolitowej mogą spowodować śpiączkę wątrobową u pacjentów z zaburzeniami czynności wątroby lub postępującą chorobą wątroby.
Stosowanie u pacjentów z zaburzeniami czynności nerek
Nie ustalono bezpieczeństwa i skuteczności produktu MICARDIS 40 mg HCT u pacjentów z ciężkimi zaburzeniami czynności nerek (CrCl ≤30 ml/min). U pacjentów z ciężkimi zaburzeniami czynności nerek nie zaleca się stosowania tabletek MICARDIS 80 mg HCT. Nie ma konieczności dostosowania dawki u pacjentów z łagodnymi (CrCl od 60 do 90 ml/min) lub umiarkowanymi (CrCl od 30 do 60 ml/min) zaburzeniami czynności nerek.
PRZEDAWKOWAĆ
Telmisartan
Dostępne są ograniczone dane dotyczące przedawkowania telmisartanu u ludzi. Najbardziej prawdopodobnymi objawami przedawkowania telmisartanu są niedociśnienie, zawroty głowy i tachykardia; bradykardia może wystąpić w wyniku stymulacji układu przywspółczulnego (błędu błędnego). W przypadku wystąpienia objawowego niedociśnienia należy wdrożyć leczenie wspomagające. Telmisartan nie jest usuwany przez hemodializę.
Hydrochlorotiazyd
Najczęstsze objawy przedmiotowe i podmiotowe obserwowane u pacjentów po przedawkowaniu hydrochlorotiazydu są spowodowane niedoborem elektrolitów (hipokaliemia, hipochloremia, hiponatremia) oraz odwodnieniem wynikającym z nadmiernej diurezy. Jeśli podano również naparstnicę, hipokaliemia może nasilać zaburzenia rytmu serca. Nie ustalono stopnia, w jakim hydrochlorotiazyd jest usuwany przez hemodializę. Doustna LD hydrochlorotiazydu jest większa niż 10 g/kg zarówno u myszy, jak i szczurów.
PRZECIWWSKAZANIA
MICARDIS HCT jest przeciwwskazany:
- U pacjentów z nadwrażliwością na którykolwiek składnik tego produktu [patrz OSTRZEŻENIA I ŚRODKI ].
- pacjentów z bezmoczem.
- Do równoczesnego podawania z aliskirenem u pacjentów z cukrzycą [patrz INTERAKCJE Z LEKAMI ].
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
MICARDIS 40mg HCT
MICARDIS 20mg HCT to połączenie dwóch leków o właściwościach przeciwnadciśnieniowych: diuretyku tiazydowego, hydrochlorotiazydu oraz blokera receptora angiotensyny II (ARB), telmisartanu.
Telmisartan
Angiotensyna II powstaje z angiotensyny I w reakcji katalizowanej przez enzym konwertujący angiotensynę (ACE, kininaza II). Angiotensyna II jest głównym czynnikiem presyjnym układu renina-angiotensyna, którego efekty obejmują zwężenie naczyń krwionośnych, stymulację syntezy i uwalniania aldosteronu, stymulację serca i zwrotne wchłanianie sodu w nerkach. Telmisartan blokuje działanie angiotensyny II na zwężenie naczyń i wydzielanie aldosteronu poprzez selektywne blokowanie wiązania angiotensyny II z receptorem AT1 w wielu tkankach, takich jak mięśnie gładkie naczyń i nadnercza. Jego działanie jest zatem niezależne od szlaków syntezy angiotensyny II.
W wielu tkankach znajduje się również receptor AT2, ale nie wiadomo, aby AT2 był związany z homeostazą sercowo-naczyniową. Telmisartan ma znacznie większe powinowactwo (>3000 razy) do receptora AT1 niż do receptora AT2.
Telmisartan nie hamuje ACE (kininazy II) ani nie wiąże się ani nie blokuje innych receptorów hormonalnych lub kanałów jonowych, o których wiadomo, że są ważne w regulacji układu krążenia.
Blokada receptora angiotensyny II hamuje negatywne sprzężenie zwrotne angiotensyny II na wydzielanie reniny, ale wynikająca z tego zwiększona aktywność reninowa osocza i stężenie angiotensyny II w krążeniu nie przezwyciężają wpływu telmisartanu na ciśnienie krwi.
Hydrochlorotiazyd
Hydrochlorotiazyd jest diuretykiem tiazydowym. Tiazydy wpływają na mechanizmy reabsorpcji elektrolitów w kanalikach nerkowych, bezpośrednio zwiększając wydalanie soli sodowej i chlorku w przybliżeniu w równoważnych ilościach. Pośrednio działanie moczopędne hydrochlorotiazydu zmniejsza objętość osocza, co w konsekwencji prowadzi do wzrostu aktywności reninowej osocza, zwiększenia wydzielania aldosteronu, zwiększenia utraty potasu z moczem i zmniejszenia stężenia potasu w surowicy. W połączeniu renina-aldosteron pośredniczy angiotensyna II, więc jednoczesne podawanie ARB ma tendencję do odwracania utraty potasu związanej z tymi lekami moczopędnymi. Mechanizm hipotensyjnego działania tiazydów nie jest w pełni poznany.
Farmakodynamika
Telmisartan
U zdrowych ochotników dawka 80 mg telmisartanu hamowała odpowiedź presyjną na dożylny wlew angiotensyny II o około 90% przy maksymalnym stężeniu w osoczu, przy czym około 40% hamowanie trwało przez 24 godziny.
Stężenie angiotensyny II i aktywność reninowa w osoczu wzrastały w sposób zależny od dawki po jednorazowym podaniu telmisartanu osobom zdrowym i wielokrotnym podaniu pacjentom z nadciśnieniem. Podawanie raz na dobę do 80 mg telmisartanu zdrowym osobom nie miało wpływu na stężenie aldosteronu w osoczu. W badaniach po podaniu wielokrotnym u pacjentów z nadciśnieniem tętniczym nie stwierdzono klinicznie istotnych zmian w elektrolitach (potasu lub sodu w surowicy) ani w funkcji metabolicznej (w tym stężenia cholesterolu, triglicerydów, HDL, LDL, glukozy lub kwasu moczowego w surowicy).
Działanie przeciwnadciśnieniowe telmisartanu badano w sześciu kontrolowanych placebo badaniach klinicznych obejmujących łącznie 1773 pacjentów z łagodnym do umiarkowanego nadciśnieniem tętniczym (rozkurczowe ciśnienie krwi od 95 do 114 mmHg), z których 1031 było leczonych telmisartanem. Po podawaniu telmisartanu raz na dobę, wielkość obniżenia ciśnienia krwi w stosunku do wartości wyjściowej po odjęciu placebo wynosiła około (SBP/DBP) 6-8/6 mmHg dla 20 mg, 9-13/6-8 mmHg dla 40 mg i 12 -13/7-8 mmHg dla 80 mg. Większe dawki (do 160 mg) nie wydawały się powodować dalszego spadku ciśnienia krwi.
Początek działania przeciwnadciśnieniowego następuje w ciągu 3 godzin, z maksymalnym zmniejszeniem o około 4 tygodnie. W dawkach 20, 40 i 80 mg działanie przeciwnadciśnieniowe telmisartanu podawanego raz na dobę utrzymywało się przez pełne 24-godzinne odstępy między dawkami.
30 pacjentów z nadciśnieniem i prawidłową czynnością nerek leczonych przez 8 tygodni telmisartanem 80 mg lub telmisartanem 80 mg w skojarzeniu z hydrochlorotiazydem 12,5 mg nie wystąpiły klinicznie istotne zmiany w stosunku do wartości wyjściowych w nerkowym przepływie krwi, szybkości przesączania kłębuszkowego, frakcji filtracyjnej, oporności nerkowo-naczyniowej, lub klirens kreatyniny.
Hydrochlorotiazyd
Po podaniu doustnym hydrochlorotiazydu diureza rozpoczyna się w ciągu 2 godzin, osiąga szczyt po około 4 godzinach i trwa około 6 do 12 godzin.
Interakcje leków
Hydrochlorotiazyd
Alkohol, barbiturany lub narkotyki
Może wystąpić nasilenie niedociśnienia ortostatycznego.
Leki zwiotczające mięśnie szkieletowe
Możliwa zwiększona reakcja na środki zwiotczające mięśnie, takie jak pochodne kurary.
Kortykosteroidy, ACTH
Nasilone ubytki elektrolitów, szczególnie hipokaliemia.
Aminy presyjne (np. noradrenalina)
Możliwa zmniejszona reakcja na aminy presyjne, ale niewystarczająca, aby wykluczyć ich stosowanie.
Farmakokinetyka
Telmisartan
Wchłanianie:
Po podaniu doustnym maksymalne stężenie (Cmax) telmisartanu osiągane jest w ciągu 0,5 do 1 godziny po podaniu. Pokarm nieznacznie zmniejsza biodostępność telmisartanu, zmniejszając pole pod krzywą zależności stężenia w osoczu od czasu (AUC) o około 6% po dawce 40 mg i około 20% po dawce 160 mg. MICARDIS 20 mg HCT można podawać z posiłkiem lub bez posiłku. Całkowita biodostępność telmisartanu zależy od dawki. Przy 40 i 160 mg biodostępność wynosiła odpowiednio 42% i 58%. Farmakokinetyka telmisartanu podawanego doustnie MICARDIS 20 mg jest nieliniowa w zakresie dawek od 20 do 160 mg, z większym niż proporcjonalny wzrost stężenia w osoczu (Cmax i AUC) wraz ze wzrostem dawek. Telmisartan wykazuje dwuwykładniczą kinetykę zaniku z okresem półtrwania w końcowej fazie eliminacji wynoszącym około 24 godziny. Minimalne stężenie telmisartanu w osoczu przy dawkowaniu raz na dobę wynosi około 10% do 25% maksymalnych stężeń w osoczu. Telmisartan ma wskaźnik kumulacji w osoczu od 1,5 do 2,0 po wielokrotnym podawaniu raz na dobę.
Dystrybucja:
Telmisartan silnie wiąże się z białkami osocza (>99,5%), głównie albuminami i kwaśną glikoproteiną α1. Wiązanie z białkami osocza jest stałe w zakresie stężeń osiąganym przy zalecanych dawkach. Objętość dystrybucji telmisartanu wynosi około 500 litrów, co wskazuje na dodatkowe wiązanie z tkankami.
Metabolizm:
Telmisartan jest metabolizowany przez sprzęganie z wytworzeniem farmakologicznie nieaktywnego acyloglukuronidu; glukuronid związku macierzystego jest jedynym metabolitem zidentyfikowanym w ludzkim osoczu i moczu. Po podaniu pojedynczej dawki glukuronid stanowi około 11% mierzonej radioaktywności w osoczu. Izoenzymy cytochromu P450 nie biorą udziału w metabolizmie telmisartanu.
Eliminacja:
Po dożylnym lub doustnym podaniu telmisartanu znakowanego węglem 14C większość podanej dawki (>97%) została wydalona w postaci niezmienionej z kałem poprzez wydalanie z żółcią; w moczu znaleziono jedynie niewielkie ilości (odpowiednio 0,91% i 0,49% całkowitej radioaktywności).
Całkowity klirens telmisartanu z osocza wynosi >800 ml/min. Wydaje się, że końcowy okres półtrwania i całkowity klirens są niezależne od dawki.
Hydrochlorotiazyd
Hydrochlorotiazyd nie jest metabolizowany, ale jest szybko eliminowany przez nerki. Gdy poziomy w osoczu były obserwowane przez co najmniej 24 godziny, okres półtrwania w osoczu wahał się od 5,6 do 14,8 godzin. Co najmniej 61% dawki doustnej jest wydalane w postaci niezmienionej w ciągu 24 godzin.
Hydrochlorotiazyd przenika przez łożysko, ale nie przez barierę krew-mózg i przenika do mleka matki.
Określone populacje
Telmisartan
Niewydolność nerek
Telmisartan nie jest usuwany z krwi przez hemofiltrację [patrz OSTRZEŻENIA I ŚRODKI , oraz Używaj w określonych populacjach ].
Niewydolność wątroby
U pacjentów z niewydolnością wątroby stężenie telmisartanu w osoczu jest zwiększone, a bezwzględna biodostępność zbliża się do 100% [patrz Używaj w określonych populacjach ].
Płeć
Stężenia telmisartanu w osoczu są na ogół 2 do 3 razy wyższe u kobiet niż u mężczyzn. Jednak w badaniach klinicznych u kobiet nie stwierdzono istotnego wzrostu odpowiedzi ciśnienia tętniczego ani częstości występowania niedociśnienia ortostatycznego. Nie jest konieczne dostosowanie dawki.
Pacjenci geriatryczni
Farmakokinetyka telmisartanu nie różni się u osób w podeszłym wieku i młodszych niż 65 lat.
Badania interakcji leków
Telmisartan
Ramipryl
Jednoczesne podawanie 80 mg telmisartanu raz na dobę i 10 mg ramiprylu raz na dobę zdrowym ochotnikom zwiększa Cmax i AUC ramiprylu w stanie stacjonarnym odpowiednio 2,3- i 2,1-krotnie oraz Cmax i AUC ramiprylatu odpowiednio 2,4- i 1,5-krotnie . Natomiast Cmax i AUC telmisartanu zmniejszają się odpowiednio o 31% i 16%. W przypadku równoczesnego podawania telmisartanu i ramiprylu odpowiedź może być większa ze względu na możliwe addytywne działanie farmakodynamiczne złożonych leków, a także ze względu na zwiększoną ekspozycję na ramipryl i ramiprylat w obecności telmisartanu.
Inne leki
Jednoczesne podawanie telmisartanu nie powodowało klinicznie istotnych interakcji z paracetamolem, amlodypiną, gliburydem, symwastatyną, hydrochlorotiazydem, warfaryną lub ibuprofenem. Telmisartan nie jest metabolizowany przez układ cytochromu P450 i in vitro nie miał wpływu na enzymy cytochromu P450, z wyjątkiem pewnego hamowania CYP2C19. Nie przewiduje się interakcji telmisartanu z lekami hamującymi enzymy cytochromu P450; nie oczekuje się również interakcji z lekami metabolizowanymi przez enzymy cytochromu P450, z wyjątkiem możliwego hamowania metabolizmu leków metabolizowanych przez CYP2C19.
Studia kliniczne
Telmisartan i hydrochlorotiazyd
kontrolowanych badaniach klinicznych z udziałem ponad 2500 pacjentów z nadciśnieniem, 1017 pacjentów otrzymywało telmisartan (20 mg do 160 mg) i jednocześnie hydrochlorotiazyd (6,25 mg do 25 mg). Badania te obejmowały jedno badanie czynnikowe (Badanie 1) z połączeniami telmisartanu (20 mg, 40 mg, 80 mg, 160 mg lub placebo) i hydrochlorotiazydu (6,25 mg, 12,5 mg, 25 mg i placebo). W badaniu czynnikowym randomizowano 818 pacjentów, w tym 493 (60%) mężczyzn; 596 (73%) innych ras i 222 (27%) czarnych; oraz 143 (18%) w wieku ≥65 lat (mediana wieku wynosiła 53 lata). Średnie ciśnienie krwi w pozycji wyjściowej dla całej populacji wynosiło 154/101 mmHg.
Połączenie telmisartanu i hydrochlorotiazydu powodowało addytywne, skorygowane względem placebo zmniejszenie skurczowego i rozkurczowego ciśnienia krwi przy wartości minimalnej 16-21/9-11 mmHg dla dawek od 40 mg/12,5 mg do 80 mg/25 mg, w porównaniu z 9-13 /7-8 mmHg dla telmisartanu 40 mg do 80 mg w monoterapii i 4/4 mmHg dla hydrochlorotiazydu 12,5 mg w monoterapii. Efekt hipotensyjny był niezależny od wieku i płci. W badaniu kontrolowanym placebo zasadniczo nie zaobserwowano zmiany częstości akcji serca u pacjentów leczonych skojarzeniem telmisartanu i hydrochlorotiazydu.
Cztery inne badania z udziałem pacjentów z nadciśnieniem, trwające co najmniej sześć miesięcy, umożliwiły dodanie hydrochlorotiazydu u pacjentów, którzy albo nie byli odpowiednio kontrolowani podczas randomizowanej dawki telmisartanu w monoterapii, albo nie osiągnęli odpowiedniej odpowiedzi na ciśnienie krwi po zakończeniu zwiększania dawki telmisartanu. W badaniach z aktywną kontrolą dodanie 12,5 mg hydrochlorotiazydu do zwiększanych dawek telmisartanu u pacjentów, u których nie uzyskano lub nie utrzymano odpowiedniej odpowiedzi na monoterapię telmisartanem, dodatkowo zmniejszało skurczowe i rozkurczowe ciśnienie krwi.
INFORMACJA O PACJENCIE
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan i hydrochlorotiazyd) Tabletki
Przeczytaj tę Informację dla pacjenta przed rozpoczęciem przyjmowania tabletek MICARDIS HCT i za każdym razem, gdy otrzymujesz uzupełnienie. Mogą pojawić się nowe informacje. Informacje te nie zastępują rozmowy z lekarzem na temat stanu zdrowia lub leczenia.
Jakie są najważniejsze informacje, które powinienem wiedzieć o tabletkach MICARDIS 20mg HCT?
MICARDIS HCT może spowodować uszkodzenie lub śmierć nienarodzonego dziecka. Porozmawiaj z lekarzem o innych sposobach obniżenia ciśnienia krwi, jeśli planujesz zajść w ciążę. Jeśli pacjentka zajdzie w ciążę podczas przyjmowania leku MICARDIS 20 mg HCT, należy natychmiast poinformować o tym lekarza.
Co to jest MICARDIS HCT?
MICARDIS 40mg HCT to lek na receptę stosowany w leczeniu wysokiego ciśnienia krwi (nadciśnienia).
MICARDIS 40mg HCT zawiera:
- telmisartan, bloker receptora angiotensyny (ARB)
- hydrochlorotiazyd, pigułka na wodę lub środek moczopędny
Lekarz może przepisać inne leki, które należy przyjmować razem z lekiem MICARDIS 80 mg HCT w celu leczenia nadciśnienia tętniczego.
Nie wiadomo, czy MICARDIS 40 mg HCT jest bezpieczny i skuteczny u dzieci.
Nie należy stosować leku MICARDIS 20 mg HCT tabletki, jeśli:
- mieć niski lub brak wydalania moczu
- jeśli pacjent ma uczulenie (nadwrażliwość) na substancje czynne (telmisartan lub hydrochlorotiazyd) lub którykolwiek z pozostałych składników wymienionych na końcu tej ulotki
O czym powinienem powiedzieć lekarzowi przed zastosowaniem leku MICARDIS 40mg HCT tabletki?
Przed przyjęciem leku MICARDIS 20 mg HCT tabletki należy poinformować lekarza, jeśli:
- są w ciąży lub planują zajść w ciążę. Widzieć „Jakie są najważniejsze informacje, które powinienem wiedzieć o tabletkach MICARDIS 20mg HCT?”
- karmisz piersią lub planujesz karmić piersią. MICARDIS 80 mg HCT może przenikać do mleka matki i może zaszkodzić dziecku. Ty i twój lekarz powinniście zdecydować, czy będziecie przyjmować lek MICARDIS HCT, czy karmić piersią. Nie powinieneś robić obu. Porozmawiaj z lekarzem o najlepszym sposobie karmienia dziecka, jeśli przyjmujesz tabletki MICARDIS HCT.
- powiedziano mu, że u pacjenta występuje nieprawidłowe stężenie soli w organizmie (elektrolitów) we krwi;
- masz problemy z wątrobą
- masz astmę lub astmę w wywiadzie
- mieć tocznia
- mieć cukrzycę
- masz problemy z nerkami
- masz jakiekolwiek inne schorzenia
Poinformuj lekarza o wszystkich przyjmowanych lekach, w tym leki na receptę i bez recepty, witaminy i suplementy ziołowe. Poinformuj również lekarza, jeśli pijesz alkohol.
MICARDIS 20mg HCT może wpływać na działanie innych leków, a inne leki mogą wpływać na działanie MICARDIS 20mg HCT. Szczególnie powiedz swojemu lekarzowi, jeśli przyjmujesz:
- aliskiren
- digoksyna (Lanoxin®)
- lit (Lithobid®, węglan litu, cytrynian litu)
- inne leki stosowane w leczeniu wysokiego ciśnienia krwi lub choroby serca;
- tabletki na wodę (moczopędne)
- aspiryna lub inne niesteroidowe leki przeciwzapalne (NLPZ)
- suplementy potasu lub substytut soli zawierający potas
- leki stosowane w leczeniu cukrzycy, w tym insulina
- narkotyczne leki przeciwbólowe
- tabletki nasenne
- lek steroidowy lub hormon adrenokortykotropowy (ACTH)
- barbiturany
- niektóre leki obniżające poziom cholesterolu (żywice stosowane do obniżania poziomu cholesterolu, np. żywice cholestyramina i kolestypol)
Zapytaj swojego lekarza, jeśli nie jesteś pewien, czy przyjmujesz jeden z wymienionych powyżej leków.
Poznaj leki, które przyjmujesz. Zachowaj ich listę i pokaż ją swojemu lekarzowi lub farmaceucie, gdy otrzymasz nowy lek.
Jak należy przyjmować tabletki MICARDIS HCT?
- Lek MICARDIS 40 mg HCT tabletki należy przyjmować zgodnie z zaleceniami lekarza.
- Lekarz poinformuje pacjenta, jaką dawkę leku MICARDIS HCT należy przyjąć i kiedy.
- Nie należy zmieniać dawki, chyba że tak zaleci lekarz.
- Lek MICARDIS HCT należy przyjmować raz dziennie.
- Lek MICARDIS 20 mg HCT tabletki należy przyjmować z posiłkiem lub bez posiłku.
- W przypadku przyjęcia zbyt dużej dawki leku MICARDIS HCT należy natychmiast skontaktować się z lekarzem lub udać się na pogotowie ratunkowe najbliższego szpitala.
- Przeczytać „Jak otworzyć blister” na końcu ulotki przed zastosowaniem leku MICARDIS 20 mg HCT. Porozmawiaj z lekarzem, jeśli nie rozumiesz instrukcji.
Jakie są możliwe działania niepożądane tabletek MICARDIS 80 mg HCT?
Tabletki MICARDIS 20mg HCT mogą powodować poważne działania niepożądane , w tym :
- Uraz lub śmierć nienarodzonego dziecka. Widzieć „Jakie są najważniejsze informacje, które powinienem wiedzieć o tabletkach MICARDIS HCT?”
- Niskie ciśnienie krwi (jon hipotensyjny) jest to najbardziej prawdopodobne, jeśli również:
- brać tabletki na wodę (diuretyki)
- są na diecie niskosolnej
- skorzystaj z dializ
- masz problemy z sercem
- zachorować na wymioty lub biegunkę
- nie pij wystarczającej ilości płynów
- dużo się pocisz
- Problemy z nerkami , co może się pogorszyć, jeśli masz już chorobę nerek. Mogą wystąpić zmiany w wynikach badań nerek i może być konieczne zastosowanie mniejszej dawki tabletek MICARDIS 40 mg HCT. Zadzwoń do lekarza, jeśli otrzymasz:
- obrzęk stóp, kostek lub dłoni
- niewyjaśniony przyrost masy ciała
- Problemy z wątrobą , co może się pogorszyć u osób, które już mają problemy z wątrobą i przyjmują lek MICARDIS 40 mg HCT.
- Problemy z oczami. Jeden z leków zawartych w leku MICARDIS HCT może powodować problemy z oczami, które mogą prowadzić do utraty wzroku. Objawy problemów z oczami mogą wystąpić w ciągu kilku godzin lub tygodni od rozpoczęcia stosowania leku MICARDIS
HCT. Należy natychmiast poinformować lekarza, jeśli masz:
- pogorszenie widzenia
- ból oka
- Reakcje alergiczne . Należy natychmiast poinformować lekarza, jeśli wystąpi którykolwiek z tych objawów:
- obrzęk twarzy, języka, gardła
- trudności w oddychaniu
- Pogarsza tocznia. Należy poinformować lekarza, jeśli stan tocznia pogorszy się lub stanie się aktywny podczas przyjmowania leku MICARDIS 20mg HCT.
- Zmiana poziomu soli w organizmie (elektrolitów) we krwi i problemy z płynami. Lekarz może wykonać badania w celu sprawdzenia krwi. Zadzwoń do lekarza od razu, jeśli masz:
- suchość w ustach
- pragnienie
- zmęczenie
- senność
- niepokój
- dezorientacja
- drgawki
- szybkie bicie serca
- słabość
- ból lub skurcze mięśni
- bardzo małe oddawanie moczu
- nudności lub wymioty
Jeśli czujesz się słabo lub masz zawroty głowy, połóż się i natychmiast wezwij lekarza.
Natychmiast skontaktuj się z lekarzem, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze działania niepożądane tabletek MICARDIS 80 mg HCT to:
- infekcje górnych dróg oddechowych, w tym ból/przekrwienie zatok i ból gardła
- zawroty głowy
- czuć się zmęczonym
- objawy grypopodobne
- ból pleców
- biegunka
- mdłości
To nie wszystkie możliwe działania niepożądane związane ze stosowaniem tabletek MICARDIS 20 mg HCT. Należy poinformować lekarza, jeśli wystąpią jakiekolwiek objawy niepożądane, które Cię niepokoją lub które nie ustępują. Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Jak przechowywać tabletki MICARDIS 80 mg HCT?
- Tabletki MICARDIS HCT należy przechowywać w temperaturze pokojowej od 20°C do 25°C.
- Nie należy wyjmować tabletek MICARDIS 40 mg HCT z blistrów bezpośrednio przed ich przyjęciem.
Lek MICARDIS 80 mg HCT tabletki i wszystkie leki należy przechowywać w miejscu niedostępnym dla dzieci.
Ogólne informacje o tabletkach MICARDIS 40mg HCT :
Czasami leki są przepisywane do celów innych niż wymienione w ulotce informacyjnej dla pacjenta. Nie należy stosować tabletek MICARDIS HCT w stanach, na które nie został przepisany. Nie należy podawać leku MICARDIS 20 mg HCT tabletek innym osobom, nawet jeśli mają one ten sam stan, co Ty. Może im to zaszkodzić.
Niniejsza ulotka z informacjami dla pacjenta podsumowuje najważniejsze informacje dotyczące tabletek MICARDIS HCT. Jeśli chcesz uzyskać więcej informacji, porozmawiaj ze swoim lekarzem. Możesz poprosić farmaceutę lub lekarza o informacje na temat tabletek MICARDIS 20 mg HCT przeznaczonych dla pracowników służby zdrowia.
Aby uzyskać aktualne informacje na temat przepisywania, zeskanuj poniższy kod lub zadzwoń do Boehringer Ingelheim Pharmaceuticals, Inc. pod numer 1-800-542-6257 lub (TTY) 1-800-459-9906.
Jakie są składniki tabletek MICARDIS 20mg HCT?
Składniki aktywne: telmisartan i hydrochlorotiazyd
Składniki nieaktywne: wodorotlenek sodu, meglumina, powidon, sorbitol, stearynian magnezu, monohydrat laktozy, celuloza mikrokrystaliczna, skrobia kukurydziana i glikolan sodowy skrobi
Tabletki 40 mg/12,5 mg i 80 mg/12,5 mg zawierają również: czerwony tlenek żelaza.
Tabletki 80 mg/25 mg zawierają również: żółty tlenek żelaza.
Co to jest wysokie ciśnienie krwi (nadciśnienie)?
Ciśnienie krwi to siła w naczyniach krwionośnych, kiedy serce bije i kiedy serce odpoczywa. Masz wysokie ciśnienie krwi, gdy siła jest zbyt duża. Leki obniżające ciśnienie krwi zmniejszają ryzyko udaru lub zawału serca.
Wysokie ciśnienie krwi sprawia, że serce pracuje ciężej, pompując krew przez organizm i powoduje uszkodzenie naczyń krwionośnych. Tabletki MICARDIS 80 mg HCT mogą pomóc w rozluźnieniu naczyń krwionośnych, dzięki czemu ciśnienie krwi jest niższe.
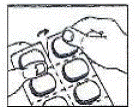
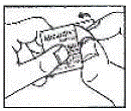
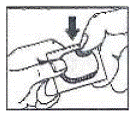
Jak otworzyć blister:
Niniejsza informacja dla pacjenta została zatwierdzona przez amerykańską Agencję ds. Żywności i Leków.
