Pepcid 20mg, 40mg Famotidine Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Pepcid i jak się go stosuje?
Pepcid (famotydyna) jest stosowany w leczeniu zgagi, GERD i zespołu Zollingera-Ellisona. Jest dostępny bez recepty. Pepcid 20mg jest dostępny jako lek generyczny.
Jakie są możliwe skutki uboczne stosowania Pepcidu?
Efekty uboczne są rzadkie, ale mogą obejmować:
- zmęczenie,
- wymioty,
- mdłości,
- dyskomfort w jamie brzusznej,
- anoreksja,
- suchość w ustach,
- wysypka i
- skurcze mięśni
OPIS
Aktywny składnik PEPCID® (famotydyna) jest antagonistą receptora histaminowego H2. Famotydyna to N'(aminosulfonylo)-3-[[[2-[(diaminometyleno)amino]-4-tiazolilo]metylo]tio]propanimidamid. Wzór empiryczny famotydyny to C8H15N7O2S3, a jej masa cząsteczkowa to 337,43. Jego wzór strukturalny to:
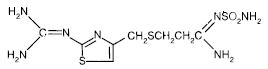
Famotydyna jest związkiem krystalicznym o barwie białej do jasnożółtej, swobodnie rozpuszczalnym w lodowatym kwasie octowym, słabo rozpuszczalnym w metanolu, bardzo słabo rozpuszczalnym w wodzie i praktycznie nierozpuszczalnym w etanolu.
Każda tabletka do podawania doustnego zawiera 20 mg lub 40 mg famotydyny oraz następujące składniki nieaktywne: hydroksypropylocelulozę, hypromelozę, tlenki żelaza, stearynian magnezu, celulozę mikrokrystaliczną, skrobię kukurydzianą, talk, dwutlenek tytanu i wosk karnauba.
WSKAZANIA
PEPCID 40mg jest wskazany w:
DAWKOWANIE I SPOSÓB PODAWANIA
Wrzód dwunastnicy
Terapia ostra: Zalecana doustna dawka dla dorosłych w przypadku czynnego wrzodu dwunastnicy wynosi 40 mg raz na dobę przed snem. Większość pacjentów goi się w ciągu 4 tygodni; rzadko istnieje powód, aby stosować PEPCID w pełnej dawce przez okres dłuższy niż 6 do 8 tygodni. Skuteczny jest również schemat 20 mg dwa razy na dobę.
Terapia podtrzymująca: Zalecana dawka doustna dla dorosłych wynosi 20 mg raz na dobę przed snem.
Łagodny wrzód żołądka
Terapia ostra: Zalecana doustna dawka dla dorosłych w przypadku czynnego, łagodnego wrzodu żołądka wynosi 40 mg raz na dobę przed snem.
Choroba refluksowa przełyku (GERD)
Zalecana dawka doustna w leczeniu dorosłych pacjentów z objawami GERD wynosi 20 mg dwa razy na dobę przez okres do 6 tygodni. Zalecana dawka doustna w leczeniu dorosłych pacjentów z zapaleniem przełyku, w tym z nadżerkami i owrzodzeniami oraz towarzyszącymi objawami związanymi z GERD, wynosi 20 lub 40 mg dwa razy na dobę przez okres do 12 tygodni (patrz FARMAKOLOGIA KLINICZNA u dorosłych , Studia kliniczne ).
Dawkowanie u pacjentów pediatrycznych w wieku poniżej 1 roku życia Choroba refluksowa przełyku (GERD)
Widzieć ŚRODKI OSTROŻNOŚCI , Pacjenci pediatryczni w wieku poniżej 1 roku.
Badania opisane w ŚRODKI OSTROŻNOŚCI, Pacjenci pediatryczni w wieku
Dawkowanie dla pacjentów pediatrycznych w wieku 1-16 lat
Widzieć ŚRODKI OSTROŻNOŚCI , Pacjenci pediatryczni w wieku 1-16 lat.
Badania opisane w ŚRODKI OSTROŻNOŚCI, Pacjenci pediatryczni w wieku 1-16 lat sugerują następujące dawki początkowe u dzieci w wieku 1-16 lat:
Wrzód trawienny - 0,5 mg/kg/dzień doustnie przed snem lub podzielona dawka do 40 mg/dzień.
Choroba refluksowa przełyku z zapaleniem przełyku lub bez, w tym nadżerki i owrzodzenia - 1,0 mg/kg/dzień po podzielona oferta do 40 mg bid
Chociaż opublikowane niekontrolowane badania sugerują skuteczność famotydyny w leczeniu choroby refluksowej przełyku i wrzodu trawiennego, dane dotyczące pacjentów pediatrycznych są niewystarczające, aby ustalić odsetek odpowiedzi w zależności od dawki i czasu trwania leczenia. W związku z tym czas trwania leczenia (początkowo w oparciu o zalecenia dotyczące czasu trwania leczenia u dorosłych) i dawkę należy dostosować indywidualnie na podstawie odpowiedzi klinicznej i (lub) oznaczenia pH (żołądka lub przełyku) oraz badania endoskopowego. W opublikowanych niekontrolowanych badaniach klinicznych u dzieci w wieku 1-16 lat stosowano dawki do 1 mg/kg/dobę w leczeniu wrzodów trawiennych i 2 mg/kg/dobę w leczeniu GERD z zapaleniem przełyku lub bez zapalenia przełyku, w tym nadżerek i owrzodzeń.
Patologiczne stany nadmiernego wydzielania (np. zespół Zollingera-Ellisona, mnogie gruczolaki wewnątrzwydzielnicze)
Dawkowanie PEPCID u pacjentów z patologicznymi stanami nadmiernego wydzielania różni się w zależności od pacjenta. Zalecana doustna dawka początkowa dla dorosłych w patologicznych stanach nadmiernego wydzielania wynosi 20 mg co 6 godzin. U niektórych pacjentów może być wymagana wyższa dawka początkowa. Dawki należy dostosować do indywidualnych potrzeb pacjenta i należy je kontynuować tak długo, jak jest to wskazane klinicznie. Niektórym dorosłym pacjentom z ciężkim zespołem Zollingera-Ellisona podawano dawki do 160 mg co 6 godzin.
Jednoczesne stosowanie leków zobojętniających kwas
W razie potrzeby można jednocześnie podawać leki zobojętniające sok żołądkowy.
Dostosowanie dawkowania u pacjentów z umiarkowaną lub ciężką niewydolnością nerek
dorosłych pacjentów z umiarkowaną (klirens kreatyniny
Na podstawie porównania parametrów farmakokinetycznych PEPCID u dorosłych i dzieci, należy rozważyć dostosowanie dawki u dzieci z umiarkowaną lub ciężką niewydolnością nerek.
JAK DOSTARCZONE
PEPCID 40 mg tabletki 20 mg, to beżowe, zaokrąglone, kwadratowe tabletki powlekane oznaczone MSD po jednej stronie i gładkie po drugiej. Dostarczane są w następujący sposób:
NDC 42998-639-09 szt. butelek 30 NDC 42998-639-98 szt. butelek po 100 sztuk.
PEPCID 40 mg tabletki, 40 mg, to beżowe, zaokrąglone, kwadratowe tabletki powlekane oznaczone MSD po jednej stronie i gładkie po drugiej. Dostarczane są w następujący sposób:
NDC 42998-649-09 szt. butelek 30 NDC 42998-649-98 szt. butelek po 100 sztuk. Przechowywanie
Przechowywać w kontrolowanej temperaturze pokojowej.
Tabletki PEPCID® (famotydyna) 20 mg i tabletki 40 mg są produkowane dla: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, USA. Wydany luty 2014.
SKUTKI UBOCZNE
Wymienione poniżej działania niepożądane zgłaszano podczas krajowych i międzynarodowych badań klinicznych u około 2500 pacjentów. W tych kontrolowanych badaniach klinicznych, w których tabletki PEPCID 40 mg porównywano z placebo, częstość występowania działań niepożądanych w grupie, która otrzymywała tabletki PEPCID 40 mg przed snem, była podobna jak w grupie placebo.
W kontrolowanych badaniach klinicznych u ponad 1% pacjentów leczonych PEPCID zgłaszano następujące działania niepożądane, które mogą być związane z lekiem: ból głowy (4,7%), zawroty głowy (1,3%), zaparcia (1,2%). ) i biegunka (1,7%).
Następujące inne działania niepożądane były zgłaszane rzadko w badaniach klinicznych lub od czasu wprowadzenia leku do obrotu. Związek z terapią PEPCID 20mg był w wielu przypadkach niejasny. W każdej kategorii działania niepożądane wymieniono według malejącego nasilenia:
Ciało jako całość: gorączka, astenia, zmęczenie
Układ sercowo-naczyniowy: arytmia, blok AV, kołatanie serca. Bardzo rzadko zgłaszano wydłużenie odstępu QT u pacjentów z zaburzeniami czynności nerek.
Przewód pokarmowy: żółtaczka cholestatyczna, zapalenie wątroby, zaburzenia aktywności enzymów wątrobowych, wymioty, nudności, dyskomfort w jamie brzusznej, jadłowstręt, suchość w ustach
Hematologiczny: rzadkie przypadki agranulocytozy, pancytopenii, leukopenii, małopłytkowości
Nadwrażliwość: anafilaksja, obrzęk naczynioruchowy, obrzęk oczodołu lub twarzy, pokrzywka, wysypka, wstrzyknięcie spojówek
Układ mięśniowo-szkieletowy: rabdomioliza, bóle mięśniowo-szkieletowe, w tym skurcze mięśni, bóle stawów
Układ nerwowy/psychiatryczny: napad typu grand mal; zaburzenia psychiczne, które były odwracalne w przypadkach, dla których przeprowadzono obserwację, w tym halucynacje, splątanie, pobudzenie, depresja, lęk, obniżone libido; parestezje; bezsenność; senność. Bardzo rzadko zgłaszano drgawki u pacjentów z zaburzeniami czynności nerek.
Oddechowy: skurcz oskrzeli, śródmiąższowe zapalenie płuc
Skóra: toksyczna nekroliza naskórka/zespół Stevensa-Johnsona (bardzo rzadko), łysienie, trądzik, świąd, suchość skóry, uderzenia gorąca
Zmysły specjalne: szum w uszach, zaburzenia smaku
Inny: zgłaszano rzadkie przypadki impotencji i rzadkie przypadki ginekomastii; jednak w kontrolowanych badaniach klinicznych częstość występowania nie była większa niż w przypadku placebo.
Działania niepożądane zgłaszane dla tabletek PEPCID mogą również wystąpić podczas stosowania PEPCID 20 mg do zawiesiny doustnej.
Pacjenci pediatryczni
W badaniu klinicznym z udziałem 35 pacjentów pediatrycznych
INTERAKCJE Z LEKAMI
Nie zidentyfikowano żadnych interakcji leków. Badania famotydyny u ludzi, na modelach zwierzęcych i in vitro nie wykazały znaczącego wpływu na rozmieszczenie związków metabolizowanych przez wątrobowe enzymy mikrosomalne, np. układ cytochromu P450. Związki testowane na ludziach obejmują warfarynę, teofilinę, fenytoinę, diazepam, aminopirynę i antypirynę. Przetestowano zieleń indocyjaninowa jako wskaźnik ekstrakcji leków z wątroby i nie stwierdzono żadnych znaczących efektów.
OSTRZEŻENIA
Nie podano informacji
ŚRODKI OSTROŻNOŚCI
Ogólny
Objawowa odpowiedź na leczenie PEPCID nie wyklucza obecności nowotworu żołądka.
Pacjenci z umiarkowaną lub ciężką niewydolnością nerek
Ponieważ u pacjentów z umiarkowaną i ciężką niewydolnością nerek zgłaszano działania niepożądane ze strony ośrodkowego układu nerwowego, u pacjentów z umiarkowaną (klirens kreatyniny FARMAKOLOGIA KLINICZNA u dorosłych oraz DAWKOWANIE I SPOSÓB PODAWANIA ). Bardzo rzadko zgłaszano wydłużenie odstępu QT u pacjentów z zaburzeniami czynności nerek, u których dawka/przerwa między dawkami famotydyny mogła nie być odpowiednio dostosowana.
rakotwórczość, mutageneza, upośledzenie płodności
W 106-tygodniowym badaniu na szczurach i 92-tygodniowym badaniu na myszach, którym podawano doustne dawki do 2000 mg/kg/dobę (około 2500-krotność zalecanej dawki u ludzi w przypadku czynnego wrzodu dwunastnicy), nie było dowodów na potencjalne działanie rakotwórcze PEPCID.
Famotydyna dała wynik ujemny w teście mutagennym drobnoustrojów (test Amesa) z użyciem Salmonella typhimurium i Escherichia coli z lub bez aktywacji enzymów wątrobowych szczura w stężeniach do 10 000 mcg/płytkę. W badaniach in vivo na myszach, z testem mikrojądrowym i testem aberracji chromosomowych, nie zaobserwowano dowodów działania mutagennego.
W badaniach na szczurach, którym podawano dawki doustne do 2000 mg/kg/dobę lub dawki dożylne do 200 mg/kg/dobę, płodność i zdolności reprodukcyjne nie były naruszone.

Ciąża
Ciąża Kategoria B
Badania dotyczące reprodukcji przeprowadzono na szczurach i królikach przy dawkach doustnych odpowiednio do 2000 i 500 mg/kg/dobę, a u obu gatunków przy dawkach dożylnych do 200 mg/kg/dobę i nie wykazały istotnych dowodów na zaburzona płodność lub uszkodzenie płodu z powodu PEPCID. Chociaż nie zaobserwowano bezpośredniego działania toksycznego na płód, u niektórych królików po podaniu doustnych dawek 200 mg/kg/dobę (250-krotnie większych od zwykłej dawki u ludzi) obserwowano sporadyczne poronienia występujące tylko u matek wykazujących znaczne zmniejszenie spożycia pokarmu. Nie ma jednak odpowiednich lub dobrze kontrolowanych badań u kobiet w ciąży. Ponieważ badania reprodukcji na zwierzętach nie zawsze pozwalają przewidzieć reakcję człowieka, lek ten powinien być stosowany w czasie ciąży tylko wtedy, gdy jest to bezwzględnie konieczne.
Matki karmiące
Badania przeprowadzone na karmiących szczurach wykazały, że famotydyna przenika do mleka matki. Przemijające zahamowanie wzrostu obserwowano u młodych szczurów karmiących piersią od matek, którym podawano dawki toksyczne dla matki, co najmniej 600 razy większe niż zwykła dawka u ludzi. Famotydyna jest wykrywalna w mleku ludzkim. Ze względu na możliwość wystąpienia poważnych działań niepożądanych u niemowląt karmionych PEPCID, należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać stosowanie leku, biorąc pod uwagę znaczenie leku dla matki.
Pacjenci pediatryczni w wieku poniżej 1 roku życia
Stosowanie PEPCID 20 mg u dzieci w wieku
Dwa badania farmakokinetyczne u dzieci w wieku 3 miesięcy do 1 roku jest podobny do klirensu obserwowanego u starszych pacjentów pediatrycznych (1-15 lat) i dorosłych . Natomiast u dzieci w wieku 0-3 miesięcy wartości klirensu famotydyny były od 2 do 4 razy mniejsze niż u starszych dzieci i dorosłych. Badania te pokazują również, że średnia biodostępność u dzieci w wieku FARMAKOLOGIA KLINICZNA u pacjentów pediatrycznych , Farmakokinetyka i farmakodynamika .)
randomizowanym, podwójnie zaślepionym badaniu z odstawieniem leczenia 35 dzieci w wieku poniżej 1 roku, u których rozpoznano chorobę refluksową przełyku, leczono przez okres do 4 tygodni famotydyną w postaci zawiesiny doustnej (0,5 mg/kg/dawkę lub 1 mg). /kg/dawkę). Chociaż dostępna była dożylna postać famotydyny, w tym badaniu żaden pacjent nie był leczony dożylnie famotydyną. Opiekunowie zostali również poinstruowani, aby stosowali leczenie zachowawcze, w tym zagęszczone karmienie. Zakwalifikowanych pacjentów zdiagnozowano przede wszystkim na podstawie historii wymiotów (plucie) i drażliwości (rozdrażnienia). Schemat dawkowania famotydyny obejmował raz na dobę u pacjentów w wieku DZIAŁANIA NIEPOŻĄDANE , Pacjenci pediatryczni ).
Badania te sugerują, że dawka początkowa 0,5 mg/kg/dawkę zawiesiny doustnej famotydyny może być korzystna w leczeniu GERD przez okres do 4 tygodni raz na dobę u pacjentów w wieku
Pacjenci pediatryczni w wieku 1-16 lat
Stosowanie PEPCID 40 mg u dzieci w wieku 1-16 lat jest poparte dowodami z odpowiednich i dobrze kontrolowanych badań PEPCID u dorosłych oraz z następujących badań u dzieci: W opublikowanych badaniach z udziałem niewielkiej liczby pacjentów pediatrycznych 1-15 klirens famotydyny był podobny do obserwowanego u dorosłych. U dzieci w wieku 11-15 lat doustne dawki 0,5 mg/kg były związane ze średnim polem pod krzywą (AUC) podobnym do obserwowanego u dorosłych leczonych doustnie 40 mg. Podobnie u dzieci w wieku 1-15 lat dożylne dawki 0,5 mg/kg wiązały się ze średnią wartością AUC podobną do obserwowanej u dorosłych leczonych dożylnie 40 mg. Ograniczone opublikowane badania sugerują również, że związek między stężeniem w surowicy a supresją kwasu jest podobny u dzieci w wieku 1-15 lat w porównaniu z dorosłymi. Badania te sugerują następującą dawkę początkową dla dzieci w wieku 1-16 lat:
Wrzód trawienny - 0,5 mg/kg/dzień doustnie przed snem lub dawka podzielona Do 40 mg/dzień.
Choroba refluksowa przełyku z zapaleniem przełyku lub bez, w tym nadżerki i owrzodzenia - 1,0 mg/kg/dzień po podzielona oferta do 40 mg bid
Chociaż opublikowane niekontrolowane badania sugerują skuteczność famotydyny w leczeniu choroby refluksowej przełyku i wrzodu trawiennego, dane dotyczące pacjentów pediatrycznych są niewystarczające, aby ustalić odsetek odpowiedzi w zależności od dawki i czasu trwania leczenia. W związku z tym czas trwania leczenia (początkowo w oparciu o zalecenia dotyczące czasu trwania leczenia u dorosłych) i dawkę należy dostosować indywidualnie na podstawie odpowiedzi klinicznej i (lub) oznaczenia pH (żołądka lub przełyku) oraz badania endoskopowego. W opublikowanych niekontrolowanych badaniach klinicznych z udziałem dzieci i młodzieży stosowano dawki do 1 mg/kg/dobę w przypadku choroby wrzodowej żołądka i 2 mg/kg/dobę w przypadku GERD z zapaleniem przełyku lub bez, w tym nadżerek i owrzodzeń.
Zastosowanie geriatryczne
Spośród 4966 uczestników badań klinicznych, którzy byli leczeni famotydyną, 488 (9,8%) było w wieku 65 lat i starszych, a 88 (1,7%) było w wieku powyżej 75 lat. Nie zaobserwowano ogólnych różnic w bezpieczeństwie lub skuteczności między tymi osobami a młodszymi osobami. Nie można jednak wykluczyć większej wrażliwości niektórych osób starszych.
Nie ma konieczności dostosowywania dawki w zależności od wieku (patrz FARMAKOLOGIA KLINICZNA u dorosłych , Farmakokinetyka ). Wiadomo, że lek ten jest w znacznym stopniu wydalany przez nerki, a ryzyko reakcji toksycznych na ten lek może być większe u pacjentów z zaburzeniami czynności nerek. Ponieważ u pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo upośledzenia czynności nerek, należy zachować ostrożność przy doborze dawki i może być przydatne monitorowanie czynności nerek. Konieczna jest modyfikacja dawkowania w przypadku umiarkowanych lub ciężkich zaburzeń czynności nerek (patrz ŚRODKI OSTROŻNOŚCI , Pacjenci z umiarkowaną lub ciężką niewydolnością nerek oraz DAWKOWANIE I SPOSÓB PODAWANIA , Dostosowanie dawkowania u pacjentów z umiarkowaną lub ciężką niewydolnością nerek ).
PRZEDAWKOWAĆ
Działania niepożądane w przypadkach przedawkowania są podobne do działań niepożądanych występujących w normalnym doświadczeniu klinicznym (patrz DZIAŁANIA NIEPOŻĄDANE ). Dorosłym pacjentom z patologicznymi stanami nadmiernego wydzielania podawano doustne dawki do 640 mg/dobę bez poważnych działań niepożądanych. W przypadku przedawkowania leczenie powinno być objawowe i podtrzymujące. Niewchłonięty materiał należy usunąć z przewodu pokarmowego, pacjenta należy monitorować i zastosować leczenie wspomagające.
Doustna dawka śmiertelna famotydyny u samców i samic szczurów i myszy wynosiła ponad 3000 mg/kg, a minimalna śmiertelna ostra dawka doustna u psów przekraczała 2000 mg/kg. Famotydyna nie wywoływała jawnego działania w dużych dawkach doustnych u myszy, szczurów, kotów i psów, ale wywoływała znaczną anoreksję i zahamowanie wzrostu u królików począwszy od dawki 200 mg/kg/dobę doustnie. Dożylne LD50 famotydyny dla myszy i szczurów wahało się od 254-563 mg/kg, a minimalna śmiertelna pojedyncza dawka dożylna u psów wynosiła około 300 mg/kg. Oznakami ostrego zatrucia u psów leczonych dożylnie były wymioty, niepokój, bladość błon śluzowych lub zaczerwienienie ust i uszu, niedociśnienie, tachykardia i zapaść.
PRZECIWWSKAZANIA
Nadwrażliwość na którykolwiek składnik tych produktów. Zaobserwowano wrażliwość krzyżową w tej klasie związków. Dlatego PEPCID 40 mg nie powinien być podawany pacjentom z nadwrażliwością na innych antagonistów receptora H2.
FARMAKOLOGIA KLINICZNA
Farmakologia kliniczna u dorosłych
Efekty żołądkowo-jelitowe
PEPCID jest konkurencyjnym inhibitorem receptorów histaminowych H2. Podstawowym klinicznie ważnym działaniem farmakologicznym PEPCID 40 mg jest hamowanie wydzielania żołądkowego. PEPCID hamuje zarówno stężenie kwasu, jak i objętość wydzielania żołądkowego, podczas gdy zmiany w wydzielaniu pepsyny są proporcjonalne do wydalanej objętości.
U zdrowych ochotników i osób z nadmiernym wydzielaniem, PEPCID 20 mg hamował podstawowe i nocne wydzielanie żołądkowe, a także wydzielanie stymulowane przez pokarm i pentagastrynę. Po podaniu doustnym początek działania przeciwwydzielniczego wystąpił w ciągu jednej godziny; maksymalny efekt był zależny od dawki i występował w ciągu jednej do trzech godzin. Czas trwania hamowania wydzielania przez dawki 20 i 40 mg wynosił od 10 do 12 godzin.
Pojedyncze wieczorne dawki doustne 20 i 40 mg hamowały podstawowe i nocne wydzielanie kwasu u wszystkich pacjentów; średnie nocne wydzielanie kwasu żołądkowego zostało zahamowane odpowiednio o 86% i 94% przez okres co najmniej 10 godzin. Te same dawki podane rano tłumiły stymulowane przez żywność wydzielanie kwasu u wszystkich badanych. Średnie zahamowanie wyniosło odpowiednio 76% i 84% 3 do 5 godzin po podaniu oraz 25% i 30% odpowiednio 8 do 10 godzin po podaniu. Jednak u niektórych osób, które otrzymały dawkę 20 mg, efekt przeciwwydzielniczy zanikał w ciągu 6-8 godzin. Nie było skumulowanego efektu po wielokrotnych dawkach. Nocne śródżołądkowe pH podniesiono wieczornymi dawkami 20 i 40 mg PEPCID do średnich wartości odpowiednio 5,0 i 6,4. Gdy 40 mg PEPCID podano po śniadaniu, podstawowe wartości pH w ciągu dnia w czasie 3 i 8 godzin po 20 lub 40 mg PEPCID 40 mg podniesiono do około 5.
PEPCID 40 mg miał niewielki lub żaden wpływ na stężenie gastryny w surowicy na czczo lub po posiłku. PEPCID nie wpływał na opróżnianie żołądka i zewnątrzwydzielniczą czynność trzustki.
Inne efekty
W badaniach farmakologii klinicznej nie odnotowano ogólnoustrojowego działania PEPCID na ośrodkowy układ nerwowy, układ sercowo-naczyniowy, oddechowy lub hormonalny. Nie odnotowano również efektów antyandrogennych. (Widzieć DZIAŁANIA NIEPOŻĄDANE .) Poziomy hormonów w surowicy, w tym prolaktyny, kortyzolu, tyroksyny (T4) i testosteronu, nie uległy zmianie po leczeniu PEPCID.
Farmakokinetyka
PEPCID 20mg jest niecałkowicie wchłaniany. Biodostępność dawek doustnych wynosi 40-45%. Biodostępność może być nieznacznie zwiększona przez pokarm lub nieznacznie zmniejszona przez leki zobojętniające; jednak efekty te nie mają konsekwencji klinicznych. PEPCID podlega minimalnemu metabolizmowi pierwszego przejścia. Po podaniu doustnym maksymalne stężenie w osoczu występuje po 1-3 godzinach. Poziomy w osoczu po wielokrotnych dawkach są podobne do tych po pojedynczych dawkach. Piętnaście do 20% PEPCID 20 mg w osoczu wiąże się z białkami. PEPCID ma okres półtrwania w fazie eliminacji 2,5-3,5 godziny. PEPCID jest eliminowany drogą nerkową (65-70%) i metaboliczną (30-35%). Klirens nerkowy wynosi 250-450 ml/min, co wskazuje na pewne wydalanie kanalikowe. Dwadzieścia pięć do 30% dawki doustnej i 65-70% dawki dożylnej jest wydalane w moczu w postaci niezmienionej. Jedynym metabolitem zidentyfikowanym u człowieka jest S-tlenek.
Istnieje ścisły związek między wartościami klirensu kreatyniny a okresem półtrwania PEPCID w fazie eliminacji. U pacjentów z ciężką niewydolnością nerek, tj. z klirensem kreatyniny mniejszym niż 10 ml/min, okres półtrwania PEPCID w fazie eliminacji może przekraczać 20 godzin i może być konieczne dostosowanie dawki lub przerw między kolejnymi dawkami w umiarkowanej i ciężkiej niewydolności nerek (patrz ŚRODKI OSTROŻNOŚCI , DAWKOWANIE I SPOSÓB PODAWANIA ).
U pacjentów w podeszłym wieku nie występują klinicznie istotne zmiany farmakokinetyki PEPCID związane z wiekiem. Jednak u pacjentów w podeszłym wieku z upośledzoną czynnością nerek klirens leku może być zmniejszony (patrz ŚRODKI OSTROŻNOŚCI , Zastosowanie geriatryczne ).
Studia kliniczne
Wrzód dwunastnicy
W wieloośrodkowym amerykańskim badaniu z podwójnie ślepą próbą u pacjentów ambulatoryjnych z potwierdzonym endoskopowo wrzodem dwunastnicy porównywano doustnie podawany PEPCID z placebo. Jak pokazano w Tabeli 1, 70% pacjentów leczonych PEPCID 40 mg hs zostało wyleczonych do 4. tygodnia.
Pacjenci, którzy nie wyleczyli się do 4 tygodnia, kontynuowali badanie. Do 8. tygodnia 83% pacjentów leczonych PEPCID wyleczyło się w porównaniu z 45% pacjentów otrzymujących placebo. Częstość gojenia się owrzodzeń po podaniu PEPCID była znacząco wyższa niż po placebo w każdym punkcie czasowym na podstawie odsetka endoskopowo potwierdzonych wygojonych owrzodzeń.
W tym badaniu czas do złagodzenia bólu w ciągu dnia i nocy był znacznie krótszy u pacjentów otrzymujących PEPCID niż u pacjentów otrzymujących placebo; pacjenci otrzymujący PEPCID przyjmowali również mniej środków zobojętniających kwas niż pacjenci otrzymujący placebo.
Długotrwałe leczenie podtrzymujące owrzodzeń dwunastnicy
PEPCID 40 mg, 20 mg pohs, porównano z placebo hs jako leczenie podtrzymujące w dwóch podwójnie zaślepionych, wieloośrodkowych badaniach pacjentów z endoskopowo potwierdzonym wygojeniem wrzodów dwunastnicy. W badaniu amerykańskim obserwowana częstość występowania wrzodów w ciągu 12 miesięcy u pacjentów otrzymujących placebo była 2,4 razy większa niż u pacjentów leczonych PEPCID. U 89 pacjentów leczonych PEPCID skumulowana częstość występowania owrzodzeń wynosiła 23,4% w porównaniu z obserwowaną częstością występowania owrzodzeń 56,6% u 89 pacjentów otrzymujących placebo (p
Wrzód gastryczny
Zarówno w amerykańskim, jak i międzynarodowym, wieloośrodkowym badaniu z podwójnie ślepą próbą u pacjentów z potwierdzonym endoskopowo aktywnym łagodnym wrzodem żołądka, porównywano doustnie PEPCID 20 mg, 40 mg hs z placebo. między grupami PEPCID i placebo. Jak pokazano w Tabeli 2, częstość gojenia się owrzodzeń (wyleczenia liczone jako niewyleczone) po podaniu PEPCID 20 mg była statystycznie istotnie lepsza niż placebo w 6. i 8. tygodniu badania w USA oraz w 4., 6. i 8. tygodniu w badaniu międzynarodowym, na podstawie na liczbę zagojonych wrzodów, potwierdzonych badaniem endoskopowym.
Czas do całkowitego złagodzenia bólu w ciągu dnia i nocy był statystycznie istotnie krótszy u pacjentów otrzymujących PEPCID 20 mg niż u pacjentów otrzymujących placebo; jednak w żadnym z badań nie było statystycznie istotnej różnicy w odsetku pacjentów, u których ból ustąpił do końca badania (8. tydzień).
Choroba refluksowa przełyku (GERD)
Doustnie podawany PEPCID porównywano z placebo w badaniu w USA, do którego włączono pacjentów z objawami GERD i bez endoskopowych dowodów na erozję lub owrzodzenie przełyku. PEPCID 20 mg bid był statystycznie istotnie lepszy niż 40 mg na godzinę i placebo w zapewnieniu pomyślnego leczenia objawowego, definiowanego jako umiarkowana lub doskonała poprawa objawów (Tabela 3).
Po dwóch tygodniach leczenia powodzenie objawowe obserwowano u większego odsetka pacjentów przyjmujących PEPCID 20 mg dwa razy na dobę w porównaniu z placebo (p ≤ 0,01).
Poprawę objawów i gojenie potwierdzonych endoskopowo nadżerek i owrzodzeń badano w dwóch dodatkowych badaniach. Gojenie definiowano jako całkowite ustąpienie wszystkich nadżerek lub owrzodzeń widocznych w endoskopii. Amerykańskie badanie porównujące PEPCID 40 mg dwa razy dziennie z placebo i PEPCID 20 mg dwa razy dziennie wykazało istotnie większy odsetek zagojenia po podaniu PEPCID 40 mg dwa razy dziennie w 6 i 12 tygodniu (Tabela 4).
W porównaniu z placebo, pacjenci, którzy otrzymywali PEPCID szybciej złagodzili zgagę w ciągu dnia i nocy, a większy odsetek pacjentów doświadczył całkowitego złagodzenia zgagi nocnej. Różnice te były istotne statystycznie.
W międzynarodowym badaniu, porównując PEPCID 40 mg dwa razy dziennie z ranitydyną 150 mg dwa razy dziennie, statystycznie istotnie większy odsetek gojenia obserwowano po podaniu PEPCID 40 mg dwa razy dziennie w 12. tygodniu (Tabela 5). Nie było jednak znaczącej różnicy między terapiami w łagodzeniu objawów.
Patologiczne stany nadmiernego wydzielania (np. zespół Zollingera-Ellisona, mnogie gruczolaki wewnątrzwydzielnicze)
W badaniach pacjentów z patologicznymi stanami nadmiernego wydzielania, takimi jak zespół Zollingera-Ellisona z lub bez wielu gruczolaków endokrynnych, PEPCID znacząco hamował wydzielanie kwasu żołądkowego i kontrolował objawy towarzyszące. Podawane doustnie dawki od 20 do 160 mg co 6 h utrzymywały podstawowe wydzielanie kwasu poniżej 10 mEq/h; dawki początkowe były dostosowywane do indywidualnych potrzeb pacjenta, a u niektórych pacjentów z czasem konieczne były dalsze dostosowania. PEPCID 40 mg był dobrze tolerowany w tych wysokich dawkach przez dłuższy czas (dłużej niż 12 miesięcy) u ośmiu pacjentów i nie zgłoszono przypadków ginekomastii, zwiększonego poziomu prolaktyny lub impotencji, które uznano za spowodowane lekiem.
Farmakologia kliniczna u pacjentów pediatrycznych
Farmakokinetyka
Tabela 6 przedstawia dane farmakokinetyczne z badań klinicznych i opublikowanego badania z udziałem dzieci (
Klirens osocza jest zmniejszony, a okres półtrwania w fazie eliminacji jest wydłużony u dzieci w wieku 0-3 miesięcy w porównaniu ze starszymi dziećmi. Parametry farmakokinetyczne dla pacjentów pediatrycznych w wieku > 3 miesięcy do 15 lat są porównywalne z uzyskanymi dla dorosłych.
Badania biodostępności przeprowadzone na 8 pacjentach pediatrycznych (w wieku 11-15 lat) wykazały średnią biodostępność po podaniu doustnym 0,5 w porównaniu z wartościami dla dorosłych od 0,42 do 0,49. Dawki doustne 0,5 mg/kg osiągnęły AUC 645 ± 249 ng-h/ml i 580 ± 60 ng-h/ml u dzieci w wieku
Farmakodynamika
Farmakodynamikę famotydyny oceniano u 5 pacjentów pediatrycznych w wieku 2-13 lat przy użyciu modelu sigmoidalnego Emax. Dane te sugerują, że związek między stężeniem famotydyny w surowicy a supresją kwasu żołądkowego jest podobny do obserwowanego w jednym badaniu z udziałem dorosłych (Tabela 7).
W pięciu opublikowanych badaniach (tabela 8) zbadano wpływ famotydyny na pH żołądka i czas trwania supresji kwasu u dzieci. Chociaż każde badanie miało inny projekt, dane dotyczące supresji kwasu w czasie podsumowano w następujący sposób:
jednym badaniu wykazano, że czas działania famotydyny podawanej dożylnie w dawce 0,5 mg/kg mc. na pH żołądka i zahamowanie wydzielania kwasu żołądkowego jest dłuższy u dzieci w wieku poniżej 1 miesiąca niż u starszych dzieci. Ten dłuższy czas trwania supresji kwasu żołądkowego jest zgodny ze zmniejszonym klirensem u dzieci w wieku
INFORMACJA O PACJENCIE
Brak informacji. Proszę odnieść się do ŚRODKI OSTROŻNOŚCI Sekcja.
