Proair Inhaler 100mcg Salbutamol Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest ProAir i jak jest używane?
ProAir to lek na receptę stosowany w leczeniu objawów ostrej, ciężkiej lub wywołanej wysiłkiem fizycznym astmy (skurczu oskrzeli). ProAir może być stosowany samodzielnie lub z innymi lekami.
ProAir należy do klasy leków o nazwie PAH, inhibitory PDE-5, inhibitory enzymu fosfodiesterazy-5.
Nie wiadomo, czy ProAir jest bezpieczny i skuteczny u dzieci w wieku poniżej 4 lat.
Jakie są możliwe skutki uboczne ProAir?
ProAir może powodować poważne skutki uboczne, w tym:
- świszczący oddech,
- dławiąc się,
- inne problemy z oddychaniem,
- ból w klatce piersiowej,
- szybkie tętno,
- bicie serca lub trzepotanie w klatce piersiowej,
- silny ból głowy,
- walenie w szyję lub uszy,
- ból lub pieczenie podczas oddawania moczu,
- zwiększone pragnienie,
- zwiększone oddawanie moczu,
- suchość w ustach,
- owocowy zapach oddechu,
- kurcze nóg,
- zaparcie,
- nieregularne bicie serca,
- zwiększone pragnienie lub oddawanie moczu,
- drętwienie lub mrowienie i
- osłabienie mięśni lub uczucie wiotkości
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne ProAir to:
- ból w klatce piersiowej,
- szybkie lub mocno bijące bicie serca,
- zawroty głowy,
- uczucie roztrzęsienia lub zdenerwowania,
- ból głowy,
- ból pleców,
- bóle,
- rozstrój żołądka,
- ból gardła,
- ból zatok i
- katar lub zatkany nos
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne ProAir. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OPIS
Aktywnym składnikiem ProAir HFA (siarczan albuterolu) aerozol do inhalacji jest siarczan albuterolu, racemiczna sól albuterolu. Siarczan Albuterolu ma nazwę chemiczną α-[(tert-butylamino)metylo]-4-hydroksy-m-ksyleno-α,α'-diolu (2:1) (sól) i ma następującą budowę chemiczną:
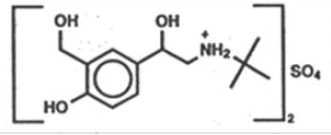
Masa cząsteczkowa siarczanu albuterolu wynosi 576,7, a wzór empiryczny to (C13H21NO3)2 •H2SO4. Siarczan Albuterolu jest krystalicznym proszkiem o barwie od białej do białawej. Jest rozpuszczalny w wodzie i słabo rozpuszczalny w etanolu. Siarczan Albuterolu jest oficjalną nazwą rodzajową w Stanach Zjednoczonych, a siarczan salbutamolu jest zalecaną nazwą rodzajową Światowej Organizacji Zdrowia. ProAir HFA Inhalation Aerosol to ciśnieniowe urządzenie aerozolowe z dozownikiem i licznikiem dawek. ProAir HFA jest przeznaczony wyłącznie do inhalacji doustnej. Zawiera mikrokrystaliczną zawiesinę siarczanu albuterolu w propelencie HFA-134a (1,1,1,2-tetrafluoroetan) i etanolu.
Napełnić inhalator przed pierwszym użyciem oraz w przypadkach, gdy inhalator nie był używany przez ponad 2 tygodnie, wypuszczając trzy rozpylenia w powietrze, z dala od twarzy. Po przygotowaniu, każde uruchomienie dostarcza 108 mcg siarczanu albuterolu z ustnika urządzenia uruchamiającego (co odpowiada 90 mcg bazy albuterolu). Każdy kanister zapewnia 200 uruchomień (wdechów).
Ten produkt nie zawiera chlorofluorowęglowodorów (CFC) jako propelentu.
WSKAZANIA
Skurcz oskrzeli
Aerozol do inhalacji PROAIR HFA jest wskazany do leczenia lub zapobiegania skurczowi oskrzeli u pacjentów w wieku 4 lat i starszych z odwracalną obturacyjną chorobą dróg oddechowych.
Skurcz oskrzeli wywołany wysiłkiem fizycznym
Aerozol do inhalacji PROAIR HFA jest wskazany w zapobieganiu skurczowi oskrzeli wywołanemu wysiłkiem fizycznym u pacjentów w wieku 4 lat i starszych.
DAWKOWANIE I SPOSÓB PODAWANIA
Skurcz oskrzeli
W leczeniu ostrych epizodów skurczu oskrzeli lub zapobieganiu objawom związanym ze skurczem oskrzeli, zwykle stosowana dawka u dorosłych i dzieci w wieku 4 lat i starszych to dwie inhalacje powtarzane co 4 do 6 godzin. Nie zaleca się częstszego podawania lub większej liczby inhalacji. U niektórych pacjentów wystarczy jedna inhalacja co 4 godziny.
Skurcz oskrzeli wywołany wysiłkiem fizycznym
Zazwyczaj stosowana dawka dla dorosłych i dzieci w wieku 4 lat lub starszych to dwie inhalacje na 15 do 30 minut przed wysiłkiem.
Informacje administracyjne
Podawać PROAIR HFA wyłącznie poprzez inhalację doustną. Dobrze wstrząśnij przed każdym rozpyleniem. Aby zapewnić prawidłowe użytkowanie tego produktu oraz zapobiec gromadzeniu się i blokowaniu leków, ważne jest dokładne przestrzeganie wskazówek dotyczących czyszczenia.
Podkładowy
Napełnić inhalator przed pierwszym użyciem oraz w przypadkach, gdy inhalator nie był używany przez ponad 2 tygodnie, wypuszczając trzy rozpylenia w powietrze, z dala od twarzy.
Czyszczenie
Podobnie jak w przypadku wszystkich inhalatorów albuterolowych zawierających HFA, aby utrzymać prawidłowe stosowanie tego produktu i zapobiec gromadzeniu się i blokowaniu leków, ważne jest regularne czyszczenie plastikowego ustnika. Inhalator może przestać podawać lek, jeśli plastikowy ustnik uruchamiający nie zostanie odpowiednio oczyszczony i wysuszony. Czyszczenie: Umyj plastikowy ustnik pod bieżącą ciepłą wodą przez 30 sekund, strząśnij nadmiar wody i przynajmniej raz w tygodniu dokładnie wysusz na powietrzu. Jeśli pacjent posiada więcej niż jeden inhalator PROAIR HFA, powinien umyć każdy z nich osobno, aby zapobiec przymocowaniu niewłaściwego pojemnika do niewłaściwego plastikowego siłownika. W ten sposób pacjent może mieć pewność, że zawsze zna prawidłową liczbę pozostałych dawek. Nigdy nie podłączaj pojemnika z lekiem z innego inhalatora do siłownika PROAIR HFA i nigdy nie podłączaj pojemnika z lekiem PROAIR HFA do siłownika innego inhalatora. Jeśli ustnik zostanie zablokowany, umycie ustnika usunie blokadę. Jeśli konieczne jest użycie inhalatora przed całkowitym wyschnięciem, strząsnąć nadmiar wody, wymienić pojemnik, rozpylić dwukrotnie w powietrze z dala od twarzy i przyjąć przepisaną dawkę. Po takim użyciu ustnik należy ponownie umyć i pozostawić do całkowitego wyschnięcia na powietrzu. [Widzieć Oznakowanie pacjenta zatwierdzone przez FDA ].
Licznik dawek
PROAIR HFA posiada licznik dawek przymocowany do siłownika. Gdy pacjent otrzyma inhalator, w okienku podglądu pojawi się czarna kropka, dopóki nie zostanie on napełniony 3 razy, po czym zostanie wyświetlony numer 200. Licznik dawek będzie odliczał za każdym razem, gdy zostanie uwolniony spray. Gdy licznik dawek osiągnie 20, kolor liczb zmieni się na czerwony, aby przypomnieć pacjentowi o skontaktowaniu się z farmaceutą w celu uzupełnienia leku lub skonsultowaniu się z lekarzem w celu uzupełnienia recepty.
Gdy licznik dawek osiągnie 0, tło zmieni się na stałe czerwone. Inhalator PROAIR HFA należy wyrzucić, gdy licznik dawek pokaże 0 lub po upływie daty ważności podanej na produkcie, w zależności od tego, co nastąpi wcześniej.
JAK DOSTARCZONE
Formy dawkowania i mocne strony
PROAIR HFA to aerozol inhalacyjny. PROAIR HFA jest dostarczany jako ciśnieniowy aluminiowy kanister 8,5 g/200 dawek z czerwonym plastikowym elementem uruchamiającym z licznikiem dawek i białą nasadką przeciwpyłową, każdy w pudełkach po jednym. Każde uruchomienie dostarcza 120 mcg siarczanu albuterolu z zaworu pojemnika i 108 mcg siarczanu albuterolu z ustnika urządzenia uruchamiającego (co odpowiada 90 mcg bazy albuterolu).
Przechowywanie i obsługa
PROAIR HFA (siarczan albuterolu) Aerozol do inhalacji jest dostarczany jako ciśnieniowy pojemnik aluminiowy z czerwonym plastikowym elementem uruchamiającym z licznikiem dawek i białą nasadką przeciwpyłową, każdy w pudełkach po jednym. Każdy kanister zawiera 8,5 g preparatu i zapewnia 200 dawek ( NDC 59310-579-22). Każde uruchomienie dostarcza 120 mcg siarczanu albuterolu z zaworu pojemnika i 108 mcg siarczanu albuterolu z ustnika urządzenia uruchamiającego (co odpowiada 90 mcg bazy albuterolu).
DOBRZE WSTRZĄSAĆ PRZED UŻYCIEM. Przechowywać w temperaturze od 15° do 25°C (59° i 77°F). Zawartość pod ciśnieniem. Nie przekłuwać ani nie spalać. Chronić przed mrozem i długotrwałym narażeniem na bezpośrednie działanie promieni słonecznych. Ekspozycja na temperatury powyżej 120°F może spowodować pęknięcie. Aby uzyskać najlepsze wyniki, pojemnik powinien mieć temperaturę pokojową przed użyciem. Unikaj rozpylania w oczach. Trzymać poza zasięgiem dzieci.
Widzieć Oznakowanie pacjenta zatwierdzone przez FDA do instrukcji gruntowania i czyszczenia.
Czerwonego siłownika dostarczanego z aerozolem do inhalacji PROAIR HFA nie należy używać z pojemnikiem z innymi produktami w aerozolu do inhalacji. Pojemnik z aerozolem do inhalacji PROAIR HFA nie powinien być używany z siłownikiem innych produktów w aerozolu do inhalacji.
Inhalator PROAIR HFA posiada licznik dawek przymocowany do siłownika. Pacjenci nie powinni nigdy próbować zmieniać numerów licznika dawek ani manipulować mechanizmem kołkowym wewnątrz siłownika. Wyrzucić inhalator PROAIR HFA, gdy licznik pokaże 0 lub po dacie ważności na produkcie, w zależności od tego, co nastąpi wcześniej. Oznaczona ilość leku w każdym uruchomieniu nie może być zapewniona po tym, jak licznik pokazuje 0, nawet jeśli pojemnik nie jest całkowicie pusty i będzie nadal działał. Nigdy nie zanurzaj kanistra w wodzie w celu określenia stopnia napełnienia kanistra („test pływaka”).
Aerozol do inhalacji PROAIR HFA nie zawiera chlorofluorowęglowodorów (CFC) jako gazu pędnego.
Kierowany przez: Teva Respiratory, LLC, Frazer, PA 19355. Kierowany przez: IVAX Pharmaceuticals Ireland Waterford, Irlandia. Aktualizacja: luty 2019 r.
SKUTKI UBOCZNE
Stosowanie PROAIR HFA może wiązać się z:
- Paradoksalny skurcz oskrzeli [patrz OSTRZEŻENIA I ŚRODKI ]
- Wpływ na układ sercowo-naczyniowy [patrz OSTRZEŻENIA I ŚRODKI ]
- Natychmiastowe reakcje nadwrażliwości [patrz OSTRZEŻENIA I ŚRODKI ]
- Hipokaliemia [patrz OSTRZEŻENIA I ŚRODKI ]
Doświadczenie w badaniach klinicznych
Podczas ogólnoświatowego programu rozwoju klinicznego łącznie 1090 pacjentów leczono aerozolem do inhalacji PROAIR HFA lub taką samą formułą albuterolu jak w aerozolu do inhalacji PROAIR HFA.
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
Dorośli i młodzież w wieku 12 lat i starsi
Informacje dotyczące działań niepożądanych przedstawione w poniższej tabeli dotyczące preparatu PROAIR HFA w aerozolu do inhalacji pochodzą z 6-tygodniowego, zaślepionego badania, w którym porównywano PROAIR HFA w aerozolu do inhalacji (180 mcg cztery razy na dobę) z podwójnie zaślepionym, dobranym placebo aerozolem do inhalacji HFA i wprowadzony do obrotu aktywny inhalator albuterolowy HFA-134a z zaślepioną oceną u 172 pacjentów z astmą w wieku od 12 do 76 lat. W tabeli wymieniono częstość występowania wszystkich zdarzeń niepożądanych (rozważanych przez badacza związanych z lekiem lub niezwiązanych z lekiem) z tego badania, które wystąpiły z częstością 3% lub większą w grupie leczonej preparatem PROAIR HFA w aerozolu do inhalacji i częściej w grupie leczonej preparatem PROAIR HFA Grupa leczona wziewnie aerozolem niż w dopasowanej grupie placebo. Ogólnie częstość występowania i charakter działań niepożądanych zgłoszonych dla preparatu PROAIR HFA w aerozolu do inhalacji i dostępnego na rynku aktywnego produktu porównawczego HFA-134a albuterol były porównywalne.
Zdarzenia niepożądane (% pacjentów) w sześciotygodniowym badaniu klinicznym*
Zdarzenia niepożądane zgłaszane przez mniej niż 3% pacjentów otrzymujących aerozol do inhalacji PROAIR HFA, ale przez większy odsetek pacjentów otrzymujących aerozol do inhalacji PROAIR HFA niż u pacjentów otrzymujących placebo, które mogą być związane z aerozolem do inhalacji PROAIR HFA, obejmowały ból w klatce piersiowej, infekcja, biegunka, zapalenie języka, przypadkowe uszkodzenie (układ nerwowy), lęk, duszność, zaburzenia ucha, ból ucha i infekcja dróg moczowych.
W badaniach z małą dawką skumulowaną drżenie, nerwowość i ból głowy były najczęściej występującymi zdarzeniami niepożądanymi.
Pacjenci pediatryczni w wieku od 4 do 11 lat
Zdarzenia niepożądane zgłoszone w 3-tygodniowym pediatrycznym badaniu klinicznym porównującym tę samą formułę albuterolu jak w PROAIR HFA w aerozolu do inhalacji (180 µg albuterolu cztery razy na dobę) z odpowiadającym placebo aerozolem do inhalacji HFA występowały z małą częstością (nie większą niż 2%). w grupie leczonej aktywnie) i były podobne do obserwowanych w badaniach z udziałem dorosłych i młodzieży.
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane po zatwierdzeniu produktu PROAIR HFA. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek. Zgłoszenia obejmowały rzadkie przypadki nasilenia skurczu oskrzeli, braku skuteczności, zaostrzenia astmy (w jednym przypadku zgonu), skurczów mięśni i różnych skutków ubocznych jamy ustnej i gardła, takich jak podrażnienie gardła, zaburzenia smaku, zapalenie języka, owrzodzenie języka i odruch wymiotny.
Następujące działania niepożądane obserwowano po zatwierdzeniu stosowania wziewnego albuterolu: pokrzywka, obrzęk naczynioruchowy, wysypka, skurcz oskrzeli, chrypka, obrzęk jamy ustnej i gardła oraz arytmie (w tym migotanie przedsionków, częstoskurcz nadkomorowy, skurcze dodatkowe). Ponadto albuterol, podobnie jak inne leki sympatykomimetyczne, może powodować działania niepożądane, takie jak: dusznica bolesna, nadciśnienie lub niedociśnienie, kołatanie serca, pobudzenie ośrodkowego układu nerwowego, bezsenność, ból głowy, nerwowość, drżenie, skurcze mięśni, wysuszenie lub podrażnienie części ustnej gardła, hipokaliemia, hiperglikemia i kwasica metaboliczna.
INTERAKCJE Z LEKAMI
Innych krótko działających sympatykomimetycznych leków rozszerzających oskrzela w aerozolu nie należy stosować jednocześnie z aerozolem do inhalacji PROAIR HFA. Jeśli dodatkowe leki adrenergiczne mają być podawane jakąkolwiek drogą, należy je stosować ostrożnie, aby uniknąć szkodliwego wpływu na układ sercowo-naczyniowy.
Beta-blokery
Środki blokujące receptory beta-adrenergiczne nie tylko blokują płucne działanie beta-agonistów, takich jak aerozol do inhalacji PROAIR HFA, ale mogą również wywoływać silny skurcz oskrzeli u pacjentów z astmą. Dlatego pacjenci z astmą zwykle nie powinni być leczeni beta-blokerami. Jednak w pewnych okolicznościach, np. jako profilaktyka po zawale mięśnia sercowego, może nie być akceptowalnych alternatyw dla stosowania leków blokujących receptory beta-adrenergiczne u pacjentów z astmą. W takim przypadku należy rozważyć kardioselektywne beta-adrenolityki, chociaż należy je podawać ostrożnie.
Diuretyki
Zmiany w zapisie EKG i (lub) hipokaliemia, które mogą wynikać z podawania leków moczopędnych nie oszczędzających potasu (takich jak diuretyki pętlowe lub tiazydowe), mogą być poważnie nasilone przez beta-agonistów, zwłaszcza po przekroczeniu zalecanej dawki beta-agonisty. Chociaż kliniczne znaczenie tych działań nie jest znane, zaleca się ostrożność przy jednoczesnym podawaniu beta-agonistów z lekami moczopędnymi nie oszczędzającymi potasu. Rozważ monitorowanie poziomu potasu.
Digoksyna
Średnie zmniejszenie stężenia digoksyny w surowicy o 16% i 22% wykazano odpowiednio po dożylnym i doustnym podaniu pojedynczej dawki albuterolu zdrowym ochotnikom, którzy otrzymywali digoksynę przez 10 dni. Kliniczne znaczenie tych wyników dla pacjentów z obturacyjną chorobą dróg oddechowych, którzy przewlekle otrzymują albuterol i digoksynę, jest niejasne. Niemniej jednak rozsądnie byłoby dokładnie ocenić poziom digoksyny w surowicy u pacjentów, którzy obecnie otrzymują digoksynę i aerozol do inhalacji PROAIR HFA.
Inhibitory monoaminooksydazy lub trójpierścieniowe leki przeciwdepresyjne
PROAIR HFA Aerozol wziewny należy podawać ze szczególną ostrożnością pacjentom leczonym inhibitorami monoaminooksydazy lub trójpierścieniowymi lekami przeciwdepresyjnymi lub w ciągu 2 tygodni po odstawieniu takich leków, ponieważ działanie albuterolu na układ sercowo-naczyniowy może ulec nasileniu. Rozważ alternatywną terapię u pacjentów przyjmujących inhibitory MAO lub trójpierścieniowe leki przeciwdepresyjne.
OSTRZEŻENIA
Zawarte jako część ŚRODKI OSTROŻNOŚCI Sekcja.
ŚRODKI OSTROŻNOŚCI
Paradoksalny skurcz oskrzeli
Aerozol do inhalacji PROAIR HFA może powodować paradoksalny skurcz oskrzeli, który może zagrażać życiu. W przypadku wystąpienia paradoksalnego skurczu oskrzeli należy natychmiast przerwać stosowanie preparatu PROAIR HFA w aerozolu do inhalacji i wdrożyć alternatywne leczenie. Należy zauważyć, że paradoksalny skurcz oskrzeli, związany z preparatami wziewnymi, często występuje przy pierwszym użyciu nowego pojemnika.
Pogorszenie astmy
Astma może ulec gwałtownemu pogorszeniu w ciągu kilku godzin lub przewlekle przez kilka dni lub dłużej. Jeśli pacjent potrzebuje większej niż zwykle dawki aerozolu do inhalacji PROAIR HFA, może to być markerem destabilizacji astmy i wymaga ponownej oceny pacjenta i schematu leczenia, ze szczególnym uwzględnieniem ewentualnej konieczności leczenia przeciwzapalnego, np.: kortykosteroidy.
Stosowanie środków przeciwzapalnych
Stosowanie samych agonistów receptorów beta-adrenergicznych rozszerzających oskrzela może nie być wystarczające do kontrolowania astmy u wielu pacjentów. Należy wcześnie rozważyć dodanie do schematu terapeutycznego środków przeciwzapalnych, np. kortykosteroidów.
Wpływ na układ sercowo-naczyniowy
Aerozol do inhalacji PROAIR HFA, podobnie jak inni agoniści receptorów beta-adrenergicznych, może wywoływać klinicznie istotne efekty sercowo-naczyniowe u niektórych pacjentów, mierzone na podstawie częstości tętna, ciśnienia krwi i/lub objawów. Chociaż takie działania są rzadkie po podaniu preparatu PROAIR HFA w aerozolu do inhalacji w zalecanych dawkach, jeśli wystąpią, może być konieczne odstawienie leku. Ponadto doniesiono, że beta-agoniści wywołują zmiany w EKG, takie jak spłaszczenie załamka T, wydłużenie odstępu QTc i obniżenie odcinka ST. Kliniczne znaczenie tych wyników nie jest znane. Dlatego PROAIR HFA w aerozolu do inhalacji, podobnie jak wszystkie aminy sympatykomimetyczne, należy stosować ostrożnie u pacjentów z zaburzeniami sercowo-naczyniowymi, zwłaszcza z niewydolnością wieńcową, zaburzeniami rytmu serca i nadciśnieniem.
Nie należy przekraczać zalecanej dawki
Zgony odnotowano w związku z nadmiernym stosowaniem wziewnych leków sympatykomimetycznych u pacjentów z astmą. Dokładna przyczyna zgonu jest nieznana, ale podejrzewa się zatrzymanie akcji serca w następstwie nieoczekiwanego rozwoju ostrego ostrego przełomu astmatycznego i następującej po nim hipoksji.
Natychmiastowe reakcje nadwrażliwości
Po podaniu siarczanu albuterolu mogą wystąpić natychmiastowe reakcje nadwrażliwości, czego dowodem są rzadkie przypadki pokrzywki, obrzęku naczynioruchowego, wysypki, skurczu oskrzeli, anafilaksji i obrzęku jamy ustnej i gardła. W ocenie klinicznej pacjentów, u których podczas stosowania preparatu PROAIR HFA w aerozolu do inhalacji wystąpiły natychmiastowe reakcje nadwrażliwości, należy wziąć pod uwagę możliwość wystąpienia nadwrażliwości.
Współistniejące warunki
Aerozol do inhalacji PROAIR HFA, podobnie jak wszystkie aminy sympatykomimetyczne, należy stosować ostrożnie u pacjentów z zaburzeniami sercowo-naczyniowymi, zwłaszcza niewydolnością wieńcową, zaburzeniami rytmu serca i nadciśnieniem; u pacjentów z drgawkami, nadczynnością tarczycy lub cukrzycą; oraz u pacjentów, którzy wyjątkowo reagują na aminy sympatykomimetyczne. U poszczególnych pacjentów zaobserwowano klinicznie istotne zmiany skurczowego i rozkurczowego ciśnienia krwi i można się spodziewać ich wystąpienia u niektórych pacjentów po zastosowaniu jakiegokolwiek beta-adrenergicznego leku rozszerzającego oskrzela. Istnieją doniesienia, że duże dawki dożylnego albuterolu zaostrzają istniejącą wcześniej cukrzycę i kwasicę ketonową.
Hipokaliemia
Podobnie jak w przypadku innych beta-agonistów, PROAIR HFA w aerozolu do inhalacji może u niektórych pacjentów wywoływać znaczną hipokaliemię, prawdopodobnie w wyniku przecieku wewnątrzkomórkowego, co może powodować niepożądane skutki sercowo-naczyniowe. Spadek jest zwykle przemijający, niewymagający suplementacji.
Informacje dotyczące poradnictwa dla pacjentów
Widzieć Oznakowanie pacjenta zatwierdzone przez FDA
Pacjenci powinni otrzymać następujące informacje:
Częstotliwość użycia
Działanie aerozolu do inhalacji PROAIR HFA powinno trwać od 4 do 6 godzin. Nie należy stosować aerozolu do inhalacji PROAIR HFA częściej niż jest to zalecane. Należy poinstruować pacjentów, aby nie zwiększali dawki ani częstości podawania dawek aerozolu do inhalacji PROAIR HFA bez konsultacji z lekarzem. Jeśli pacjenci uznają, że leczenie za pomocą aerozolu do inhalacji PROAIR HFA staje się mniej skuteczne w łagodzeniu objawów, objawy nasilają się i/lub muszą stosować produkt częściej niż zwykle, powinni natychmiast zwrócić się o pomoc lekarską.
Gruntowanie i czyszczenie
Podkładowy
Gruntowanie jest niezbędne, aby zapewnić odpowiednią zawartość albuterolu przy każdym uruchomieniu. Należy poinstruować pacjentów, aby przygotowali inhalator przed pierwszym użyciem oraz w przypadkach, gdy inhalator nie był używany przez ponad 2 tygodnie, wypuszczając trzy rozpylenia w powietrze, z dala od twarzy.
Czyszczenie
Aby zapewnić prawidłowe dawkowanie i zapobiec zablokowaniu otworu siłownika, należy poinstruować pacjentów, aby co najmniej raz w tygodniu myli ustnik z czerwonego plastiku i dokładnie suszyli. Należy poinstruować pacjentów, że jeśli mają więcej niż jeden inhalator PROAIR HFA, powinni myć każdy z nich oddzielnie, aby zapobiec przymocowaniu niewłaściwego pojemnika do niewłaściwego plastikowego siłownika. W ten sposób mogą być pewni, że zawsze będą znać prawidłową liczbę pozostałych dawek. Należy pouczyć pacjentów, aby nigdy nie podłączali pojemnika z lekiem z innego inhalatora do siłownika PROAIR HFA i nigdy nie podłączali pojemnika z lekiem PROAIR HFA do siłownika innego inhalatora. Pacjenci nie powinni wyjmować pojemnika z siłownika, chyba że podczas czyszczenia, ponieważ ponowne podłączenie może spowodować uwolnienie dawki w powietrze, a licznik dawki będzie odliczał za każdym razem, gdy zostanie uwolniony spray. Szczegółowe instrukcje dotyczące czyszczenia znajdują się w ilustrowanej ulotce informacyjnej dla pacjenta.
Licznik dawek
Należy poinformować pacjentów, że PROAIR HFA posiada licznik dawek podłączony do siłownika. Gdy pacjent otrzyma inhalator, w okienku podglądu pojawi się czarna kropka, dopóki nie zostanie on napełniony 3 razy, po czym zostanie wyświetlony numer 200. Licznik dawek będzie odliczał za każdym razem, gdy zostanie uwolniony spray. W oknie licznika dawek wyświetlana jest liczba rozpyleń pozostałych w inhalatorze w jednostkach po dwie (np. 200, 198, 196 itd.). Gdy licznik wyświetla 20, kolor liczb zmieni się na czerwony, aby przypomnieć pacjentowi o skontaktowaniu się z farmaceutą w celu uzupełnienia leku lub skonsultowaniu się z lekarzem w celu uzupełnienia recepty. Gdy licznik dawek osiągnie 0, tło zmieni się na stałe czerwone. Pacjentów należy poinformować o konieczności wyrzucenia inhalatora PROAIR HFA, gdy licznik dawek pokaże 0 lub po upływie daty ważności podanej na produkcie, w zależności od tego, co nastąpi wcześniej.
Paradoksalny skurcz oskrzeli
Należy poinformować pacjentów, że aerozol do inhalacji PROAIR HFA może powodować paradoksalny skurcz oskrzeli. Należy poinstruować pacjentów, aby w przypadku wystąpienia paradoksalnego skurczu oskrzeli przerwali stosowanie preparatu PROAIR HFA w aerozolu do inhalacji.
Jednoczesne zażywanie narkotyków
Podczas stosowania preparatu PROAIR HFA w aerozolu do inhalacji inne leki wziewne i leki na astmę należy przyjmować wyłącznie zgodnie z zaleceniami lekarza.
Częste zdarzenia niepożądane
Częstymi działaniami niepożądanymi leczenia wziewnym albuterolem są kołatanie serca, ból w klatce piersiowej, szybkie bicie serca, drżenie lub nerwowość.
Ciąża
Pacjentki w ciąży lub karmiące piersią powinny skontaktować się z lekarzem w sprawie stosowania aerozolu do inhalacji PROAIR HFA.
Istnieje rejestr ekspozycji w czasie ciąży, który monitoruje przebieg ciąży u kobiet narażonych na leki na astmę w czasie ciąży [patrz Używaj w określonych populacjach ].
Ogólne informacje dotyczące użytkowania
Skuteczne i bezpieczne stosowanie aerozolu do inhalacji PROAIR HFA obejmuje zrozumienie sposobu jego podawania.
Dobrze wstrząśnij przed każdym rozpyleniem.
Aerozol do inhalacji PROAIR HFA należy stosować wyłącznie z aktywatorem dostarczonym z produktem. Inhalator PROAIR HFA należy wyrzucić, gdy licznik dawek wyświetli 0 lub po dacie ważności na produkcie, w zależności od tego, co nastąpi wcześniej. Nigdy nie zanurzaj kanistra w wodzie w celu określenia stopnia napełnienia kanistra („test pływaka”).
Ogólnie technika podawania aerozolu do inhalacji PROAIR HFA dzieciom jest podobna do tej stosowanej u dorosłych. Dzieci powinny stosować aerozol do inhalacji PROAIR HFA pod nadzorem osoby dorosłej, zgodnie z zaleceniami lekarza pacjenta.
Oznakowanie pacjenta zatwierdzone przez FDA
Zobacz ilustrację odrywania Informacje dla Pacjenta ulotka.
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
2-letnim badaniu na szczurach Sprague-Dawley siarczan albuterolu powodował zależne od dawki zwiększenie częstości występowania łagodnych mięśniaków gładkokomórkowych mezowarium przy dawkach dietetycznych 2 mg/kg mc. dobowa dawka wziewna (MRHDID) odpowiednio dla dorosłych i dzieci, w mg/m²). W innym badaniu efekt ten był blokowany przez jednoczesne podawanie propranololu, nieselektywnego antagonisty beta-adrenergicznego. W 18-miesięcznym badaniu na myszach CD-1, siarczan albuterolu nie wykazał rakotwórczości w dawkach dietetycznych do 500 mg/kg (około 1900 razy i 740 razy więcej niż MRHDID dla dorosłych i dzieci, odpowiednio, w mg/m²). podstawa). W 22-miesięcznym badaniu na Golden Hamsters, siarczan albuterolu nie wykazał rakotwórczości przy dawkach dietetycznych do 50 mg/kg (około 250-krotność i 100-krotność MRHDID odpowiednio dla dorosłych i dzieci w przeliczeniu na mg/m²). .
Siarczan Albuterolu nie wykazywał działania mutagennego w teście Amesa ani w teście mutacji na drożdżach. Siarczan Albuterolu nie wykazywał działania klastogennego w teście na ludzkich limfocytach obwodowych ani w teście mikrojądrowym u myszy szczepu AH1.
Badania na szczurach dotyczące reprodukcji nie wykazały zaburzeń płodności po podaniu doustnych dawek do 50 mg/kg (około 380-krotność MRHDID dla dorosłych w przeliczeniu na mg/m²).
Używaj w określonych populacjach
Ciąża
Rejestr ekspozycji w ciąży
Istnieje rejestr narażenia na ciążę, który monitoruje przebieg ciąży u kobiet narażonych na leki na astmę w czasie ciąży. Aby uzyskać więcej informacji, skontaktuj się z Mothers To Baby Pregnancy Studies prowadzonym przez Organizację Specjalistów ds. Informacji Teratologicznych pod numerem 1-877-311-8972 lub odwiedź stronę http://mothertobaby.org/pregnancystudies/.
Podsumowanie ryzyka
Nie ma randomizowanych badań klinicznych dotyczących stosowania albuterolu w czasie ciąży. Dostępne dane z opublikowanych badań epidemiologicznych i opisy przypadków po wprowadzeniu do obrotu dotyczące wyników ciąży po zastosowaniu wziewnego albuterolu nie wskazują jednoznacznie na ryzyko poważnych wad wrodzonych lub poronienia. Istnieją względy kliniczne dotyczące stosowania albuterolu u kobiet w ciąży [patrz Rozważania kliniczne ]. W badaniach na zwierzętach dotyczących reprodukcji, gdy siarczan albuterolu podawano podskórnie ciężarnym myszom, stwierdzono rozszczep podniebienia w dawce mniejszej niż do 9-krotności maksymalnej zalecanej dziennej dawki wziewnej dla ludzi (MRHDID) [patrz Dane ].
Szacowane ryzyko tła poważnych wad wrodzonych i poronienia dla wskazanej populacji jest nieznane. W ogólnej populacji USA szacowane ryzyko poważnych wad wrodzonych i poronienia w klinicznie rozpoznanych ciążach wynosi odpowiednio 2 do 4% i 15 do 20%.
Rozważania kliniczne
Ryzyko związane z chorobą u matki i/lub zarodka/płodu
kobiet ze słabo lub umiarkowanie kontrolowaną astmą istnieje zwiększone ryzyko wystąpienia stanu przedrzucawkowego u matki i wcześniactwa, niskiej masy urodzeniowej i małego wieku ciążowego u noworodków. Kobiety w ciąży powinny być ściśle monitorowane iw razie potrzeby dostosowywane leki w celu utrzymania optymalnej kontroli.
Praca lub dostawa
Ze względu na możliwość wpływu beta-agonistów na kurczliwość macicy, stosowanie preparatu PROAIR HFA w aerozolu do inhalacji w celu złagodzenia skurczu oskrzeli podczas porodu należy ograniczyć do tych pacjentek, u których korzyści wyraźnie przewyższają ryzyko. Aerozol do inhalacji PROAIR HFA nie został zatwierdzony do leczenia porodów przedwczesnych. Ciężkie działania niepożądane, w tym obrzęk płuc, były zgłaszane podczas lub po leczeniu przedwczesnego porodu beta2-mimetykami, w tym albuterolem.
Dane
Dane zwierząt
badaniu dotyczącym reprodukcji na myszach, podskórnie podawany siarczan albuterolu powodował powstanie rozszczepu podniebienia u 5 ze 111 (4,5%) płodów przy ekspozycji dziewięć dziesiątych MRHDID dla dorosłych (w przeliczeniu na mg/m² przy dawce matczynej 0,25 mg/kg ) oraz u 10 ze 108 (9,3%) płodów przy około 9-krotności MRHDID (w przeliczeniu na mg/m² przy dawce dla matki wynoszącej 2,5 mg/kg). Podobnych efektów nie zaobserwowano przy około jednej jedenastej MRHDID dla dorosłych (w przeliczeniu na mg/m² przy dawce matczynej 0,025 mg/kg). Rozszczep podniebienia wystąpił również u 22 z 72 (30,5%) płodów kobiet leczonych podskórnie izoproterenolem (kontrola pozytywna).
W badaniu reprodukcji na królikach, doustnie podawany siarczan albuterolu wywoływał kranioschizę u 7 z 19 płodów (37%) przy około 750-krotności MRHDID (w przeliczeniu na mg/m² przy dawce matczynej 50 mg/kg).
badaniu rozrodczości szczurów preparat albuterolu siarczan/HFA-134a podawany przez inhalację nie wywoływał żadnego działania teratogennego przy ekspozycji około 80 razy większej niż MRHDID (w przeliczeniu na mg/m² przy dawce matczynej 10,5 mg/kg).
Badanie, w którym ciężarnym szczurom podawano znakowany radioaktywnie siarczan albuterolu, wykazało, że materiał związany z lekiem jest przenoszony z krążenia matki do płodu.
Laktacja
Podsumowanie ryzyka
Brak dostępnych danych dotyczących obecności albuterolu w mleku ludzkim, wpływu na dziecko karmione piersią lub wpływu na produkcję mleka. Jednak poziomy albuterolu w osoczu po wziewnych dawkach terapeutycznych są niskie u ludzi, a jeśli jest obecny w mleku matki, albuterol ma niską biodostępność doustną [patrz FARMAKOLOGIA KLINICZNA ].
Należy wziąć pod uwagę korzyści rozwojowe i zdrowotne wynikające z karmienia piersią, a także kliniczne zapotrzebowanie matki na albuterol i wszelkie potencjalne niekorzystne skutki albuterolu lub choroby matki u karmionego piersią dziecka.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność aerozolu do inhalacji PROAIR HFA w leczeniu lub profilaktyce skurczu oskrzeli u dzieci w wieku 12 lat i starszych z odwracalną obturacyjną chorobą dróg oddechowych są oparte na jednym 6-tygodniowym badaniu klinicznym z udziałem 116 pacjentów w wieku 12 lat i starszych z astmą porównującą dawki 180 mcg cztery razy dziennie z placebo oraz jedno badanie krzyżowe z pojedynczą dawką porównujące dawki 90, 180 i 270 mcg z placebo u 58 pacjentów [patrz Studia kliniczne ]. Bezpieczeństwo i skuteczność preparatu PROAIR HFA w aerozolu do inhalacji w leczeniu skurczu oskrzeli wywołanego wysiłkiem fizycznym u dzieci w wieku 12 lat i starszych opiera się na jednym badaniu krzyżowym z pojedynczą dawką u 24 dorosłych i młodzieży ze skurczem oskrzeli wywołanym wysiłkiem fizycznym, porównującym dawki 180 µg z placebo. [Widzieć Studia kliniczne ].
Bezpieczeństwo aerozolu do inhalacji PROAIR HFA u dzieci w wieku od 4 do 11 lat opiera się na jednym 3-tygodniowym badaniu klinicznym z udziałem 50 pacjentów w wieku od 4 do 11 lat z astmą, przy użyciu tej samej formuły albuterolu, co w aerozolu do inhalacji PROAIR HFA, porównując dawki 180 mcg cztery razy dziennie z placebo. Skuteczność aerozolu do inhalacji PROAIR HFA u dzieci w wieku od 4 do 11 lat została ekstrapolowana z badań klinicznych u pacjentów w wieku 12 lat i starszych z astmą i skurczem oskrzeli wywołanym wysiłkiem fizycznym, na podstawie danych z badania pojedynczej dawki porównującego działanie rozszerzające oskrzela PROAIR HFA 90 mcg i 180 mcg z placebo u 55 pacjentów z astmą oraz 3-tygodniowe badanie kliniczne z użyciem tej samej formuły albuterolu, co w PROAIR HFA w aerozolu do inhalacji u 95 dzieci chorych na astmę w wieku od 4 do 11 lat, porównując dawkę 180 mcg albuterolu cztery razy dziennie z placebo [patrz Studia kliniczne ].
Bezpieczeństwo i skuteczność aerozolu do inhalacji PROAIR HFA u dzieci w wieku poniżej 4 lat nie zostały ustalone.
Zastosowanie geriatryczne
Badania kliniczne preparatu PROAIR HFA w aerozolu do inhalacji nie obejmowały wystarczającej liczby pacjentów w wieku 65 lat i starszych, aby określić, czy reagują oni inaczej niż pacjenci młodsi. Inne zgłoszone doświadczenia kliniczne nie wykazały różnic w odpowiedziach pomiędzy pacjentami w podeszłym wieku i młodszymi. Ogólnie rzecz biorąc, dobór dawki u pacjentów w podeszłym wieku powinien być ostrożny, zwykle zaczynając od dolnej granicy zakresu dawkowania, co odzwierciedla większą częstość pogorszenia czynności wątroby, nerek lub serca oraz współistniejących chorób lub innych leków [patrz OSTRZEŻENIA I ŚRODKI ].
Wiadomo, że wszyscy agoniści receptorów beta2-adrenergicznych, w tym albuterol, są w znacznym stopniu wydalane przez nerki, a ryzyko wystąpienia reakcji toksycznych może być większe u pacjentów z zaburzeniami czynności nerek. Ponieważ u pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo upośledzenia czynności nerek, należy zachować ostrożność przy doborze dawki i może być przydatne monitorowanie czynności nerek.
PRZEDAWKOWAĆ
Oczekiwane objawy przedawkowania to objawy nadmiernej stymulacji betaadrenergicznej i/lub wystąpienie lub nasilenie któregokolwiek z objawów wymienionych w sekcji DZIAŁANIA NIEPOŻĄDANE, np. drgawki, dusznica bolesna, nadciśnienie lub niedociśnienie, tachykardia z częstością do 200 uderzeń na minutę, zaburzenia rytmu serca, nerwowość , ból głowy, drżenie, suchość w ustach, kołatanie serca, nudności, zawroty głowy, zmęczenie, złe samopoczucie i bezsenność.
Może również wystąpić hipokaliemia. Podobnie jak w przypadku wszystkich leków sympatykomimetycznych, zatrzymanie akcji serca, a nawet śmierć mogą być związane z nadużywaniem aerozolu do inhalacji PROAIR HFA.
Leczenie polega na odstawieniu preparatu PROAIR HFA w aerozolu do inhalacji wraz z odpowiednią terapią objawową. Można rozważyć rozważne zastosowanie kardioselektywnego beta-blokera receptorów beta, pamiętając, że taki lek może wywołać skurcz oskrzeli. Nie ma wystarczających dowodów, aby określić, czy dializa jest korzystna w przypadku przedawkowania preparatu PROAIR HFA w aerozolu do inhalacji.
Średnia doustna śmiertelna dawka siarczanu albuterolu u myszy jest większa niż 2000 mg/kg (około 6800-krotność maksymalnej zalecanej dziennej dawki wziewnej dla dorosłych w mg/m2 i około 3200-krotność maksymalnej zalecanej dziennej dawki inhalacyjnej dla dzieci na mg/m2 /m² podstawy). U dojrzałych szczurów, podskórna mediana śmiertelnej dawki siarczanu albuterolu wynosi około 450 mg/kg (około 3000-krotność maksymalnej zalecanej dawki dobowej dla dorosłych w przeliczeniu na mg/m2 i około 1400-krotność maksymalnej zalecanej dziennej dawki inhalacyjnej dla dzieci na mg/m² podstawy). U młodych szczurów średnia podskórna dawka śmiertelna wynosi około 2000 mg/kg (około 14 000 razy większa niż maksymalna zalecana dobowa dawka wziewna dla dorosłych na mg/m² i około 6400 razy większa niż maksymalna zalecana dobowa dawka wziewna dla dzieci na mg/m² podstawa). Mediana inhalacyjnej dawki śmiertelnej nie została określona u zwierząt.
PRZECIWWSKAZANIA
Aerozol do inhalacji PROAIR HFA jest przeciwwskazany u pacjentów z nadwrażliwością na albuterol i inne składniki aerozolu do inhalacji PROAIR HFA. Rzadkie przypadki reakcji nadwrażliwości, w tym pokrzywki, obrzęku naczynioruchowego i wysypki zgłaszano po zastosowaniu siarczanu albuterolu [patrz OSTRZEŻENIA I ŚRODKI ].
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Siarczan Albuterolu jest agonistą receptorów beta2-adrenergicznych. Farmakologiczne działanie siarczanu albuterolu można przypisać aktywacji receptorów beta2-adrenergicznych na mięśniach gładkich dróg oddechowych. Aktywacja receptorów beta2-adrenergicznych prowadzi do aktywacji adenylocyklazy i wzrostu wewnątrzkomórkowego stężenia cyklicznego 3',5'-adenozynomonofosforanu (cyklicznego AMP). Ten wzrost cyklicznego AMP jest związany z aktywacją kinazy białkowej A, która z kolei hamuje fosforylację miozyny i obniża wewnątrzkomórkowe stężenie jonowego wapnia, powodując rozluźnienie mięśni. Albuterol rozluźnia mięśnie gładkie wszystkich dróg oddechowych, od tchawicy do końcowych oskrzelików. Albuterol działa jako funkcjonalny antagonista rozluźniający drogi oddechowe niezależnie od zaangażowanego spazmogenu, chroniąc w ten sposób przed wszystkimi wyzwaniami związanymi ze zwężeniem oskrzeli. Zwiększone stężenia cyklicznego AMP są również związane z hamowaniem uwalniania mediatorów z komórek tucznych w drogach oddechowych. Chociaż wiadomo, że receptory beta2-adrenergiczne są dominującymi receptorami na mięśniach gładkich oskrzeli, dane wskazują, że w ludzkim sercu znajdują się beta-receptory, z których 10% do 50% stanowią sercowe receptory beta2-adrenergiczne. Dokładna funkcja tych receptorów nie została ustalona [patrz OSTRZEŻENIA I ŚRODKI ].
większości kontrolowanych badań klinicznych wykazano, że albuterol ma większy wpływ na drogi oddechowe w postaci zwiotczenia mięśni gładkich oskrzeli niż izoproterenol w porównywalnych dawkach, przy jednoczesnym mniejszym działaniu sercowo-naczyniowym. Jednak wziewny albuterol, podobnie jak inne leki będące agonistami receptorów beta-adrenergicznych, może wywoływać u niektórych pacjentów znaczące działanie sercowo-naczyniowe, mierzone za pomocą częstości tętna, ciśnienia krwi, objawów i/lub zmian elektrokardiograficznych [patrz OSTRZEŻENIA I ŚRODKI ].
Farmakokinetyka
Ogólnoustrojowe poziomy albuterolu są niskie po inhalacji zalecanych dawek. W badaniu krzyżowym przeprowadzonym na zdrowych ochotnikach płci męskiej i żeńskiej wysokie skumulowane dawki preparatu PROAIR HFA w aerozolu do inhalacji (1080 mcg zasady albuterolu podawane w ciągu jednej godziny) osiągnęły średnie maksymalne stężenie w osoczu (Cmax) i ekspozycję ogólnoustrojową (AUCinf) wynoszące około 4100 pg/ ml i 28 426 pg/ml*h, odpowiednio w porównaniu z około 3900 pg/ml i 28 395 pg/ml*h, odpowiednio po tej samej dawce aktywnego leku porównawczego albuterolu HFA-134a. Końcowy okres półtrwania albuterolu w osoczu dostarczanego przez PROAIR HFA w aerozolu do inhalacji wynosił około 6 godzin. Porównanie parametrów farmakokinetycznych nie wykazało różnic pomiędzy produktami.
Profil farmakokinetyczny preparatu PROAIR HFA w aerozolu do inhalacji oceniano w dwukierunkowym badaniu krzyżowym z udziałem 11 zdrowych ochotników pediatrycznych w wieku od 4 do 11 lat. Po podaniu pojedynczej dawki preparatu PROAIR HFA w aerozolu do inhalacji (180 µg zasady albuterolu) uzyskano średnie wartości najmniejszych kwadratów (SE) Cmax i AUC0-∞ wynoszące odpowiednio 1100 (1,18) pg/ml i 5120 (1,15) pg/ml*h. Najmniejszy średni (SE) końcowy okres półtrwania w osoczu albuterolu dostarczanego przez PROAIR HFA w aerozolu do inhalacji wynosił 166 (7,8) minut.
Metabolizm i eliminacja
Informacje dostępne w opublikowanej literaturze sugerują, że głównym enzymem odpowiedzialnym za metabolizm albuterolu u ludzi jest SULTIA3 (sulfotransferaza). Gdy racemiczny albuterol podawano dożylnie lub wziewnie po doustnym podaniu węgla drzewnego, wystąpiła 3 do 4-krotna różnica w polu pod krzywymi stężenie-czas pomiędzy enancjomerami (R) i (S) albuterolu, przy czym (S stężenia )-albuterolu były konsekwentnie wyższe. Jednak bez wstępnego leczenia węglem drzewnym, po podaniu doustnym lub wziewnym, różnice były 8 do 24-krotne, co sugeruje, że (R)-albuterol jest preferencyjnie metabolizowany w przewodzie pokarmowym, prawdopodobnie przez SULTIA3.
Główną drogą eliminacji albuterolu jest wydalanie przez nerki (80% do 100%) związku macierzystego lub głównego metabolitu. Mniej niż 20% leku wykrywa się w kale. Po dożylnym podaniu racemicznego albuterolu, od 25% do 46% frakcji (R)-albuterolu dawki było wydalane w postaci niezmienionej (R)-albuterolu z moczem.
Osoby geriatryczne, pediatryczne, zaburzenia wątroby/nerki
Nie przeprowadzono badań farmakokinetyki preparatu PROAIR HFA w aerozolu do inhalacji u noworodków lub osób w podeszłym wieku.
Nie oceniano wpływu zaburzeń czynności wątroby na farmakokinetykę preparatu PROAIR HFA w aerozolu do inhalacji.
Wpływ zaburzeń czynności nerek na farmakokinetykę albuterolu oceniano u 5 pacjentów z klirensem kreatyniny od 7 do 53 ml/min, a wyniki porównano z wynikami zdrowych ochotników. Choroba nerek nie miała wpływu na okres półtrwania, ale nastąpił 67% spadek klirensu albuterolu. Należy zachować ostrożność podczas podawania dużych dawek preparatu PROAIR HFA aerozol do inhalacji pacjentom z zaburzeniami czynności nerek [patrz Używaj w określonych populacjach ].
Toksykologia i/lub farmakologia zwierząt
Przedkliniczne
Badania dożylne na szczurach z siarczanem albuterolu wykazały, że albuterol przenika przez barierę krew-mózg i osiąga stężenia w mózgu wynoszące około 5% stężeń w osoczu. W strukturach poza barierą krew-mózg (szyszynka i przysadka mózgowa) stężenie albuterolu było 100 razy większe niż w całym mózgu.
Badania na zwierzętach laboratoryjnych (świnki miniaturowe, gryzonie i psy) wykazały występowanie arytmii serca i nagłej śmierci (z histologicznymi dowodami martwicy mięśnia sercowego) w przypadku jednoczesnego podawania beta-agonistów i metyloksantyn. Kliniczne znaczenie tych wyników nie jest znane.
Propelent HFA-134a jest pozbawiony aktywności farmakologicznej, z wyjątkiem bardzo dużych dawek u zwierząt (380-1300-krotność maksymalnej ekspozycji u ludzi na podstawie porównania wartości AUC), wywołując głównie ataksję, drżenie, duszność lub ślinienie. Są one podobne do efektów wytwarzanych przez strukturalnie pokrewne chlorofluorowęglowodory (CFC), które są szeroko stosowane w inhalatorach z dozownikiem.
zwierząt i ludzi stwierdzono, że propelent HFA-134a jest szybko wchłaniany i szybko eliminowany, z okresem półtrwania eliminacji wynoszącym 3-27 minut u zwierząt i 5-7 minut u ludzi. Czas do maksymalnego stężenia w osoczu (Tmax) i średni czas przebywania są niezwykle krótkie, co prowadzi do przejściowego pojawienia się HFA-134a we krwi bez dowodów na akumulację.
Studia kliniczne
Skurcz oskrzeli związany z astmą
Pacjenci dorośli i młodzież w wieku 12 lat i starsi
W 6-tygodniowym, randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniu, PROAIR HFA Inhalation Aerosol (58 pacjentów) porównano z dopasowanym placebo HFA aerozol inhalacyjny (58 pacjentów) u pacjentów z astmą w wieku od 12 do 76 lat w dawce 180 mcg albuterolu cztery razy dziennie. Do badania włączono ramię z aktywnym komparatorem HFA-134a z inhalatorem albuterolowym HFA-134a (56 pacjentów).
Seryjne pomiary FEV1, pokazane poniżej jako zmiana procentowa w stosunku do wartości wyjściowych w dniu badania w 1. i 43. dniu, wykazały, że dwie inhalacje aerozolu do inhalacji PROAIR HFA spowodowały znacznie większą poprawę FEV1 w porównaniu z wartością sprzed leczenia niż w przypadku dopasowanego placebo, a także porównywalny efekt rozszerzający oskrzela z dostępnym na rynku aktywnym komparatorem HFA-134a albuterolem.
FEV1 jako średnia procentowa zmiana od dawki przed podaniem w dniu badania w 6-tygodniowym dniu badania klinicznego
INFORMACJA O PACJENCIE
PROAIR® HFA (pro'ar) (siarczan albuterolu) Wdychanie Aerozol
Przeczytaj tę Informację dla pacjenta przed rozpoczęciem stosowania PROAIR HFA i za każdym razem, gdy otrzymasz wkład. Mogą pojawić się nowe informacje. Informacje te nie zastępują rozmowy z lekarzem na temat stanu zdrowia lub leczenia.
Co to jest PROAIR HFA?
PROAIR HFA to lek na receptę stosowany u osób w wieku 4 lat i starszych w celu:
- leczyć lub zapobiegać skurczowi oskrzeli u osób z odwracalną obturacyjną chorobą dróg oddechowych
- zapobiegać skurczowi oskrzeli wywołanemu wysiłkiem fizycznym
Nie wiadomo, czy PROAIR HFA jest bezpieczny i skuteczny u dzieci poniżej 4 roku życia.
Kto nie powinien stosować PROAIR HFA?
Nie używaj PROAIR HFA, jeśli: jesteś uczulony na siarczan albuterolu lub którykolwiek ze składników PROAIR HFA. Pełna lista składników preparatu PROAIR HFA znajduje się na końcu tej ulotki.
O czym powinienem powiedzieć lekarzowi przed zastosowaniem PROAIR HFA?
Przed zastosowaniem PROAIR HFA należy poinformować lekarza, jeśli:
- masz problemy z sercem
- mieć wysokie ciśnienie krwi (nadciśnienie)
- mieć konwulsje (drgawki)
- masz problemy z tarczycą
- mieć cukrzycę
- masz niski poziom potasu we krwi
- są w ciąży lub planują zajść w ciążę. Nie wiadomo, czy PROAIR HFA zaszkodzi nienarodzonemu dziecku. Porozmawiaj z lekarzem, jeśli jesteś w ciąży lub planujesz zajść w ciążę.
- karmisz piersią lub planujesz karmić piersią. Nie wiadomo, czy PROAIR HFA przenika do mleka matki. Porozmawiaj z lekarzem o najlepszym sposobie karmienia dziecka, jeśli stosujesz PROAIR HFA.
Poinformuj lekarza o wszystkich przyjmowanych lekach, tym leki na receptę i bez recepty, witaminy i suplementy ziołowe.
PROAIR HFA i inne leki mogą wzajemnie na siebie oddziaływać i powodować działania niepożądane. PROAIR HFA może wpływać na działanie innych leków, a inne leki mogą wpływać na działanie PROAIR HFA.
Szczególnie powiedz swojemu lekarzowi, jeśli przyjmujesz:
- inne leki wziewne lub leki na astmę
- leki beta-blokerowe
- diuretyki
- digoksyna
- inhibitory monoaminooksydazy
- trójpierścieniowe leki przeciwdepresyjne
W razie wątpliwości należy zapytać lekarza lub farmaceutę o listę tych leków.
Poznaj leki, które przyjmujesz. Zachowaj ich listę, aby pokazać lekarzowi i farmaceucie, gdy otrzymasz nowy lek.
Jak stosować PROAIR HFA?
- Aby uzyskać szczegółowe instrukcje, zobacz "Instrukcja użycia" na końcu niniejszych Informacji dla Pacjenta.
- Stosuj PROAIR HFA zgodnie z zaleceniami lekarza.
- Jeśli Twoje dziecko musi stosować PROAIR HFA, uważnie obserwuj je, aby upewnić się, że dziecko używa inhalatora prawidłowo. Lekarz pokaże, jak dziecko powinno stosować PROAIR HFA.
- Każda dawka PROAIR HFA powinna trwać od 4 godzin do 6 godzin.
- Nie rób zwiększyć dawkę lub przyjąć dodatkowe dawki PROAIR HFA bez uprzedniej konsultacji z lekarzem.
- Natychmiast uzyskaj pomoc medyczną, jeśli PROAIR HFA nie pomaga już w objawach.
- Natychmiast uzyskaj pomoc medyczną, jeśli objawy się pogorszą lub jeśli musisz częściej używać inhalatora.
- Podczas stosowania leku PROAIR HFA nie należy stosować innych wziewnych leków doraźnych ani leków na astmę, chyba że tak zaleci lekarz.
- Zadzwoń do lekarza, jeśli objawy astmy, takie jak świszczący oddech i problemy z oddychaniem, pogorszą się w ciągu kilku godzin lub dni. Lekarz może zalecić podanie innego leku (na przykład kortykosteroidów) w celu leczenia objawów.
Jakie są możliwe skutki uboczne PROAIR HFA?
PROAIR HFA może powodować poważne skutki uboczne, w tym:
- nasilenie problemów z oddychaniem, kaszel i świszczący oddech (paradoksalny skurcz oskrzeli). takim przypadku należy zaprzestać stosowania PROAIR HFA i natychmiast skontaktować się z lekarzem lub uzyskać pomoc w nagłych wypadkach. Paradoksalny skurcz oskrzeli jest bardziej prawdopodobny po pierwszym użyciu nowego pojemnika z lekiem.
- problemy z sercem, w tym szybsze tętno i wyższe ciśnienie krwi
- możliwy zgon u osób z astmą, które stosują zbyt dużo PROAIR HFA
- reakcje alergiczne. Natychmiast skontaktuj się z lekarzem, jeśli wystąpią następujące objawy reakcji alergicznej:
- swędząca skóra
- obrzęk pod skórą lub w gardle
- wysypka
- nasilające się problemy z oddychaniem
- niski poziom potasu we krwi
- pogorszenie innych problemów zdrowotnych u osób, które również stosują PROAIR HFA, w tym wzrost poziomu cukru we krwi
Do najczęstszych skutków ubocznych PROAIR HFA należą:
- czujesz, że serce wali lub wali (palpitacje)
- ból w klatce piersiowej
- szybkie tętno
- drżenie
- nerwowość
- ból głowy
- zawroty głowy
- ból gardła
- katar
Należy poinformować lekarza, jeśli wystąpią jakiekolwiek objawy niepożądane, które Cię niepokoją lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne stosowania PROAIR HFA. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Jak przechowywać PROAIR HFA?
- Przechowywać PROAIR HFA w temperaturze pokojowej od 15 ° C do 25 ° C od 59 ° F do 77 ° F.
- Unikaj narażenia na ekstremalne ciepło i zimno.
- Przed użyciem mocno wstrząsnąć pojemnikiem PROAIR HFA.
- Nie rób przebić kanister PROAIR HFA.
- Nie rób przechowywać kanister PROAIR HFA w pobliżu źródeł ciepła lub płomieni. Temperatury powyżej 120 ° F mogą spowodować pęknięcie kanistra.
- Nie rób wrzuć kanister PROAIR HFA do ognia lub spalarni.
- Unikaj rozpylania PROAIR HFA na oczy.
PROAIR HFA i wszystkie leki należy przechowywać w miejscu niedostępnym dla dzieci.
Ogólne informacje o bezpiecznym i efektywnym stosowaniu PROAIR HFA
Leki są czasami przepisywane do celów innych niż wymienione w Przewodniku po lekach. Nie należy stosować PROAIR HFA w stanach, na które nie został przepisany. Nie podawaj PROAIR HFA innym osobom, nawet jeśli mają takie same objawy jak Ty. Może im to zaszkodzić.
Niniejsza Informacja dla Pacjenta podsumowuje najważniejsze informacje o PROAIR HFA. Jeśli chcesz uzyskać więcej informacji, porozmawiaj ze swoim lekarzem. Możesz poprosić farmaceutę lub lekarza o informacje na temat PROAIR HFA, które są przeznaczone dla pracowników służby zdrowia.
Aby uzyskać więcej informacji, odwiedź stronę www.ProAirHFA.com lub zadzwoń pod numer 1-888-482-9522.
Jakie są składniki PROAIR HFA?
Składnik aktywny: siarczan albuterolu
Składniki nieaktywne: propelent HFA-134a i etanol.
Instrukcja użycia
PROAIR® HFA (pro'ar) (siarczan albuterolu) Wdychanie Aerozol
Przeczytaj tę instrukcję użytkowania przed rozpoczęciem stosowania PROAIR HFA i za każdym razem, gdy otrzymasz wkład. Mogą pojawić się nowe informacje. Informacje te nie zastępują rozmowy z lekarzem na temat stanu zdrowia lub leczenia.
Części inhalatora PROAIR HFA:
Istnieją 2 główne części inhalatora PROAIR HFA, w tym:
- czerwony plastikowy siłownik, który rozpyla lek z kanistra. Zobacz rysunek A.
- ochronna osłona przeciwpyłowa, która zakrywa ustnik siłownika. Zobacz rysunek A.
Istnieje również metalowy pojemnik, w którym znajduje się lek. Zobacz rysunek A.
Z tyłu siłownika znajduje się również licznik dawek z okienkiem, które pokazuje, ile rozpyleń leku pozostało. Zobacz rysunek B.
Zobaczysz czarną kropkę w okienku kontrolnym na siłowniku, dopóki urządzenie nie zostanie trzykrotnie uzbrojone. Patrz rysunek B i „Przygotowanie urządzenia PROAIR HFA” poniżej.
Rysunek A i Rysunek B 
- Nie rób używać siłownika PROAIR HFA z pojemnikiem z lekiem z dowolnego innego inhalatora.
- Nie rób używać kanistra PROAIR HFA z aktywatorem z dowolnego innego inhalatora, w tym z innego inhalatora PROAIR HFA.
Przygotowanie urządzenia PROAIR HFA:
Urządzenie PROAIR musi zostać zagruntowane przed użyciem go po raz pierwszy lub jeśli urządzenie nie było używane przez ponad 14 dni z rzędu. Nie rób codziennie uzdatniaj swoje urządzenie PROAIR HFA.
- Wyjmij urządzenie PROAIR HFA z opakowania.
- Zdejmij nasadkę ochronną z ustnika.
- Dobrze wstrząśnij inhalatorem i rozpyl go w powietrzu z dala od twarzy. Zobacz rysunek C.
Rysunek C 
- Wstrząsnąć i spryskać inhalator w ten sposób jeszcze 2 razy, aby zakończyć jego przygotowanie. Licznik dawki na siłowniku powinien wyświetlać liczbę 200 po pierwszym zalaniu siłownika. Zobacz rysunek D.
Rysunek D 
Za każdym razem, gdy używasz urządzenia PROAIR HFA:
- Upewnij się, że pojemnik jest dobrze dopasowany do plastikowego siłownika.
- Zajrzeć do ustnika, aby upewnić się, że nie ma w nim ciał obcych, zwłaszcza jeśli nasadka nie została użyta do zakrycia ustnika.
Odczytywanie licznika dawek na siłowniku PROAIR HFA
- Licznik dawek będzie odliczał za każdym razem, gdy zostanie uwolniony spray. W okienku licznika dawek wyświetlana jest liczba rozpyleń pozostałych w inhalatorze w jednostkach po 2 rozpylenia. Na przykład pozostało 190 rozpyleń, jeśli strzałka znajduje się dokładnie naprzeciwko liczby 190, lub 189 rozpyleń, jeśli strzałka wskazuje od 190 do 188. Patrz rysunek D.
- Gdy licznik dawek osiągnie 0, będzie nadal wskazywał 0 i należy wymienić urządzenie PROAIR HFA.
- Licznika dawek nie można zresetować i jest on na stałe połączony z aktywatorem. Nigdy nie zmieniaj cyfr licznika dawek ani nie dotykaj kołka wewnątrz siłownika.
- Nie rób wyjąć pojemnik z plastikowego siłownika, chyba że podczas czyszczenia. Ponowne przymocowanie pojemnika do siłownika może przypadkowo uwolnić dawkę PROAIR HFA do powietrza. Licznik dawek będzie odliczał za każdym razem, gdy zostanie uwolniony spray.
Korzystanie z urządzenia PROAIR HFA:
Krok 1. Dobrze wstrząśnij inhalatorem przed każdym sprayem. Zdjąć nasadkę z ustnika siłownika.
Krok 2. Trzymaj inhalator ustnikiem w dół. Zobacz rysunek E.
Rysunek E 
Krok 3. Wydychaj przez usta i wypchnij jak najwięcej powietrza z płuc. Włóż ustnik do ust i zaciśnij wokół niego usta. Zobacz rysunek F.
Krok 4. Wciśnij górną część pojemnika do samego dołu, wykonując głęboki i powolny wdech przez usta. Zobacz rysunek F.
Rysunek F 
Krok 5. Zaraz po wypłynięciu sprayu zdejmij palec z pojemnika. Po całkowitym wdechu wyjąć inhalator z ust i zamknąć usta.
Krok 6. Wstrzymaj oddech tak długo, jak możesz, do 10 sekund, a następnie oddychaj normalnie.
Jeśli lekarz zalecił stosowanie większej ilości aerozoli, odczekać 1 minutę i ponownie wstrząsnąć inhalatorem. Powtórz kroki od 2 do 6.
Krok 7. Po każdym użyciu inhalatora załóż z powrotem nasadkę na ustnik. Upewnij się, że nasadka mocno zatrzasnęła się na swoim miejscu.
Czyszczenie urządzenia PROAIR HFA:
Bardzo ważne jest utrzymywanie plastikowego siłownika w czystości, aby lek nie gromadził się i nie blokował rozprysku. Zobacz rysunek G i rysunek H.
Rysunek G i Rysunek H 
- Nie próbuj czyścić metalowego kanistra ani nie dopuszczać do jego zamoczenia. Inhalator może przestać rozpylać, jeśli nie zostanie prawidłowo wyczyszczony.
- przypadku posiadania więcej niż 1 inhalatora PROAIR HFA, należy myć każde urządzenie w oddzielnych momentach, aby zapobiec połączeniu niewłaściwego pojemnika z niewłaściwym plastikowym aktywatorem. W ten sposób możesz mieć pewność, że zawsze będziesz znać prawidłową liczbę pozostałych dawek PROAIR HFA.
- Umyj siłownik przynajmniej 1 raz w tygodniu w następujący sposób:
- Wyjmij pojemnik z siłownika i zdejmij nasadkę z ustnika.
- Trzymaj siłownik pod kranem i przepuszczaj przez niego ciepłą wodę przez około 30 sekund. Zobacz rysunek I.
Rysunek I 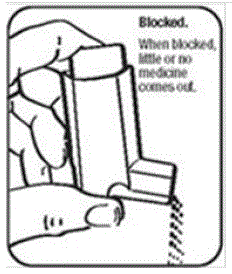
- Odwrócić siłownik do góry nogami i przepuszczać przez ustnik ciepłą wodę przez około 30 sekund. Zobacz rysunek J.
Rysunek J 
- Strząsnąć jak najwięcej wody z siłownika. Zajrzeć do ustnika, aby upewnić się, że nagromadzony lek został całkowicie wypłukany. W przypadku nagromadzenia należy powtórzyć instrukcje prania.
- Pozwól siłownikowi całkowicie wyschnąć na powietrzu, np. przez noc. Zobacz rysunek K.
Rysunek K 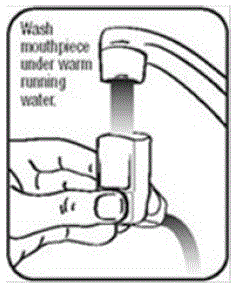
- Gdy siłownik jest suchy, włóż pojemnik do siłownika i upewnij się, że jest dobrze dopasowany. Dobrze wstrząśnij inhalatorem i dwukrotnie rozpyl go w powietrzu z dala od twarzy. Załóż z powrotem nasadkę na ustnik.
Jeśli musisz użyć inhalatora przed całkowitym wyschnięciem siłownika:
- Strząsnąć jak najwięcej wody z siłownika.
- Umieść pojemnik w siłowniku i upewnij się, że jest dobrze dopasowany.
- Dobrze wstrząśnij inhalatorem i dwukrotnie rozpyl go w powietrzu z dala od twarzy.
- Przyjmuj dawkę PROAIR HFA zgodnie z zaleceniami.
- Postępuj zgodnie z powyższymi instrukcjami czyszczenia.
Wymiana urządzenia PROAIR HFA
- Gdy licznik dawki na siłowniku wskaże liczbę 20, kolor liczb zmieni się na czerwony. Czerwone cyfry mają przypominać o konieczności uzupełnienia recepty lub poprosić lekarza o kolejną receptę na PROAIR HFA. Gdy licznik dawek osiągnie 0, kolor tła zmieni się na stały czerwony.
- Wyrzuć inhalator PROAIR HFA jak tylko licznik dawek wskaże 0 lub po dacie ważności na opakowaniu PROAIR HFA, w zależności od tego, co nastąpi wcześniej. Nie należy używać inhalatora po 200 rozpyleniach, nawet jeśli pojemnik może nie być całkowicie pusty. Nie możesz być pewien, że po 200 rozpyleniach otrzymasz jakikolwiek lek.
- Nie używać inhalatora po upływie terminu ważności na opakowaniu PROAIR HFA.
Niniejsze informacje dla pacjenta i instrukcje użytkowania zostały zatwierdzone przez amerykańską Agencję ds. Żywności i Leków.
