Singulair 10mg, 4mg, 5mg Montelukast Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Singulair i jak się go stosuje?
Singulair 5 mg to lek na receptę stosowany w leczeniu objawów astmy, wywołanego wysiłkiem skurczu oskrzeli oraz alergicznego lub całorocznego (całorocznego) nieżytu nosa. Singulair można stosować samodzielnie lub z innymi lekami.
- Singulair należy do klasy leków zwanych antagonistami receptora leukotrienowego.
- Nie wiadomo, czy Singulair jest bezpieczny i skuteczny u dzieci w wieku poniżej 1 roku.
Jakie są możliwe skutki uboczne Singulair?
Singulair może powodować poważne działania niepożądane, w tym:
- nietypowe zmiany nastroju lub zachowania,
- wysypka na skórze,
- siniaki,
- silne mrowienie,
- drętwienie,
- ból,
- słabe mięśnie,
- ból ucha,
- obrzęk,
- ciepło,
- gorączka,
- ból gardła,
- obrzęk twarzy lub języka,
- pieczenie w twoich oczach i
- ból skóry, po którym następuje czerwona lub fioletowa wysypka, która rozprzestrzenia się na górną część ciała i powoduje powstawanie pęcherzy i łuszczenie
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze działania niepożądane Singulair to:
- ból brzucha,
- biegunka,
- gorączka,
- Objawy grypy,
- objawy przeziębienia (zatkany nos, ból zatok, kaszel, ból gardła),
- ból głowy i
- moczenie nocne lub utrata kontroli pęcherza u dzieci
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne stosowania Singulair. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OPIS
Montelukast sodu, substancja czynna leku SINGULAIR 4 mg, jest selektywnym i doustnym aktywnym antagonistą receptora leukotrienowego, który hamuje receptor leukotrienów cysteinylowych CysLT1.
Montelukast sodu jest chemicznie opisany jako [R-(E)]-1-[[[1-[3-[2-(7-chloro-2-chinolinylo)etenylo]fenylo]-3-[2-(1-hydroksy Sól monosodowa kwasu 1-metyloetylo)fenylo]propylo]tio]metylo]cyklopropanooctowego.
Wzór empiryczny to C35H35ClNNaO3S, a jego masa cząsteczkowa to 608,18. Wzór strukturalny to:
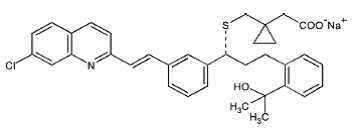
Montelukast sodu jest higroskopijnym, optycznie czynnym proszkiem o barwie od białej do białawej. Montelukast sodu jest łatwo rozpuszczalny w etanolu, metanolu i wodzie i praktycznie nierozpuszczalny w acetonitrylu.
Każda tabletka powlekana SINGULAIR 10 mg zawiera 10,4 mg montelukastu sodu, co odpowiada 10 mg montelukastu, oraz następujące nieaktywne składniki: celuloza mikrokrystaliczna, laktoza jednowodna, kroskarmeloza sodowa, hydroksypropyloceluloza i stearynian magnezu. Powłoka składa się z hydroksypropylometylocelulozy, hydroksypropylocelulozy, dwutlenku tytanu, czerwonego tlenku żelazowego, żółtego tlenku żelazowego i wosku Carnauba.
Każda tabletka SINGULAIR 4 mg i 5 mg do rozgryzania i żucia zawiera odpowiednio 4,2 i 5,2 mg montelukastu sodu, co odpowiada odpowiednio 4 i 5 mg montelukastu. Obie tabletki do żucia zawierają następujące składniki nieaktywne: mannitol, celulozę mikrokrystaliczną, hydroksypropylocelulozę, czerwony tlenek żelaza, kroskarmelozę sodową, aromat wiśniowy, aspartam i stearynian magnezu.
Każde opakowanie granulatu doustnego SINGULAIR 4 mg zawiera 4,2 mg montelukastu sodu, co odpowiada 4 mg montelukastu. Granulat doustny zawiera następujące składniki nieaktywne: mannitol, hydroksypropylocelulozę i stearynian magnezu.
WSKAZANIA
Astma
SINGULAIR® jest wskazany w profilaktyce i przewlekłym leczeniu astmy u dorosłych i dzieci w wieku 12 miesięcy i starszych.
Zwężenie oskrzeli wywołane wysiłkiem fizycznym (EIB)
SINGULAIR jest wskazany w zapobieganiu skurczowi oskrzeli wywołanemu wysiłkiem fizycznym (EIB) u pacjentów w wieku 6 lat i starszych.
Alergiczny nieżyt nosa
SINGULAIR 10 mg jest wskazany w łagodzeniu objawów sezonowego alergicznego zapalenia błony śluzowej nosa u pacjentów w wieku 2 lat i starszych oraz całorocznego alergicznego zapalenia błony śluzowej nosa u pacjentów w wieku 6 miesięcy i starszych. Ponieważ korzyści ze stosowania leku SINGULAIR 4 mg mogą nie przewyższać ryzyka wystąpienia objawów neuropsychiatrycznych u pacjentów z alergicznym nieżytem nosa [patrz OSTRZEŻENIA I ŚRODKI ], zarezerwować zastosowanie dla pacjentów, którzy mają niewystarczającą odpowiedź lub nietolerancję na alternatywne terapie.
Ograniczenia użytkowania
SINGULAIR nie jest wskazany w leczeniu ostrego napadu astmy.
DAWKOWANIE I SPOSÓB PODAWANIA
Astma
W przypadku astmy podawać SINGULAIR doustnie raz dziennie wieczorem, z jedzeniem lub bez. Nie przeprowadzono badań klinicznych u pacjentów z astmą oceniających względną skuteczność dawkowania rano i wieczorem.
Zalecane są następujące dawki:
Pacjenci, którzy pominęli dawkę, powinni przyjąć następną dawkę o zwykłej porze i nie powinni przyjmować 2 dawek jednocześnie.
Zwężenie oskrzeli wywołane wysiłkiem fizycznym (EIB)
celu zapobiegania EIB należy podać pojedynczą dawkę SINGULAIR 10 mg doustnie co najmniej 2 godziny przed wysiłkiem. Zalecane są następujące dawki:
Nie należy przyjmować dodatkowej dawki leku SINGULAIR w ciągu 24 godzin od przyjęcia poprzedniej dawki. Pacjenci przyjmujący już SINGULAIR codziennie z innego wskazania (w tym z astmą przewlekłą) nie powinni przyjmować dodatkowej dawki w celu zapobiegania EIB. Wszyscy pacjenci powinni mieć dostęp do krótko działającego beta-mimetyku.
Nie ustalono, aby codzienne podawanie produktu SINGULAIR w przewlekłym leczeniu astmy zapobiegało ostrym epizodom EIB.
Alergiczny nieżyt nosa
W przypadku alergicznego nieżytu nosa SINGULAIR 5 mg podawać doustnie raz dziennie, niezależnie od pory spożycia pokarmu. Czas podawania u pacjentów z alergicznym nieżytem nosa można dostosować do potrzeb pacjenta.
W leczeniu objawów sezonowego alergicznego nieżytu nosa zaleca się następujące dawki:
Tabela 3: Zalecane dawkowanie w sezonowym alergicznym zapaleniu błony śluzowej nosa
Pacjenci, którzy pominęli dawkę, powinni przyjąć następną dawkę o zwykłej porze i nie powinni przyjmować 2 dawek jednocześnie.
Astma i alergiczny nieżyt nosa
przypadku pacjentów zarówno z astmą, jak i alergicznym nieżytem nosa, podawać tylko jedną dawkę SINGULAIR doustnie raz dziennie wieczorem.
Pacjenci, którzy pominęli dawkę, powinni przyjąć następną dawkę o zwykłej porze i nie powinni przyjmować 2 dawek jednocześnie.
Instrukcje dotyczące podawania granulek doustnych
SINGULAIR 4 mg granulat doustny można podawać bezpośrednio do ust, rozpuścić w 1 łyżeczce (5 ml) zimnego lub o temperaturze pokojowej odżywki dla niemowląt lub mleka matki, albo zmieszać z łyżką zimnego lub o temperaturze pokojowej miękkiego pokarmu; w oparciu o badania stabilności należy używać tylko musu jabłkowego, marchwi, ryżu lub lodów. Opakowanie nie powinno być otwierane, dopóki nie będzie gotowe do użycia. Po otwarciu opakowania pełną dawkę (z mieszaniem lub bez zmieszania z mieszanką dla niemowląt, mlekiem matki lub pokarmem) należy podać w ciągu 15 minut. W przypadku zmieszania z preparatem dla niemowląt, mlekiem matki lub pokarmem SINGULAIR 4 mg granulat doustny nie może być przechowywany do przyszłego użycia. Wyrzuć niewykorzystaną część. SINGULAIR granulat doustny nie jest przeznaczony do rozpuszczania w żadnym płynie do podawania w innym płynie niż mieszanka dla niemowląt lub mleko matki. Jednak po podaniu można przyjmować płyny. SINGULAIR granulat doustny można podawać niezależnie od pory posiłków.
JAK DOSTARCZONE
Formy dawkowania i mocne strony
Tablety
10 mg, beżowe, zaokrąglone, kwadratowe tabletki powlekane, z kodem MSD 117 po jednej stronie i SINGULAIR 4 mg po drugiej.
Tabletki do żucia
5 mg, różowy, okrągły, dwuwypukły, z kodem MSD 275 po jednej stronie i SINGULAIR po drugiej.
Tabletki do żucia
4 mg, różowy, owalny, dwuwypukły, z kodem MSD 711 po jednej stronie i SINGULAIR po drugiej.
Granulat Doustny
4 mg, biały granulat o masie netto 500 mg, zapakowany w opakowanie foliowe zabezpieczone przed dostępem dzieci.
Składowania i stosowania
SINGULAIR 4 mg granulat doustny : biały granulat o masie netto 500 mg, zapakowany w opakowanie foliowe zabezpieczone przed dostępem dzieci.
NDC 0006-3841-30 karton jednostkowy zawierający 30 opakowań.
SINGULAIR 4 mg tabletki : różowe, owalne, dwuwypukłe tabletki do żucia, z kodem MSD 711 po jednej stronie i SINGULAIR 10 mg po drugiej.
NDC 0006-1711-31 butelek z polietylenu o wysokiej gęstości (HDPE) po 30 sztuk z polipropylenową nakrętką zabezpieczającą przed dostępem dzieci, uszczelką indukcyjną z folii aluminiowej i środkiem osuszającym w postaci żelu krzemionkowego.
SINGULAIR 5 mg tabletki różowe, okrągłe, dwuwypukłe tabletki do żucia, z kodem MSD 275 po jednej stronie i SINGULAIR po drugiej.
NDC 0006-9275-31 butelek z polietylenu o wysokiej gęstości (HDPE) po 30 sztuk z polipropylenową nakrętką zabezpieczającą przed dostępem dzieci, uszczelką indukcyjną z folii aluminiowej i środkiem osuszającym w postaci żelu krzemionkowego.
SINGULAIR 10 mg tabletki : beżowe, zaokrąglone, kwadratowe tabletki powlekane, z kodem MSD 117 po jednej stronie i SINGULAIR 4 mg po drugiej.
NDC 0006-9117-31 butelek z polietylenu o wysokiej gęstości (HDPE) po 30 sztuk z polipropylenową nakrętką zabezpieczającą przed dostępem dzieci, uszczelką indukcyjną z folii aluminiowej i środkiem osuszającym w postaci żelu krzemionkowego
NDC 0006-9117-54 Jednorazowe butelki z polietylenu o wysokiej gęstości (HDPE) po 90 sztuk z polipropylenową zakrętką zabezpieczającą przed dostępem dzieci, uszczelką indukcyjną z folii aluminiowej i środkiem osuszającym w postaci żelu krzemionkowego.
Magazynowanie
SINGULAIR 4 mg granulat doustny, 4 mg tabletki do żucia, 5 mg tabletki do żucia i 10 mg tabletki powlekane w temperaturze od 20°C do 25°C (68°F do 77°F), dopuszczalne odchylenia do 15° C do 30°C (59°F do 86°F) [patrz Kontrolowana temperatura pokojowa USP]. Chronić przed wilgocią i światłem. Przechowywać w oryginalnym opakowaniu.
Dystrybutor: Merck Sharp & Dohme Corp., spółka zależna MERCK & CO., INC., Whitehouse Station, USA. Poprawiono: luty 2021
SKUTKI UBOCZNE
Następujące klinicznie istotne działania niepożądane opisano w innym miejscu na etykiecie:
- Zdarzenia neuropsychiatryczne [patrz OSTRZEŻENIA I ŚRODKI ]
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce klinicznej. W poniższym opisie doświadczeń z badań klinicznych wymieniono działania niepożądane niezależnie od oceny związku przyczynowego.
Najczęstszymi działaniami niepożądanymi (częstość występowania ≥5% i większa niż w przypadku placebo; wymienione w kolejności od częstości występowania) w kontrolowanych badaniach klinicznych były: zakażenie górnych dróg oddechowych, gorączka, ból głowy, zapalenie gardła, kaszel, ból brzucha, biegunka, zapalenie ucha środkowego, grypa, wyciek z nosa, zapalenie zatok, zapalenie ucha.
Dorośli i młodzież w wieku 15 lat i starsi z astmą
Bezpieczeństwo leku SINGULAIR 10 mg oceniono w badaniach klinicznych u około 2950 dorosłych i młodzieży w wieku 15 lat i starszych. W badaniach klinicznych kontrolowanych placebo, następujące działania niepożądane zgłaszane po podaniu produktu SINGULAIR 4 mg wystąpiły u co najmniej 1% pacjentów i z częstością większą niż u pacjentów otrzymujących placebo:
Częstość rzadszych działań niepożądanych była porównywalna w przypadku produktu SINGULAIR i placebo.
Profil bezpieczeństwa produktu SINGULAIR 10 mg podawanego w pojedynczej dawce w celu zapobiegania EIB u dorosłych i młodzieży w wieku 15 lat i starszych był zgodny z profilem bezpieczeństwa opisanym wcześniej dla produktu SINGULAIR.
Łącznie 569 pacjentów było leczonych SINGULAIR 10 mg przez co najmniej 6 miesięcy, 480 przez jeden rok i 49 przez dwa lata w badaniach klinicznych. Przy przedłużonym leczeniu profil działań niepożądanych nie zmienił się znacząco.
Pacjenci pediatryczni w wieku od 6 do 14 lat z astmą
SINGULAIR 10 mg został oceniony pod kątem bezpieczeństwa u 476 pacjentów pediatrycznych w wieku od 6 do 14 lat. Łącznie 289 pacjentów pediatrycznych leczono SINGULAIR 10 mg przez co najmniej 6 miesięcy, a 241 przez rok lub dłużej w badaniach klinicznych. Profil bezpieczeństwa produktu SINGULAIR w 8-tygodniowym, podwójnie zaślepionym badaniu skuteczności u dzieci był zasadniczo podobny do profilu bezpieczeństwa u dorosłych. U dzieci w wieku od 6 do 14 lat otrzymujących SINGULAIR 5 mg następujące reakcje występowały z częstością ≥2% i częściej niż u dzieci i młodzieży otrzymujących placebo: zapalenie gardła, grypa, gorączka, zapalenie zatok, nudności, biegunka, niestrawność, zapalenie ucha, infekcja wirusowa i zapalenie krtani. Częstość występowania rzadszych działań niepożądanych była porównywalna dla produktu SINGULAIR 4 mg i placebo. Przy przedłużonym leczeniu profil działań niepożądanych nie zmienił się znacząco.
Profil bezpieczeństwa produktu SINGULAIR 4 mg podawanego w pojedynczej dawce w celu zapobiegania EIB u dzieci w wieku 6 lat i starszych był zgodny z profilem bezpieczeństwa opisanym wcześniej dla produktu SINGULAIR.
W badaniach oceniających tempo wzrostu profil bezpieczeństwa u tych pacjentów pediatrycznych był zgodny z profilem bezpieczeństwa opisanym wcześniej dla SINGULAIR. W 56-tygodniowym badaniu z podwójnie ślepą próbą oceniającym tempo wzrostu u dzieci w wieku od 6 do 8 lat otrzymujących SINGULAIR następujące reakcje nieobserwowane wcześniej podczas stosowania SINGULAIR w tej grupie wiekowej występowały z częstością ≥ 2% i częściej niż u dzieci i młodzieży otrzymujących placebo: ból głowy, nieżyt nosa (zakaźny), ospa wietrzna, zapalenie żołądka i jelit, atopowe zapalenie skóry, ostre zapalenie oskrzeli, zakażenie zębów, zakażenie skóry i krótkowzroczność.
Pacjenci pediatryczni w wieku od 2 do 5 lat z astmą
SINGULAIR oceniano pod kątem bezpieczeństwa u 573 pacjentów pediatrycznych w wieku od 2 do 5 lat w badaniach z zastosowaniem pojedynczej i wielokrotnej dawki. Łącznie w badaniach klinicznych 426 dzieci w wieku od 2 do 5 lat leczono produktem SINGULAIR 10 mg przez co najmniej 3 miesiące, 230 przez 6 miesięcy lub dłużej, a 63 pacjentów przez rok lub dłużej. U dzieci w wieku od 2 do 5 lat otrzymujących SINGULAIR następujące reakcje występowały z częstością ≥2% i częściej niż u dzieci i młodzieży otrzymujących placebo: gorączka, kaszel, ból brzucha, biegunka, ból głowy, wyciek z nosa, zapalenie zatok, zapalenie ucha, grypa, wysypka, ból ucha, zapalenie żołądka i jelit, egzema, pokrzywka, ospa wietrzna, zapalenie płuc, zapalenie skóry i zapalenie spojówek.
Pacjenci pediatryczni z astmą w wieku od 6 do 23 miesięcy
Bezpieczeństwo i skuteczność u dzieci i młodzieży w wieku poniżej 12 miesięcy z astmą nie zostały ustalone.
SINGULAIR 4 mg oceniano pod kątem bezpieczeństwa u 175 dzieci w wieku od 6 do 23 miesięcy. Profil bezpieczeństwa produktu SINGULAIR w 6-tygodniowym, podwójnie zaślepionym, kontrolowanym placebo badaniu klinicznym był zasadniczo podobny do profilu bezpieczeństwa u dorosłych i dzieci w wieku od 2 do 14 lat. U dzieci w wieku od 6 do 23 miesięcy otrzymujących SINGULAIR 5 mg następujące reakcje występowały z częstością ≥2% i częściej niż u dzieci i młodzieży otrzymujących placebo: zakażenie górnych dróg oddechowych, świszczący oddech; zapalenie ucha środkowego; zapalenie gardła, zapalenie migdałków, kaszel; i nieżyt nosa. Częstość rzadszych działań niepożądanych była porównywalna w przypadku produktu SINGULAIR i placebo.
Dorośli i młodzież w wieku 15 lat i starsi z sezonowym alergicznym nieżytem nosa
SINGULAIR został oceniony pod kątem bezpieczeństwa u 2199 dorosłych i młodzieży w wieku 15 lat i starszych w badaniach klinicznych. SINGULAIR 10 mg podawany raz na dobę rano lub wieczorem miał podobny profil bezpieczeństwa jak placebo. W badaniach klinicznych kontrolowanych placebo po zastosowaniu leku SINGULAIR 5 mg zgłaszano następującą reakcję z częstością ≥ 1% iz częstością większą niż w przypadku placebo: zakażenie górnych dróg oddechowych, 1,9% pacjentów otrzymujących SINGULAIR 4 mg w porównaniu do 1,5% pacjentów otrzymujących placebo. W 4-tygodniowym badaniu klinicznym kontrolowanym placebo, profil bezpieczeństwa był zgodny z obserwowanym w 2-tygodniowych badaniach. We wszystkich badaniach częstość występowania senności była podobna jak w przypadku placebo.
Pacjenci pediatryczni w wieku od 2 do 14 lat z sezonowym alergicznym nieżytem nosa
SINGULAIR 5 mg oceniano u 280 pacjentów pediatrycznych w wieku od 2 do 14 lat w 2-tygodniowym, wieloośrodkowym, podwójnie zaślepionym, kontrolowanym placebo badaniu bezpieczeństwa w grupach równoległych. SINGULAIR podawany raz na dobę wieczorem miał profil bezpieczeństwa podobny do placebo. W tym badaniu następujące reakcje występowały z częstością ≥2% iz częstością większą niż w przypadku placebo: ból głowy, zapalenie ucha środkowego, zapalenie gardła i zakażenie górnych dróg oddechowych.
Dorośli i młodzież w wieku 15 lat i starsi z całorocznym alergicznym nieżytem nosa
SINGULAIR oceniano pod kątem bezpieczeństwa u 3357 dorosłych i młodzieży w wieku 15 lat i starszych z całorocznym alergicznym zapaleniem błony śluzowej nosa, z których 1632 otrzymywało SINGULAIR w dwóch trwających 6 tygodni badaniach klinicznych. Profil bezpieczeństwa SINGULAIR 10 mg podawany raz na dobę był zgodny z obserwowanym u pacjentów z sezonowym alergicznym nieżytem nosa i podobny do profilu placebo. W tych dwóch badaniach po zastosowaniu produktu SINGULAIR zgłaszano następujące reakcje z częstością ≥ 1% iz częstością większą niż w przypadku placebo: zapalenie zatok, zakażenie górnych dróg oddechowych, zatokowy ból głowy, kaszel, krwawienie z nosa i zwiększona aktywność AlAT. Częstość występowania senności była podobna jak w przypadku placebo.
Pacjenci pediatryczni w wieku od 6 miesięcy do 14 lat z całorocznym alergicznym nieżytem nosa
Bezpieczeństwo u pacjentów w wieku od 2 do 14 lat z całorocznym alergicznym nieżytem nosa jest poparte bezpieczeństwem u pacjentów w wieku od 2 do 14 lat z sezonowym alergicznym nieżytem nosa. Bezpieczeństwo u pacjentów w wieku od 6 do 23 miesięcy jest poparte danymi z badań farmakokinetycznych oraz badań dotyczących bezpieczeństwa i skuteczności w astmie w tej populacji pediatrycznej oraz z badań farmakokinetycznych u dorosłych.
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane podczas stosowania produktu SINGULAIR po dopuszczeniu do obrotu. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek.
Zaburzenia krwi i układu chłonnego zwiększona skłonność do krwawień, małopłytkowość
Zaburzenia układu immunologicznego reakcje nadwrażliwości, w tym anafilaksja, nacieki eozynofilowe w wątrobie
Zaburzenia psychiczne tym między innymi pobudzenie, agresywne zachowanie lub wrogość, lęk, depresja, dezorientacja, zaburzenia uwagi, zaburzenia snu, dysfemia (jąkanie), omamy, bezsenność, drażliwość, zaburzenia pamięci, objawy obsesyjno-kompulsywne, niepokój, somnambulizm, myśli i zachowania samobójcze (w tym samobójstwo), tiki i drżenie [patrz OSTRZEŻENIE W PUDEŁKU , OSTRZEŻENIA I ŚRODKI ]
Zaburzenia układu nerwowego senność, parestezje/niedoczulica, drgawki
Zaburzenia serca kołatanie serca
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia krwawienie z nosa, eozynofilia płucna
Zaburzenia żołądkowo-jelitowe biegunka, niestrawność, nudności, zapalenie trzustki, wymioty
Zaburzenia wątroby i dróg żółciowych pacjentów leczonych produktem SINGULAIR zgłaszano przypadki cholestatycznego zapalenia wątroby, uszkodzenia wątrobowokomórkowego wątroby oraz uszkodzenia wątroby o mieszanym wzorze. Większość z nich wystąpiła w połączeniu z innymi czynnikami zakłócającymi, takimi jak stosowanie innych leków lub gdy SINGULAIR podawano pacjentom z potencjalnymi chorobami wątroby, takimi jak spożywanie alkoholu lub inne postacie zapalenia wątroby.
Zaburzenia skóry i tkanki podskórnej obrzęk naczynioruchowy, siniaki, rumień wielopostaciowy, rumień guzowaty, świąd, zespół Stevensa-Johnsona/toksyczna martwica naskórka, pokrzywka
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej bóle stawów, bóle mięśni, w tym skurcze mięśni
Zaburzenia nerek i dróg moczowych moczenie u dzieci
Zaburzenia ogólne i stany w miejscu podania obrzęk
Pacjenci z astmą leczeni produktem SINGULAIR mogą wykazywać ogólnoustrojową eozynofilię, czasami z objawami klinicznymi zapalenia naczyń zgodnymi z zespołem Churga-Straussa, stanem często leczonym ogólnoustrojową terapią kortykosteroidami. Reakcje te były czasami związane ze zmniejszeniem leczenia doustnymi kortykosteroidami. Lekarze powinni być wyczuleni na eozynofilię, wysypkę naczyniową, nasilenie objawów ze strony płuc, powikłania sercowe i/lub neuropatię u swoich pacjentów [patrz OSTRZEŻENIA I ŚRODKI ].
INTERAKCJE Z LEKAMI
Nie ma konieczności dostosowania dawki, gdy SINGULAIR 5 mg jest podawany jednocześnie z teofiliną, prednizonem, prednizolonem, doustnymi środkami antykoncepcyjnymi, feksofenadyną, digoksyną, warfaryną, gemfibrozylem, itrakonazolem, hormonami tarczycy, lekami uspokajającymi, niesteroidowymi lekami przeciwzapalnymi, benzodiazepinami i induktory enzymów cytochromu P450 (CYP) [patrz FARMAKOLOGIA KLINICZNA ].
OSTRZEŻENIA
Zawarte jako część "ŚRODKI OSTROŻNOŚCI" Sekcja
ŚRODKI OSTROŻNOŚCI
Wydarzenia neuropsychiatryczne
Podczas stosowania produktu SINGULAIR zgłaszano poważne zdarzenia neuropsychiatryczne (NP). Te zgłoszenia po wprowadzeniu do obrotu były bardzo zróżnicowane i obejmowały między innymi pobudzenie, agresywne zachowanie lub wrogość, lęk, depresję, dezorientację, zaburzenia uwagi, zaburzenia snu, dysfemię (jąkanie), omamy, bezsenność, drażliwość, zaburzenia pamięci, objawy obsesyjno-kompulsywne, niepokój, somnambulizm, myśli i zachowania samobójcze (w tym samobójstwo), tiki i drżenie. Zdarzenia NP zgłaszano u dorosłych, młodzieży i dzieci z zaburzeniami psychicznymi w wywiadzie lub bez nich. Zdarzenia NP były zgłaszane głównie podczas leczenia SINGULAIR 10 mg, ale niektóre były zgłaszane po odstawieniu SINGULAIR 5 mg. Badania na zwierzętach wykazały, że montelukast przenika do mózgu szczurów [patrz FARMAKOLOGIA KLINICZNA ]; jednak mechanizmy leżące u podstaw zdarzeń NP związanych z SINGULAIR nie są obecnie dobrze poznane. Na podstawie dostępnych danych trudno jest zidentyfikować czynniki ryzyka lub określić ilościowo ryzyko wystąpienia NP przy stosowaniu SINGULAIR 10 mg.
Ze względu na ryzyko wystąpienia zdarzeń NP, korzyści ze stosowania leku SINGULAIR mogą nie przewyższać ryzyka u niektórych pacjentów, zwłaszcza gdy objawy choroby mogą być łagodne i odpowiednio leczone terapią alternatywną. Zarezerwować stosowanie SINGULAIR 4 mg dla pacjentów z alergicznym nieżytem nosa, którzy mają niewystarczającą odpowiedź lub nietolerancję na alternatywne terapie [patrz WSKAZANIA ]. U pacjentów z astmą lub skurczem oskrzeli wywołanym wysiłkiem fizycznym należy rozważyć korzyści i zagrożenia przed przepisaniem leku SINGULAIR.
Podczas przepisywania leku SINGULAIR należy omówić korzyści i ryzyko związane ze stosowaniem leku SINGULAIR 10 mg z pacjentami i opiekunami. Należy poinformować pacjentów i (lub) opiekunów, aby zwracali uwagę na zmiany w zachowaniu lub na nowe objawy NP podczas przyjmowania leku SINGULAIR. W przypadku zaobserwowania zmian w zachowaniu lub pojawienia się nowych objawów NP lub myśli i (lub) zachowań samobójczych, należy doradzić pacjentom odstawienie leku SINGULAIR 10 mg i natychmiast skontaktować się z lekarzem. W wielu przypadkach objawy ustąpiły po zaprzestaniu leczenia lekiem SINGULAIR; jednak w niektórych przypadkach objawy utrzymywały się po odstawieniu leku SINGULAIR. Dlatego należy nadal monitorować i zapewniać opiekę wspomagającą, aż objawy ustąpią. W przypadku wystąpienia takich zdarzeń należy ponownie ocenić korzyści i ryzyko związane z wznowieniem leczenia lekiem SINGULAIR 10 mg.
Ostra astma
SINGULAIR nie jest wskazany do stosowania w celu odwrócenia skurczu oskrzeli w ostrych atakach astmy, w tym w stanie astmatycznym. Pacjentom należy zalecić, aby mieli dostępne odpowiednie leki doraźne. Leczenie preparatem SINGULAIR 4 mg można kontynuować podczas zaostrzeń astmy. Pacjenci, u których po wysiłku występują zaostrzenia astmy, powinni mieć dostęp do krótko działającego beta-mimetyku wziewnego.
Jednoczesne stosowanie kortykosteroidów
Chociaż dawkę wziewnego kortykosteroidu można stopniowo zmniejszać pod nadzorem lekarza, SINGULAIR nie powinien być nagle zastępowany kortykosteroidami wziewnymi lub doustnymi.
Wrażliwość na aspirynę
Pacjenci ze stwierdzoną wrażliwością na aspirynę powinni nadal unikać aspiryny lub niesteroidowych leków przeciwzapalnych podczas przyjmowania leku SINGULAIR. Chociaż SINGULAIR skutecznie poprawia czynność dróg oddechowych u astmatyków z udokumentowaną wrażliwością na aspirynę, nie wykazano, że zmniejsza odpowiedź zwężającą oskrzela na aspirynę i inne niesteroidowe leki przeciwzapalne u pacjentów z astmą wrażliwą na aspirynę [patrz Studia kliniczne ].
Warunki eozynofilowe
Pacjenci z astmą leczeni produktem SINGULAIR mogą wykazywać ogólnoustrojową eozynofilię, czasami z objawami klinicznymi zapalenia naczyń zgodnymi z zespołem Churga-Straussa, stanem często leczonym ogólnoustrojową terapią kortykosteroidami. Zdarzenia te były czasami związane ze zmniejszeniem leczenia doustnymi kortykosteroidami. Lekarze powinni być wyczuleni na eozynofilię, wysypkę naczyniową, nasilenie objawów ze strony płuc, powikłania sercowe i/lub neuropatię u swoich pacjentów. Nie ustalono związku przyczynowego między SINGULAIR 10 mg a tymi podstawowymi schorzeniami [patrz DZIAŁANIA NIEPOŻĄDANE ].
Ryzyko u pacjentów z fenyloketonurią
SINGULAIR 4mg zawiera aspartam, źródło fenyloalaniny. Fenyloalanina może być szkodliwa dla pacjentów z fenyloketonurią (PKU). Każda tabletka do żucia 4 mg i 5 mg zawiera odpowiednio 0,674 mg i 0,842 mg fenyloalaniny. Przed przepisaniem SINGULAIR pacjentowi z PKU należy rozważyć łączną dobową ilość fenyloalaniny ze wszystkich źródeł, w tym SINGULAIR.
Informacje dotyczące poradnictwa dla pacjentów
W przypadku tabletek i tabletek do żucia należy doradzić pacjentowi i/lub opiekunowi przeczytanie zatwierdzonego przez FDA oznakowania pacjenta ( Przewodnik po lekach ).
W przypadku granulatu doustnego należy doradzić pacjentowi i/lub opiekunowi przeczytanie zatwierdzonego przez FDA oznakowania pacjenta ( Przewodnik po lekach i instrukcje użytkowania ).
- Poinformuj pacjentów o potencjalnym ryzyku wystąpienia poważnych objawów neuropsychiatrycznych i zmian behawioralnych związanych ze stosowaniem SINGULAIR [patrz OSTRZEŻENIA I ŚRODKI ].
- Należy omówić korzyści i ryzyko związane ze stosowaniem leku SINGULAIR z pacjentami, którzy przepisują lub kontynuują leczenie lekiem SINGULAIR [patrz OSTRZEŻENIA I ŚRODKI ].
- Poradzić pacjentom, aby monitorowali zmiany w zachowaniu lub objawy neuropsychiatryczne u pacjentów przyjmujących SINGULAIR [patrz OSTRZEŻENIA I ŚRODKI ].
- Należy poinstruować pacjentów, aby przerwali stosowanie leku SINGULAIR i niezwłocznie skontaktowali się z lekarzem, jeśli wystąpią zmiany w zachowaniu lub myśleniu nietypowe dla pacjenta lub jeśli u pacjenta wystąpią myśli samobójcze lub zachowania samobójcze [patrz OSTRZEŻENIA I ŚRODKI ].
- Należy doradzić pacjentom, aby przyjmowali SINGULAIR codziennie zgodnie z zaleceniami, nawet gdy nie występują u nich objawy, a także w okresach pogorszenia się astmy, a jeśli astma nie jest dobrze kontrolowana, należy skontaktować się z lekarzem.
- Należy poinformować pacjentów, że doustny SINGULAIR nie jest przeznaczony do leczenia ostrych napadów astmy. Powinni mieć dostęp do odpowiednich krótko działających beta-mimetyków wziewnych do leczenia zaostrzeń astmy. Pacjentów, u których po wysiłku występuje zaostrzenie astmy, należy poinstruować, aby mieli przy sobie krótko działającego beta-mimetyka w postaci wziewnej. Codzienne podawanie produktu SINGULAIR w przewlekłym leczeniu astmy nie zostało ustalone w celu zapobiegania ostrym epizodom EIB [patrz OSTRZEŻENIA I ŚRODKI ].
- Należy doradzić pacjentom, aby zwrócili się o pomoc lekarską, jeśli krótko działające wziewne leki rozszerzające oskrzela są potrzebne częściej niż zwykle lub jeśli potrzebna jest większa niż maksymalna liczba inhalacji krótko działającego leku rozszerzającego oskrzela przepisana na okres 24 godzin.
- Poinstruuj pacjentów, aby kontynuowali przyjmowanie innych leków przeciwastmatycznych zgodnie z zaleceniami lekarza, chyba że zaleci to lekarz.
- Należy poinstruować pacjentów ze znaną wrażliwością na aspirynę, aby kontynuowali unikanie aspiryny lub niesteroidowych leków przeciwzapalnych podczas przyjmowania leku SINGULAIR [patrz OSTRZEŻENIA I ŚRODKI ].
- Należy poinformować pacjentów z fenyloketonurią, że tabletki do żucia 4 mg i 5 mg zawierają fenyloalaninę (źródło aspartamu) [patrz OSTRZEŻENIA I ŚRODKI ].
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
badaniach rakotwórczości trwających 2 lata u szczurów Sprague-Dawley lub 92 tygodni u myszy po podaniu doustnym dawek do 200 mg/kg/dobę lub 100 mg/kg/dobę nie zaobserwowano dowodów na działanie rakotwórcze. Szacowana ekspozycja u szczurów była około 120 i 75 razy większa od AUC odpowiednio dla dorosłych i dzieci przy maksymalnej zalecanej dziennej dawce doustnej. Szacowana ekspozycja u myszy była około 45 i 25 razy większa od AUC odpowiednio dla dorosłych i dzieci przy maksymalnej zalecanej dziennej dawce doustnej.
Montelukast nie wykazał działania mutagennego ani klastogennego w następujących testach: test mutagenezy drobnoustrojów, test mutagenezy na komórkach ssaków V-79, test elucji alkalicznej w hepatocytach szczura, test aberracji chromosomowych w komórkach jajnika chomika chińskiego oraz test aberracji chromosomowych szpiku kostnego myszy vivo.
badaniach płodności u samic szczurów montelukast powodował zmniejszenie wskaźników płodności i płodności po podaniu doustnym dawki 200 mg/kg (szacunkowa ekspozycja była około 70 razy większa od AUC dla dorosłych przy maksymalnej zalecanej doustnie dawce). Nie zaobserwowano wpływu na płodność lub płodność kobiet po podaniu doustnym dawki 100 mg/kg (szacowana ekspozycja wynosiła około 20-krotność AUC dla dorosłych przy maksymalnej zalecanej dziennej dawce doustnej). Montelukast nie miał wpływu na płodność samców szczurów w dawkach doustnych do 800 mg/kg (szacunkowa ekspozycja wynosiła około 160-krotność AUC dla dorosłych przy maksymalnej zalecanej doustnej dawce dobowej).
Używaj w określonych populacjach
Ciąża
Podsumowanie ryzyka
Dostępne dane z opublikowanych prospektywnych i retrospektywnych badań kohortowych na przestrzeni dziesięcioleci z zastosowaniem montelukastu u kobiet w ciąży nie wykazały związanego z lekiem ryzyka wystąpienia poważnych wad wrodzonych [patrz Dane ]. W badaniach na zwierzętach dotyczących reprodukcji nie zaobserwowano działań niepożądanych rozwojowych po doustnym podaniu montelukastu ciężarnym szczurom i królikom podczas organogenezy w dawkach odpowiednio około 100 i 110-krotności maksymalnej zalecanej dawki dobowej u ludzi (MRHDOD) na podstawie AUC [patrz Dane ].
Szacowane ryzyko tła poważnych wad wrodzonych i poronienia dla wskazanej populacji jest nieznane. Wszystkie ciąże wiążą się z ryzykiem wady wrodzonej, utraty lub innych niekorzystnych skutków. w
W populacji ogólnej USA szacowane podstawowe ryzyko poważnych wad wrodzonych i poronienia w klinicznie rozpoznanych ciążach wynosi odpowiednio 2-4% i 15-20%.
Rozważania kliniczne
Związane z chorobą ryzyko matki i/lub zarodka/płodu
Słabo lub umiarkowanie kontrolowana astma w ciąży zwiększa ryzyko okołoporodowych działań niepożądanych, takich jak stan przedrzucawkowy i wcześniactwo noworodków, niska masa urodzeniowa i niski wiek ciążowy.
Dane
Dane ludzkie
Opublikowane dane z prospektywnych i retrospektywnych badań kohortowych nie wykazały związku ze stosowaniem preparatu SINGULAIR podczas ciąży i poważnych wad wrodzonych. Dostępne badania mają ograniczenia metodologiczne, w tym małą wielkość próby, w niektórych przypadkach retrospektywne gromadzenie danych oraz niespójne grupy porównawcze.
Dane zwierząt
W badaniach dotyczących rozwoju zarodka i płodu, montelukast podawany ciężarnym samicom szczurów i królików w czasie organogenezy (od 6. do 17. dnia ciąży u szczurów i od 6. do 18. dnia u królików) nie wywoływał żadnych niepożądanych skutków rozwojowych w dawkach doustnych do 400 i 300 mg/kg mc. /dzień odpowiednio u szczurów i królików (odpowiednio około 100 i 110-krotność AUC u ludzi przy MRHDOD).
Laktacja
Podsumowanie ryzyka
Opublikowane kliniczne badanie laktacji donosi o obecności montelukastu w mleku ludzkim. Dostępne dane dotyczące wpływu leku na niemowlęta, bezpośrednio [patrz Zastosowanie pediatryczne lub poprzez mleko matki, nie sugerują znaczącego ryzyka wystąpienia działań niepożądanych w wyniku narażenia na SINGULAIR. Wpływ leku na produkcję mleka jest nieznany. Należy wziąć pod uwagę korzyści rozwojowe i zdrowotne wynikające z karmienia piersią, a także kliniczne zapotrzebowanie matki na SINGULAIR 5 mg oraz wszelkie potencjalne działania niepożądane związane ze stosowaniem SINGULAIR 10 mg u karmionego piersią niemowlęcia lub z powodu schorzenia matki.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność preparatu SINGULAIR w leczeniu astmy ustalono u dzieci w wieku od 6 do 14 lat. Stosowanie leku SINGULAIR 4 mg w tym wskazaniu jest poparte dowodami z dobrze kontrolowanych badań. Dane dotyczące bezpieczeństwa i skuteczności w tej grupie wiekowej są podobne do danych obserwowanych u dorosłych [patrz DZIAŁANIA NIEPOŻĄDANE , FARMAKOLOGIA KLINICZNA , Określone populacje , oraz Studia kliniczne ].
Skuteczność preparatu SINGULAIR w leczeniu sezonowego alergicznego nieżytu nosa u dzieci w wieku od 2 do 14 lat oraz w leczeniu całorocznego alergicznego nieżytu nosa u dzieci w wieku od 6 miesięcy do 14 lat została ustalona i jest poparta ekstrapolacją wykazanej skuteczności u pacjentów w wieku 15 lat i starszych z alergicznym nieżytem nosa oraz założenie, że przebieg choroby, patofizjologia i działanie leku są zasadniczo podobne w tych populacjach.
Bezpieczeństwo stosowania tabletek do rozgryzania i żucia SINGULAIR 4 mg u dzieci i młodzieży w wieku od 2 do 5 lat z astmą zostało wykazane na podstawie odpowiednich i dobrze kontrolowanych danych [patrz DZIAŁANIA NIEPOŻĄDANE ]. Skuteczność SINGULAIR 5 mg w tej grupie wiekowej została ekstrapolowana z wykazanej skuteczności u pacjentów w wieku 6 lat i starszych z astmą i opiera się na podobnych danych farmakokinetycznych, a także założeniu, że przebieg choroby, patofizjologia i działanie leku są zasadniczo podobne wśród tych populacji. Skuteczność w tej grupie wiekowej potwierdzają rozpoznawcze oceny skuteczności przeprowadzone w dużym, dobrze kontrolowanym badaniu bezpieczeństwa przeprowadzonym u pacjentów w wieku od 2 do 5 lat.
Bezpieczeństwo stosowania produktu SINGULAIR w postaci granulatu 4 mg u dzieci w wieku od 12 do 23 miesięcy z astmą wykazano w analizie 172 pacjentów pediatrycznych, z których 124 otrzymywało SINGULAIR w 6-tygodniowym, podwójnie zaślepionym, placebo kontrolowane badanie [patrz DZIAŁANIA NIEPOŻĄDANE ]. Skuteczność leku SINGULAIR w tej grupie wiekowej została ekstrapolowana na podstawie wykazanej skuteczności u pacjentów w wieku 6 lat i starszych z astmą na podstawie podobnej średniej ekspozycji ogólnoustrojowej (AUC) oraz tego, że przebieg choroby, patofizjologia i działanie leku są zasadniczo podobne w tych populacjach , poparte danymi dotyczącymi skuteczności z badania bezpieczeństwa, w którym skuteczność była oceną eksploracyjną.
Bezpieczeństwo stosowania tabletek do rozgryzania i żucia SINGULAIR 4 mg i 5 mg u dzieci i młodzieży w wieku od 2 do 14 lat z alergicznym zapaleniem błony śluzowej nosa jest poparte danymi z badań przeprowadzonych u dzieci w wieku od 2 do 14 lat z astmą. Badanie bezpieczeństwa u dzieci w wieku od 2 do 14 lat z sezonowym alergicznym nieżytem nosa wykazało podobny profil bezpieczeństwa [patrz DZIAŁANIA NIEPOŻĄDANE ]. Bezpieczeństwo stosowania produktu SINGULAIR w postaci granulatu 4 mg u dzieci i młodzieży w wieku 6 miesięcy z całorocznym alergicznym zapaleniem błony śluzowej nosa jest poparte ekstrapolacją danych dotyczących bezpieczeństwa uzyskanych z badań przeprowadzonych u dzieci w wieku od 6 do 23 miesięcy z astmą oraz z danych farmakokinetycznych porównanie ekspozycji ogólnoustrojowej u pacjentów w wieku od 6 do 23 miesięcy z ekspozycjami ogólnoustrojowymi u dorosłych.
Nie ustalono bezpieczeństwa i skuteczności u dzieci w wieku poniżej 12 miesięcy z astmą, 6 miesięcy z całorocznym alergicznym nieżytem nosa i 6 lat ze skurczem oskrzeli wywołanym wysiłkiem fizycznym.
Tempo wzrostu u pacjentów pediatrycznych
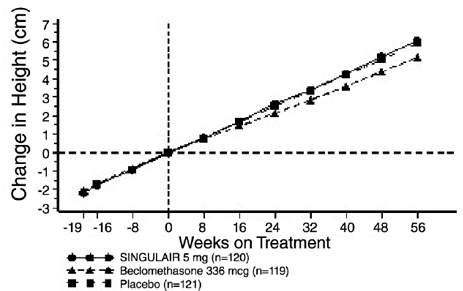
Przeprowadzono 56-tygodniowe, wieloośrodkowe, podwójnie zaślepione, randomizowane, kontrolowane za pomocą substancji czynnej i placebo badanie w grupach równoległych w celu oceny wpływu produktu SINGULAIR 4 mg na tempo wzrostu u 360 pacjentów z łagodną astmą w wieku od 6 do 8 lat. Grupy leczenia obejmowały SINGULAIR 5 mg raz na dobę, placebo i dipropionian beklometazonu podawany w dawce 168 mcg dwa razy na dobę za pomocą przekładki. Dla każdego osobnika szybkość wzrostu zdefiniowano jako nachylenie linii regresji liniowej dopasowanej do pomiarów wzrostu w ciągu 56 tygodni. Podstawowym porównaniem była różnica w szybkości wzrostu między grupami SINGULAIR i placebo. Wskaźniki wzrostu wyrażone jako średnia najmniejszych kwadratów (LS) (95% CI) w cm/rok dla grup leczonych SINGULAIR, placebo i beklometazonem wynosiły 5,67 (5,46, 5,88), 5,64 (5,42, 5,86) i 4,86 ( 4,64, 5,08). Różnice w szybkości wzrostu wyrażone jako średnia najmniejszych kwadratów (LS) (95% CI) w cm/rok dla grup leczonych SINGULAIR 5 mg minus placebo, beklometazon minus placebo i SINGULAIR 5 mg minus beklometazon wynosiły 0,03 (-0,26; 0,31) -0,78 (-1,06, -0,49); i odpowiednio 0,81 (0,53, 1,09). Tempo wzrostu (wyrażone jako średnia zmiana wzrostu w czasie) dla każdej grupy leczenia przedstawiono na RYC. 1.
Rycina 1: Zmiana wzrostu (cm) od wizyty randomizacyjnej według zaplanowanego tygodnia (średnia grupy leczenia ± błąd standardowy* średniej)
Zastosowanie geriatryczne
Spośród całkowitej liczby pacjentów w badaniach klinicznych montelukastu 3,5% było w wieku 65 lat i więcej, a 0,4% miało 75 lat i więcej. Nie zaobserwowano ogólnych różnic w bezpieczeństwie lub skuteczności między tymi pacjentami a młodszymi pacjentami, a inne zgłoszone doświadczenia kliniczne nie wykazały różnic w odpowiedziach między pacjentami w podeszłym wieku i młodszymi, ale nie można wykluczyć większej wrażliwości niektórych osób starszych. Profil farmakokinetyczny i biodostępność po podaniu doustnym pojedynczej dawki 10 mg montelukastu są podobne u osób starszych i młodszych. Okres półtrwania montelukastu w osoczu jest nieco dłuższy u osób w podeszłym wieku. Nie ma konieczności dostosowania dawkowania u osób w podeszłym wieku.
Niewydolność wątroby
Nie zaleca się zmiany dawkowania u pacjentów z łagodną lub umiarkowaną niewydolnością wątroby [patrz FARMAKOLOGIA KLINICZNA ].
Zaburzenia czynności nerek
Nie zaleca się modyfikacji dawkowania u pacjentów z niewydolnością nerek [patrz FARMAKOLOGIA KLINICZNA ].
PRZEDAWKOWAĆ
Brak szczegółowych informacji dotyczących leczenia przedawkowania produktu SINGULAIR. W przypadku przedawkowania uzasadnione jest zastosowanie zwykłych środków wspomagających; np. usunąć niewchłonięty materiał z przewodu pokarmowego, zastosować monitorowanie kliniczne i w razie potrzeby wdrożyć leczenie wspomagające. Nie wiadomo, czy montelukast usuwa się za pomocą dializy otrzewnowej czy hemodializy.
PRZECIWWSKAZANIA
SINGULAIR jest przeciwwskazany u pacjentów z nadwrażliwością na którykolwiek z jego składników.
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Leukotrieny cysteinylowe (LTC4, LTD4, LTE4) są produktami metabolizmu kwasu arachidonowego i są uwalniane z różnych komórek, w tym z komórek tucznych i eozynofili. Te eikozanoidy wiążą się z receptorami leukotrienów cysteinylowych (CysLT). Receptor CysLT typu 1 (CysLT1) znajduje się w drogach oddechowych człowieka (w tym w komórkach mięśni gładkich dróg oddechowych i makrofagach dróg oddechowych) oraz na innych komórkach prozapalnych (w tym eozynofilach i niektórych komórkach macierzystych szpiku). CysLTs skorelowano z patofizjologią astmy i alergicznego nieżytu nosa. W astmie wpływ leukotrienów obejmuje obrzęk dróg oddechowych, skurcz mięśni gładkich i zmienioną aktywność komórkową związaną z procesem zapalnym. W alergicznym nieżycie nosa CysLT są uwalniane z błony śluzowej nosa po ekspozycji na alergen, zarówno we wczesnej, jak i późnej fazie reakcji i są związane z objawami alergicznego nieżytu nosa.
Montelukast jest związkiem czynnym doustnie, który wiąże się z wysokim powinowactwem i wybiórczo z receptorem CysLT1 (zamiast innych farmakologicznie ważnych receptorów dróg oddechowych, takich jak receptor prostanoidowy, cholinergiczny lub β-adrenergiczny). Montelukast hamuje fizjologiczne działania LTD4 na receptor CysLT1 bez jakiejkolwiek aktywności agonistycznej.
Farmakodynamika
Montelukast powoduje hamowanie receptorów leukotrienów cysteinylowych w drogach oddechowych, co wykazano poprzez zdolność do hamowania skurczu oskrzeli wywołanego wdychaniem LTD4 u astmatyków. Dawki tak niskie jak 5 mg powodują znaczną blokadę skurczu oskrzeli wywołanego LTD4. W badaniu naprzemiennym kontrolowanym placebo (n=12) SINGULAIR 4 mg hamował skurcz oskrzeli we wczesnej i późnej fazie spowodowany prowokacją antygenem odpowiednio o 75% i 57%.
badaniach klinicznych badano wpływ SINGULAIR 5 mg na eozynofile we krwi obwodowej. U pacjentów z astmą w wieku 2 lat i starszych, którzy otrzymywali SINGULAIR 10 mg, zaobserwowano zmniejszenie średniej liczby eozynofili we krwi obwodowej w zakresie od 9% do 15% w porównaniu z placebo w okresach leczenia metodą podwójnie ślepej próby. U pacjentów z sezonowym alergicznym nieżytem nosa w wieku 15 lat i starszych, którzy otrzymywali SINGULAIR 4 mg, odnotowano średni wzrost liczby eozynofili we krwi obwodowej o 0,2% w porównaniu ze średnim wzrostem o 12,5% u pacjentów otrzymujących placebo, w porównaniu z leczeniem metodą podwójnie ślepej próby. okresy; odzwierciedla to średnią różnicę 12,3% na korzyść SINGULAIR. Związek między tymi obserwacjami a korzyściami klinicznymi montelukastu odnotowanymi w badaniach klinicznych nie jest znany [patrz Studia kliniczne ].
Farmakokinetyka
Wchłanianie
Montelukast jest szybko wchłaniany po podaniu doustnym. Po podaniu 10 mg tabletki powlekanej dorosłym na czczo średnie maksymalne stężenie montelukastu w osoczu (Cmax) jest osiągane w ciągu 3 do 4 godzin (Tmax). Średnia biodostępność po podaniu doustnym wynosi 64%. Standardowy posiłek rano nie wpływa na biodostępność i Cmax po podaniu doustnym.
W przypadku tabletki do rozgryzania i żucia 5 mg, średnie Cmax jest osiągane w ciągu 2 do 2,5 godziny po podaniu dorosłym na czczo. Średnia biodostępność po podaniu doustnym wynosi 73% na czczo w porównaniu z 63% po podaniu rano ze standardowym posiłkiem.
W przypadku tabletki do rozgryzania i żucia 4 mg średnie Cmax jest osiągane 2 godziny po podaniu u dzieci w wieku od 2 do 5 lat na czczo.
Granulat doustny o mocy 4 mg jest biorównoważny z tabletką do żucia o mocy 4 mg przy podawaniu dorosłym na czczo. Jednoczesne podawanie doustnego granulatu z musem jabłkowym nie miało klinicznie istotnego wpływu na farmakokinetykę montelukastu. Poranny posiłek o wysokiej zawartości tłuszczu nie wpływał na wartość AUC montelukastu w postaci granulatu doustnego; jednak posiłek zmniejszył Cmax o 35% i wydłużył Tmax z 2,3 ± 1,0 godziny do 6,4 ± 2,9 godziny.
Bezpieczeństwo i skuteczność preparatu SINGULAIR u pacjentów z astmą wykazano w badaniach klinicznych, w których tabletki powlekane 10 mg i tabletki do żucia 5 mg podawano wieczorem, niezależnie od pory spożycia pokarmu. Bezpieczeństwo stosowania produktu SINGULAIR 4 mg u pacjentów z astmą wykazano również w badaniach klinicznych, w których tabletki do żucia 4 mg i granulat doustny 4 mg podawano wieczorem, niezależnie od pory przyjmowania pokarmu. Bezpieczeństwo i skuteczność preparatu SINGULAIR u pacjentów z sezonowym alergicznym nieżytem nosa wykazano w badaniach klinicznych, w których tabletkę powlekaną 10 mg podawano rano lub wieczorem, niezależnie od pory spożycia pokarmu.
Nie przeprowadzono oceny porównawczej farmakokinetyki montelukastu podawanego w postaci dwóch tabletek do żucia 5 mg i jednej tabletki powlekanej 10 mg.
Dystrybucja
Montelukast w ponad 99% wiąże się z białkami osocza. Objętość dystrybucji montelukastu w stanie stacjonarnym wynosi średnio od 8 do 11 litrów. Doustnie podawany montelukast przenika do mózgu szczurów.
Eliminacja
Klirens osoczowy montelukastu u zdrowych osób dorosłych wynosi średnio 45 ml/min. Po podaniu doustnym znakowanego radioaktywnie montelukastu 86% radioaktywności wykryto w 5-dniowej zbiórce kału, a
W kilku badaniach średni okres półtrwania montelukastu w osoczu wynosił od 2,7 do 5,5 godziny u zdrowych młodych osób dorosłych. Farmakokinetyka montelukastu jest prawie liniowa dla dawek doustnych do 50 mg. Podczas podawania montelukastu raz na dobę 10 mg montelukastu kumulacja leku macierzystego w osoczu jest niewielka (14%).
Metabolizm
Montelukast jest intensywnie metabolizowany. W badaniach z zastosowaniem dawek terapeutycznych stężenia metabolitów montelukastu w osoczu są niewykrywalne w stanie stacjonarnym u dorosłych i dzieci.
Badania in vitro z użyciem mikrosomów wątroby ludzkiej wskazują, że w metabolizmie montelukastu biorą udział CYP3A4, 2C8 i 2C9. W klinicznie istotnych stężeniach 2C8 wydaje się odgrywać główną rolę w metabolizmie montelukastu.
Określone populacje
Pacjenci z niewydolnością wątroby
U pacjentów z łagodną lub umiarkowaną niewydolnością wątroby i klinicznymi objawami marskości wątroby zaobserwowano zmniejszony metabolizm montelukastu, co prowadziło do zwiększenia o 41% (90% CI=7%, 85%) średniej wartości AUC montelukastu po podaniu pojedynczej dawki 10 mg. Eliminacja montelukastu była nieznacznie wydłużona w porównaniu z eliminacją u zdrowych osób (średni okres półtrwania 7,4 godziny). Nie ma konieczności dostosowania dawki u pacjentów z łagodną do umiarkowanej niewydolnością wątroby. Nie oceniano farmakokinetyki produktu SINGULAIR u pacjentów z cięższą niewydolnością wątroby lub zapaleniem wątroby.
Pacjenci z niewydolnością nerek
Ponieważ montelukast i jego metabolity nie są wydalane z moczem, nie oceniano farmakokinetyki montelukastu u pacjentów z niewydolnością nerek. U tych pacjentów nie zaleca się zmiany dawkowania.
Pacjenci płci męskiej i żeńskiej
Farmakokinetyka montelukastu jest podobna u mężczyzn i kobiet.
Grupy rasowe
Nie badano różnic farmakokinetycznych ze względu na rasę.
Młodzież i pacjenci pediatryczni
W badaniach farmakokinetycznych oceniano ogólnoustrojową ekspozycję na 4 mg granulat doustny u dzieci w wieku od 6 do 23 miesięcy, tabletki do rozgryzania i żucia 4 mg u dzieci w wieku 2 do 5 lat, tabletki do rozgryzania i żucia 5 mg u dzieci i młodzieży 6 do 14 lat oraz tabletki powlekane 10 mg u młodych osób dorosłych i młodzieży w wieku ≥15 lat.
Profil stężenia montelukastu w osoczu po podaniu tabletki powlekanej 10 mg jest podobny u młodzieży w wieku ≥15 lat i młodych dorosłych. Tabletka powlekana 10 mg jest zalecana do stosowania u pacjentów w wieku ≥15 lat.
Średnia ekspozycja ogólnoustrojowa na tabletki do rozgryzania i żucia 4 mg u dzieci w wieku od 2 do 5 lat oraz tabletki do rozgryzania i żucia 5 mg u dzieci w wieku od 6 do 14 lat jest podobna do średniej ekspozycji ogólnoustrojowej na tabletki powlekane u dorosłych. Tabletkę do żucia 5 mg należy stosować u dzieci w wieku od 6 do 14 lat, a tabletkę do żucia 4 mg należy stosować u dzieci w wieku od 2 do 5 lat.
dzieci w wieku od 6 do 11 miesięcy ogólnoustrojowa ekspozycja na montelukast i zmienność stężeń montelukastu w osoczu były większe niż obserwowane u dorosłych. Na podstawie analiz populacyjnych średnia wartość AUC (4296 ng•h/ml [zakres 1200 do 7153]) była o 60% wyższa, a średnie Cmax (667 ng/ml [zakres 201 do 1058]) było o 89% wyższe niż obserwowane w dorosłych (średnie AUC 2689 ng•h/ml [zakres 1521 do 4595]) i średnie Cmax (353 ng/ml [zakres 180 do 548]). Ekspozycja ogólnoustrojowa u dzieci w wieku od 12 do 23 miesięcy była mniej zmienna, ale nadal wyższa niż obserwowana u dorosłych. Średnia wartość AUC (3574 ng•h/ml [zakres od 2229 do 5408]) była o 33% wyższa, a średnie Cmax (562 ng/ml [zakres od 296 do 814]) było o 60% wyższe niż obserwowane u dorosłych. Bezpieczeństwo i tolerancja montelukastu w badaniu farmakokinetyki pojedynczej dawki u 26 dzieci w wieku od 6 do 23 miesięcy były podobne jak u pacjentów w wieku 2 lat i starszych [patrz DZIAŁANIA NIEPOŻĄDANE ]. Granulat doustny o mocy 4 mg należy stosować u dzieci w wieku od 12 do 23 miesięcy w leczeniu astmy lub u dzieci w wieku od 6 do 23 miesięcy w leczeniu całorocznego alergicznego nieżytu nosa. Ponieważ doustny preparat w postaci granulatu 4 mg jest biorównoważny z 4 mg tabletką do żucia, można go również stosować jako alternatywny preparat do 4 mg tabletki do żucia u pacjentów pediatrycznych w wieku od 2 do 5 lat.
Badania interakcji leków
Teofilina, prednizon i prednizolon
SINGULAIR podawano z innymi lekami rutynowo stosowanymi w profilaktyce i przewlekłym leczeniu astmy bez widocznego nasilenia działań niepożądanych. W badaniach interakcji leków zalecana dawka kliniczna montelukastu nie miała klinicznie istotnego wpływu na farmakokinetykę następujących leków: teofiliny, prednizonu i prednizolonu.
Montelukast w dawce 10 mg raz na dobę podawany do farmakokinetycznego stanu stacjonarnego nie powodował klinicznie istotnych zmian w kinetyce pojedynczej dawki dożylnej teofiliny [głównie substratu cytochromu P450 (CYP) 1A2). Montelukast w dawkach ≥100 mg na dobę podawanych do farmakokinetycznego stanu stacjonarnego nie powodował żadnych klinicznie istotnych zmian w profilach osoczowych prednizonu lub prednizolonu po podaniu prednizonu doustnie lub dożylnie.
Doustne środki antykoncepcyjne, feksofenadyna, digoksyna i warfaryna
badaniach interakcji leków zalecana dawka kliniczna montelukastu nie miała klinicznie istotnego wpływu na farmakokinetykę następujących leków: doustnych środków antykoncepcyjnych (noretyndron 1 mg/etynyloestradiol 35 mcg), digoksyna i warfaryna. Montelukast w dawkach ≥100 mg na dobę podawanych do farmakokinetycznego stanu stacjonarnego nie zmieniał znacząco stężenia w osoczu żadnego ze składników doustnego środka antykoncepcyjnego zawierającego noretyndron 1 mg/etynyloestradiol 35 µg. Montelukast w dawce 10 mg raz na dobę podawany do farmakokinetycznego stanu stacjonarnego nie zmieniał profilu stężenia feksofenadyny w osoczu, nie zmieniał profilu farmakokinetycznego ani wydalania z moczem immunoreaktywnej digoksyny; nie zmieniły profilu farmakokinetycznego warfaryny (głównie substratu CYP2C9, 3A4 i 1A2) ani nie wpłynęły na wpływ pojedynczej dawki doustnej 30 mg warfaryny na czas protrombinowy lub międzynarodowy współczynnik znormalizowany (INR).
Hormony tarczycy, uspokajające środki nasenne, niesteroidowe środki przeciwzapalne, benzodiazepiny i leki zmniejszające przekrwienie
Chociaż nie przeprowadzono dodatkowych specyficznych badań interakcji, SINGULAIR stosowano jednocześnie z szeroką gamą powszechnie przepisywanych leków w badaniach klinicznych bez dowodów na kliniczne niepożądane interakcje. Leki te obejmowały hormony tarczycy, uspokajające środki nasenne, niesteroidowe środki przeciwzapalne, benzodiazepiny i leki zmniejszające przekrwienie.
Induktory enzymów cytochromu P450 (CYP)
Fenobarbital, który indukuje metabolizm wątrobowy, zmniejszył pole pod krzywą stężenia w osoczu (AUC) montelukastu o około 40% po podaniu pojedynczej dawki 10 mg montelukastu. Nie zaleca się dostosowywania dawki produktu SINGULAIR. Rozsądne jest zastosowanie odpowiedniego monitorowania klinicznego w przypadku równoczesnego podawania z produktem SINGULAIR silnych induktorów enzymów CYP, takich jak fenobarbital lub ryfampicyna.
Wpływ Montelukastu na enzymy cytochromu P450 (CYP)
Montelukast jest silnym inhibitorem CYP2C8 in vitro. Jednak dane z klinicznego badania interakcji między montelukastem i rozyglitazonem (substrat próbny reprezentatywny dla leków metabolizowanych głównie przez CYP2C8) u 12 zdrowych osób wykazały, że farmakokinetyka rozyglitazonu nie zmienia się podczas jednoczesnego podawania tych leków, co wskazuje, że montelukast nie hamuje CYP2C8 in vivo. Dlatego nie przewiduje się, aby montelukast zmieniał metabolizm leków metabolizowanych przez ten enzym (np. paklitaksel, rozyglitazon i repaglinid). W oparciu o dalsze wyniki badań in vitro w mikrosomach wątroby ludzkiej, terapeutyczne stężenia montelukastu w osoczu nie hamują CYP 3A4, 2C9, 1A2, 2A6, 2C19 ani 2D6.
Inhibitory enzymów cytochromu P450 (CYP)
Badania in vitro wykazały, że montelukast jest substratem CYP 2C8, 2C9 i 3A4. Jednoczesne podawanie montelukastu z itrakonazolem, silnym inhibitorem CYP 3A4, nie powodowało istotnego zwiększenia ogólnoustrojowej ekspozycji na montelukast. Dane z klinicznego badania interakcji montelukastu z gemfibrozylem (inhibitorem CYP 2C8 i 2C9) wykazały, że gemfibrozyl w dawce terapeutycznej zwiększał 4,4-krotnie ekspozycję ogólnoustrojową na montelukast. Jednoczesne podawanie itrakonazolu, gemfibrozylu i montelukastu nie zwiększało dalej ogólnoustrojowej ekspozycji na montelukast. W oparciu o dostępne doświadczenie kliniczne nie ma konieczności dostosowywania dawki montelukastu podczas jednoczesnego podawania z gemfibrozylem [patrz PRZEDAWKOWAĆ ].
Studia kliniczne
Astma
Dorośli i młodzież w wieku 15 lat i starsi z astmą
Badania kliniczne z udziałem dorosłych i młodzieży w wieku 15 lat i starszych wykazały, że montelukast w dawkach większych niż 10 mg raz na dobę nie przynosi dodatkowych korzyści klinicznych.
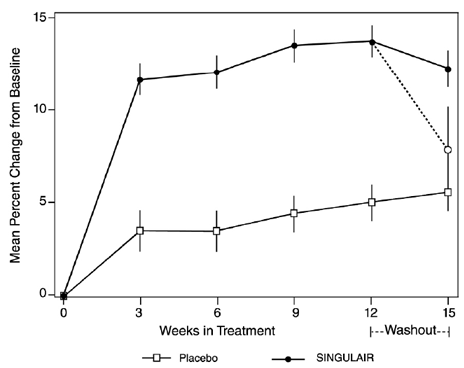
Skuteczność preparatu SINGULAIR w przewlekłym leczeniu astmy u dorosłych i młodzieży w wieku 15 lat i starszych wykazano w dwóch podobnie zaprojektowanych, randomizowanych, 12-tygodniowych badaniach z podwójnie ślepą próbą, kontrolowanych placebo (w USA i w wielu krajach) z udziałem 1576 pacjentów ( 795 leczonych preparatem SINGULAIR, 530 leczonych placebo, a 251 leczonych aktywną kontrolą). Mediana wieku wynosiła 33 lata (zakres od 15 do 85); 56,8% stanowiły kobiety, a 43,2% mężczyźni. Rozkład etniczny/rasowy w tych badaniach wynosił 71,6% rasy białej, 17,7% latynoskiej, 7,2% innego pochodzenia i 3,5% rasy czarnej. Pacjenci cierpieli na astmę łagodną lub umiarkowaną i byli osobami niepalącymi, które wymagały około 5 wziewnych dawek β-agonisty dziennie na podstawie „w razie potrzeby”. U pacjentów średni wyjściowy procent przewidywanej natężonej objętości wydechowej w ciągu 1 sekundy (FEV1) wynosił 66% (przybliżony zakres 40 do 90%). Równorzędnymi pierwszorzędowymi punktami końcowymi w tych badaniach były FEV1 i objawy astmy w ciągu dnia. W obu badaniach po 12 tygodniach losową podgrupę pacjentów otrzymujących SINGULAIR 5 mg zmieniono na placebo na dodatkowe 3 tygodnie leczenia metodą podwójnie ślepej próby w celu oceny możliwego efektu z odbicia.
Wyniki badania w USA dotyczące pierwszorzędowego punktu końcowego, porannego FEV1, wyrażone jako średnia procentowa zmiana w stosunku do wartości wyjściowej uśredniona w ciągu 12-tygodniowego okresu leczenia, przedstawiono na RYC. 2. W porównaniu z placebo, leczenie jedną tabletką SINGULAIR 10 mg na dobę w wieczór spowodował statystycznie istotny wzrost procentowej zmiany FEV1 w stosunku do wartości wyjściowej (zmiana 13,0% w grupie leczonej SINGULAIR 4 mg vs. zmiana 4,2% w grupie placebo, p
Rycina 2: Średnia procentowa zmiana FEV1 od wartości wyjściowej (badanie amerykańskie: SINGULAIR 5 mg N=406; Placebo N=270) (model ANOVA)
Wpływ produktu SINGULAIR 5 mg na inne pierwszorzędowe i drugorzędowe punkty końcowe, reprezentowane przez badanie międzynarodowe, przedstawiono w TABELI 6. Wyniki dotyczące tych punktów końcowych były podobne w badaniu w USA.
obu badaniach oceniano wpływ leku SINGULAIR 4 mg na drugorzędowe punkty końcowe, w tym na atak astmy (wykorzystanie zasobów opieki zdrowotnej, takich jak niezaplanowana wizyta w gabinecie lekarskim, izbie przyjęć lub szpitalu; lub leczenie doustne, dożylne lub kortykosteroid domięśniowy) oraz stosowanie doustnych kortykosteroidów w celu ratowania astmy. W badaniu wielonarodowym znacznie mniej pacjentów (15,6% pacjentów) leczonych produktem SINGULAIR miało napady astmy w porównaniu z pacjentami otrzymującymi placebo (27,3%, p
Początek działania i utrzymanie efektów
W każdym badaniu z grupą kontrolną otrzymującą placebo u dorosłych, efekt leczniczy produktu SINGULAIR 4 mg, mierzony za pomocą parametrów z dziennego dzienniczka, w tym oceny objawów, stosowania β-agonistów „w razie potrzeby” oraz pomiarów PEFR, osiągnięto po podaniu pierwszej dawki i utrzymywało się na stałym poziomie. przez cały okres dawkowania (24 godziny). Nie zaobserwowano istotnej zmiany efektu leczenia podczas ciągłego podawania raz na dobę wieczorem w niekontrolowanych placebo badaniach uzupełniających przez okres do jednego roku. Odstawienie leku SINGULAIR 4 mg u chorych na astmę po 12 tygodniach ciągłego stosowania nie spowodowało pogorszenia astmy z odbicia.
Pacjenci pediatryczni w wieku od 6 do 14 lat z astmą
Skuteczność produktu SINGULAIR 5 mg u dzieci w wieku od 6 do 14 lat wykazano w jednym 8-tygodniowym badaniu z podwójnie ślepą próbą, kontrolowanym placebo z udziałem 336 pacjentów (201 leczonych SINGULAIR i 135 leczonych placebo) stosujących wziewny β-agonista na zasadzie „w razie potrzeby”. U pacjentów średni wyjściowy procent przewidywanej wartości FEV1 wynosił 72% (przybliżony zakres 45 do 90%) i średnie dzienne zapotrzebowanie na β-agonistę wziewnego wynoszące 3,4 inhalacji albuterolu. Około 36% pacjentów otrzymywało kortykosteroidy wziewne. Mediana wieku wynosiła 11 lat (zakres od 6 do 15); 35,4% stanowiły kobiety, a 64,6% mężczyźni. Rozkład etniczny/rasowy w tym badaniu wynosił 80,1% rasy białej, 12,8% rasy czarnej, 4,5% latynoskiej i 2,7% innego pochodzenia.
porównaniu z placebo, leczenie jedną tabletką do rozgryzania i żucia 5 mg SINGULAIR 4 mg na dobę spowodowało znaczną poprawę średniej procentowej zmiany FEV1 porannej w stosunku do wartości wyjściowej (8,7% w grupie leczonej SINGULAIR 4 mg w porównaniu z 4,2% zmianą w stosunku do wartości wyjściowej w grupie placebo, p
Podobnie jak w badaniach z udziałem dorosłych, nie zaobserwowano istotnej zmiany efektu leczenia podczas ciągłego podawania raz na dobę w jednym otwartym badaniu rozszerzonym bez jednoczesnej grupy placebo przez okres do 6 miesięcy.
Pacjenci pediatryczni w wieku od 2 do 5 lat z astmą
Skuteczność preparatu SINGULAIR w przewlekłym leczeniu astmy u dzieci i młodzieży w wieku od 2 do 5 lat badano w 12-tygodniowym, kontrolowanym placebo badaniu bezpieczeństwa i tolerancji u 689 pacjentów, z których 461 było leczonych preparatem SINGULAIR. Mediana wieku wynosiła 4 lata (zakres od 2 do 6); 41,5% stanowiły kobiety, a 58,5% mężczyźni. Rozkład etniczny/rasowy w tym badaniu wynosił 56,5% rasy białej, 20,9% latynoskiej, 14,4% innego pochodzenia i 8,3% rasy czarnej.
Chociaż głównym celem było określenie bezpieczeństwa i tolerancji produktu SINGULAIR 10 mg w tej grupie wiekowej, badanie obejmowało rozpoznawcze oceny skuteczności, w tym ocenę objawów astmy w ciągu dnia i nocy, stosowanie beta-mimetyków, ratowanie doustnymi kortykosteroidami oraz ogólną ocenę lekarza. Wyniki tych eksploracyjnych ocen skuteczności wraz z farmakokinetyką i ekstrapolacją danych dotyczących skuteczności uzyskanych od starszych pacjentów potwierdzają ogólny wniosek, że SINGULAIR jest skuteczny w leczeniu podtrzymującym astmy u pacjentów w wieku od 2 do 5 lat.
Wpływ u pacjentów przyjmujących jednocześnie kortykosteroidy wziewne
W oddzielnych badaniach z udziałem dorosłych oceniano zdolność produktu SINGULAIR 10 mg do nasilenia działania klinicznego kortykosteroidów wziewnych i umożliwienia zmniejszenia dawki kortykosteroidów wziewnych podczas jednoczesnego stosowania.
Do jednego randomizowanego, kontrolowanego placebo badania w grupach równoległych (n=226) włączono dorosłych ze stabilną astmą ze średnią FEV1 około 84% przewidywanej, którzy wcześniej otrzymywali różne wziewne kortykosteroidy (dostarczane za pomocą inhalatorów aerozolowych lub proszkowych ). Mediana wieku wyniosła 41,5 roku (zakres od 16 do 70); 52,2% stanowiły kobiety, a 47,8% mężczyźni. Rozkład etniczny/rasowy w tym badaniu wynosił 92,0% rasy kaukaskiej, 3,5% rasy czarnej, 2,2% latynoskiej i 2,2% azjatyckiej. Rodzaje kortykosteroidów wziewnych i ich średnie zapotrzebowanie wyjściowe obejmowały dipropionian beklometazonu (średnia dawka 1203 μg/dobę), acetonid triamcynolonu (średnia dawka 2004 μg/dobę), flunizolid (średnia dawka 1971 μg/dobę), propionian flutykazonu (średnia dawka 1083 mcg/dobę) lub budezonid (średnia dawka 1192 mcg/dobę). Niektóre z tych wziewnych kortykosteroidów były preparatami niezatwierdzonymi w USA, a wyrażone dawki mogą nie być wyzwalające. Zapotrzebowanie na kortykosteroidy wziewne przed badaniem zmniejszyło się o około 37% podczas 5- do 7-tygodniowego okresu wstępnego z placebo, którego celem było dostosowanie pacjentów do najniższej skutecznej dawki wziewnego kortykosteroidu. Leczenie produktem SINGULAIR 4 mg spowodowało dalsze 47% zmniejszenie średniej dawki wziewnego kortykosteroidu w porównaniu ze średnim zmniejszeniem o 30% w grupie placebo w ciągu 12-tygodniowego okresu aktywnego leczenia (p≤0,05). Nie wiadomo, czy wyniki tego badania można uogólnić na pacjentów z astmą, którzy wymagają większych dawek kortykosteroidów wziewnych lub kortykosteroidów ogólnoustrojowych.
innym randomizowanym, kontrolowanym placebo badaniu w grupach równoległych (n=642) w podobnej populacji dorosłych pacjentów, którym wcześniej leczono wziewne kortykosteroidy, ale nie były one odpowiednio kontrolowane (beklometazon 336 µg/dobę), dodanie SINGULAIR do beklometazonu spowodowało statystycznie znamiennej poprawy FEV1 w porównaniu z pacjentami, którzy kontynuowali leczenie samym beklometazonem lub z pacjentami, którym odstawiono beklometazon i leczono tylko montelukastem lub placebo w ciągu ostatnich 10 tygodni 16-tygodniowego okresu leczenia zaślepionego. Pacjenci przydzieleni losowo do ramion leczenia zawierających beklometazon mieli statystycznie istotnie lepszą kontrolę astmy niż pacjenci przydzieleni losowo do grupy SINGULAIR w monoterapii lub w monoterapii, na co wskazywało FEV1, objawy astmy w ciągu dnia, PEFR, nocne wybudzenia z powodu astmy i „w razie potrzeby” β- wymagania agonistyczne.
dorosłych pacjentów z astmą z udokumentowaną wrażliwością na aspirynę, z których prawie wszyscy otrzymywali jednocześnie kortykosteroidy wziewne i (lub) doustne, 4-tygodniowe, randomizowane badanie w grupach równoległych (n=80) wykazało, że SINGULAIR 10 mg w porównaniu z placebo w znaczącej poprawie parametrów kontroli astmy. Siła działania produktu SINGULAIR 4 mg u pacjentów wrażliwych na aspirynę była podobna do działania obserwowanego w ogólnej populacji badanych pacjentów z astmą. Nie oceniano wpływu produktu SINGULAIR na odpowiedź skurczu oskrzeli na aspirynę lub inne niesteroidowe leki przeciwzapalne u pacjentów z astmą wrażliwą na aspirynę [patrz OSTRZEŻENIA I ŚRODKI ].
Zwężenie oskrzeli wywołane wysiłkiem fizycznym (EIB)
Zwężenie oskrzeli wywołane wysiłkiem fizycznym (dorośli, młodzież i dzieci w wieku 6 lat i starsze)
Skuteczność SINGULAIR 5 mg, 10 mg, podawanego w pojedynczej dawce 2 godziny przed wysiłkiem fizycznym w zapobieganiu EIB, była badana w trzech (USA i międzynarodowe), randomizowanych, podwójnie zaślepionych, kontrolowanych placebo badaniach naprzemiennych, obejmujących łącznie 160 dorosłych i młodzieży w wieku 15 lat i starszych z EIB. Test wysiłkowy przeprowadzono po 2 godzinach, 8,5 lub 12 godzinach i 24 godzinach po podaniu pojedynczej dawki badanego leku (SINGULAIR 10 mg lub placebo). Pierwszorzędowym punktem końcowym był średni maksymalny procentowy spadek FEV1 po prowokacji wysiłkowej 2 godziny po podaniu dawki we wszystkich trzech badaniach (Badanie A, Badanie B i Badanie C). W badaniu A pojedyncza dawka preparatu SINGULAIR 10 mg wykazała statystycznie istotną korzyść ochronną przed EIB, gdy została przyjęta 2 godziny przed wysiłkiem. Niektórzy pacjenci byli chronieni przed EIB po 8,5 i 24 godzinach po podaniu; jednak niektórzy pacjenci nie. Wyniki dla średniego maksymalnego procentowego spadku w każdym punkcie czasowym w badaniu A przedstawiono w TABELI 7 i są reprezentatywne dla wyników z pozostałych dwóch badań.
Skuteczność tabletek do rozgryzania i żucia SINGULAIR 5 mg, podawanego w pojedynczej dawce 2 godziny przed wysiłkiem fizycznym w zapobieganiu EIB, zbadano w jednym międzynarodowym, pacjentów w wieku od 6 do 14 lat z EIB. Próbę wysiłkową przeprowadzono 2 godziny i 24 godziny po podaniu pojedynczej dawki badanego leku (SINGULAIR 5 mg lub placebo). Pierwszorzędowym punktem końcowym był średni maksymalny procentowy spadek FEV1 po 2 godzinach od podania dawki prowokacyjnej. Pojedyncza dawka SINGULAIR 5 mg wykazała statystycznie istotną korzyść ochronną przeciwko EIB, gdy została przyjęta 2 godziny przed wysiłkiem (TABELA 8). Podobne wyniki uzyskano 24 godziny po podaniu (drugorzędowy punkt końcowy). Niektórzy pacjenci byli chronieni przed EIB w 24 godziny po podaniu; jednak niektórzy pacjenci nie byli. Nie oceniano żadnych punktów czasowych między 2 a 24 godziną po podaniu.
Nie ustalono skuteczności produktu SINGULAIR 5 mg w zapobieganiu EIB u pacjentów w wieku poniżej 6 lat.
Nie ustalono, aby dobowe podawanie produktu SINGULAIR 4 mg w przewlekłym leczeniu astmy zapobiegało ostrym epizodom EIB.
12-tygodniowym, randomizowanym badaniu z podwójnie ślepą próbą, prowadzonym w grupach równoległych, obejmującym 110 dorosłych i nastoletnich astmatyków w wieku 15 lat i starszych, ze średnią wyjściową FEV1 procent przewidywanych 83% i z udokumentowanym zaostrzeniem astmy wywołanym wysiłkiem fizycznym, leczenie z SINGULAIR w dawce 10 mg raz na dobę wieczorem skutkowało statystycznie istotnym zmniejszeniem średniego maksymalnego procentowego spadku FEV1 i średniego czasu do powrotu do poziomu 5% przed treningiem FEV1. Prowokację wysiłkową przeprowadzono pod koniec przerwy w dawkowaniu (tj. 20 do 24 godzin po poprzedniej dawce). Efekt ten utrzymywał się przez cały 12-tygodniowy okres leczenia, co wskazuje, że tolerancja nie wystąpiła. SINGULAIR 4 mg nie zapobiegł jednak klinicznie istotnemu pogorszeniu maksymalnego procentowego spadku FEV1 po wysiłku (tj. ≥20% zmniejszeniu w stosunku do stanu wyjściowego przed treningiem) u 52% badanych pacjentów. W oddzielnym badaniu krzyżowym u osób dorosłych podobny efekt zaobserwowano po dwóch dawkach 10 mg raz na dobę preparatu SINGULAIR.
pacjentów pediatrycznych w wieku od 6 do 14 lat, stosujących tabletki do żucia 5 mg, w dwudniowym badaniu krzyżowym wykazano efekty podobne do obserwowanych u dorosłych, gdy pod koniec przerwy w dawkowaniu przeprowadzono prowokację wysiłkową (tj. 20 do 24 godzin). godzin po poprzedniej dawce).
Alergiczny nieżyt nosa (sezonowy i całoroczny)
Sezonowy alergiczny nieżyt nosa
Skuteczność tabletek SINGULAIR w leczeniu sezonowego alergicznego nieżytu nosa była badana w 5 podobnie zaprojektowanych, randomizowanych, podwójnie zaślepionych, równoległych badaniach kontrolowanych placebo i substancją czynną (loratadyna) przeprowadzonych w Ameryce Północnej. Do 5 badań włączono łącznie 5029 pacjentów, z których 1799 było leczonych tabletkami SINGULAIR. Pacjenci byli w wieku od 15 do 82 lat z sezonowym alergicznym zapaleniem błony śluzowej nosa w wywiadzie, dodatnim wynikiem testu skórnego na co najmniej jeden istotny alergen sezonowy i aktywnymi objawami sezonowego alergicznego nieżytu nosa w momencie włączenia do badania.
Okres randomizowanego leczenia wynosił 2 tygodnie w 4 badaniach i 4 tygodnie w jednym badaniu. Pierwszorzędową zmienną wyniku była średnia zmiana w stosunku do wartości wyjściowej w punktacji objawów ze strony nosa w ciągu dnia (średnia indywidualnych wyników dotyczących przekrwienia błony śluzowej nosa, wycieku z nosa, swędzenia nosa, kichania) ocenianych przez pacjentów w skali kategorycznej 0-3.
czterech z pięciu badań wykazano istotne zmniejszenie nasilenia objawów ze strony nosa w ciągu dnia po zastosowaniu leku SINGULAIR w postaci tabletek 10 mg w porównaniu z placebo. Wyniki jednego badania przedstawiono poniżej. Mediana wieku w tym badaniu wyniosła 35,0 lat (zakres od 15 do 81); 65,4% stanowiły kobiety, a 34,6% mężczyźni. Rozkład etniczny/rasowy w tym badaniu wynosił 83,1% rasy białej, 6,4% innego pochodzenia, 5,8% rasy czarnej i 4,8% latynoskiej. W TABELI 9 przedstawiono średnie zmiany w stosunku do wartości wyjściowej w ocenie objawów ze strony nosa w ciągu dnia w grupach leczonych, które otrzymywały SINGULAIR 4 mg tabletki, loratadynę i placebo. Pozostałe trzy badania, w których wykazano skuteczność, wykazały podobne wyniki. Wykazano skuteczność sezonowego alergicznego nieżytu nosa, gdy montelukast podawano rano lub wieczorem.
Całoroczny alergiczny nieżyt nosa
Skuteczność tabletek SINGULAIR 5 mg w leczeniu całorocznego alergicznego zapalenia błony śluzowej nosa badano w 2 randomizowanych badaniach z podwójnie ślepą próbą, kontrolowanych placebo, przeprowadzonych w Ameryce Północnej i Europie. Do dwóch badań włączono łącznie 3357 pacjentów, z których 1632 otrzymywało tabletki SINGULAIR 10 mg. Pacjenci w wieku od 15 do 82 lat z całorocznym alergicznym zapaleniem błony śluzowej nosa potwierdzonym wywiadem i dodatnim wynikiem testu skórnego na co najmniej jeden istotny całoroczny alergen (roztocza kurzu domowego, sierść zwierząt i/lub zarodniki pleśni), którzy mieli aktywne objawy w czasie badania wpis, zostali zapisani.
badaniu, w którym wykazano skuteczność, mediana wieku wynosiła 35 lat (zakres od 15 do 81); 64,1% stanowiły kobiety, a 35,9% mężczyźni. Rozkład etniczny/rasowy w tym badaniu wynosił 83,2% rasy białej, 8,1% rasy czarnej, 5,4% latynoskiej, 2,3% azjatyckiej i 1,0% innego pochodzenia. Wykazano, że SINGULAIR 10 mg tabletki raz na dobę znacząco zmniejsza objawy całorocznego alergicznego nieżytu nosa w ciągu 6-tygodniowego okresu leczenia (TABELA 10); w tym badaniu pierwszorzędową zmienną wyniku była średnia zmiana w stosunku do wartości wyjściowej w punktacji objawów ze strony nosa w ciągu dnia (średnia indywidualnych ocen przekrwienia błony śluzowej nosa, wycieku z nosa i kichania).
innym 6-tygodniowym badaniu oceniano SINGULAIR 10 mg (n=626), placebo (n=609) i substancję kontrolną (cetyryzyna 10 mg; n=120). W analizie pierwotnej porównywano średnią zmianę od wartości wyjściowej w punktacji objawów ze strony nosa w ciągu dnia dla produktu SINGULAIR w porównaniu z placebo w ciągu pierwszych 4 tygodni leczenia; badanie nie zostało zaprojektowane do statystycznego porównania między SINGULAIR i aktywną kontrolą. Pierwszorzędowa zmienna wyniku obejmowała swędzenie nosa oraz przekrwienie błony śluzowej nosa, wyciek z nosa i kichanie. Szacowana różnica między SINGULAIR a placebo wyniosła -0,04 przy 95% CI (-0,09; 0,01). Szacowana różnica między aktywną kontrolą a placebo wyniosła -0,10 przy 95% CI (-0,19, -0,01).
INFORMACJA O PACJENCIE
SINGULAIR® (SING-u-lair)(montelukast sodu) tabletki do żucia
Jakie są najważniejsze informacje, które powinienem wiedzieć o SINGULAIR 4mg?Poważne problemy ze zdrowiem psychicznym wystąpiły u osób przyjmujących SINGULAIR lub nawet po zakończeniu leczenia.
Może się to zdarzyć u osób z historią problemów ze zdrowiem psychicznym lub bez. Należy przerwać stosowanie leku SINGULAIR i natychmiast poinformować lekarza, jeśli u pacjenta lub dziecka wystąpią jakiekolwiek nietypowe zmiany w zachowaniu lub myśleniu, w tym którykolwiek z poniższych objawów:
- pobudzenie, w tym zachowanie agresywne lub wrogość
- problemy z uwagą
- złe lub żywe sny
- depresja
- dezorientacja (dezorientacja)
- czuję się niespokojny
- drażliwość
- halucynacje (widzenie lub słyszenie rzeczy, których tak naprawdę nie ma)
- problemy z pamięcią
- objawy obsesyjno-kompulsywne
- niepokój
- Lunatykowanie
- jąkanie
- myśli i działania samobójcze (w tym samobójstwo)
- drżenie
- problemy ze snem
- niekontrolowane ruchy mięśni
Co to jest SINGULAIR 10mg?
SINGULAIR 4mg to lek na receptę, który blokuje w organizmie substancje zwane leukotrienami. Może to pomóc złagodzić objawy astmy i zapalenia błony śluzowej nosa (alergiczny nieżyt nosa). SINGULAIR nie zawiera sterydów. SINGULAIR służy do:
- alergie zewnętrzne występujące w ciągu roku (sezonowy alergiczny nieżyt nosa) u dorosłych i dzieci w wieku 2 lat i starszych, oraz
- alergie wewnętrzne występujące przez cały rok (całoroczny alergiczny nieżyt nosa) u dorosłych i dzieci w wieku 6 miesięcy i starszych.
Nie rób SINGULAIR należy stosować w przypadku uczulenia na którykolwiek z jego składników. Pełna lista składników preparatu SINGULAIR znajduje się na końcu niniejszego Przewodnika po lekach.
Przed przyjęciem leku SINGULAIR 4 mg należy poinformować lekarza o wszystkich swoich chorobach, w tym o:
- są uczuleni na aspirynę.
- mieć fenyloketonurię. Tabletki do żucia SINGULAIR zawierają aspartam, źródło fenyloalaniny.
- masz lub miałeś problemy ze zdrowiem psychicznym.
- są w ciąży lub planują zajść w ciążę. Porozmawiaj z lekarzem, jeśli jesteś w ciąży lub planujesz zajść w ciążę, SINGULAIR 4mg może nie być dla Ciebie odpowiedni.
- karmisz piersią lub planujesz karmić piersią. Nie wiadomo, czy SINGULAIR przenika do mleka matki. Porozmawiaj z lekarzem o najlepszym sposobie karmienia dziecka podczas przyjmowania leku SINGULAIR.
Poinformuj swojego lekarza o wszystkich przyjmowanych lekach, w tym o lekach na receptę i bez recepty, witaminach i suplementach ziołowych. Niektóre leki mogą wpływać na działanie leku SINGULAIR lub SINGULAIR 4 mg może wpływać na działanie innych leków.
Jak powinienem przyjmować SINGULAIR 10mg?
Do ktokolwiek kto bierze SINGULAIR:
- Przeczytaj szczegółowe informacje Instrukcja użycia który jest dostarczany z granulatem doustnym SINGULAIR.
- SINGULAIR 4 mg należy przyjmować dokładnie zgodnie z zaleceniami lekarza. Twój lekarz poinformuje Cię, ile leku SINGULAIR należy przyjąć, oraz kiedy to wziąć.
- Należy przerwać przyjmowanie leku SINGULAIR 5 mg i natychmiast poinformować lekarza, jeśli u pacjenta lub dziecka wystąpią jakiekolwiek nietypowe zmiany w zachowaniu lub myśleniu.
- Lek SINGULAIR 5 mg można przyjmować z jedzeniem lub bez jedzenia. Zobacz sekcję „Jak mogę podać dziecku SINGULAIR granulat doustny?” w Instrukcja użycia w celu uzyskania informacji o tym, jakie pokarmy i płyny można przyjmować razem z SINGULAIR 10 mg granulat doustny.
- przypadku pominięcia dawki leku SINGULAIR przez pacjenta lub dziecko, należy przyjąć następną dawkę o zwykłej porze. Nie należy przyjmować 2 dawek jednocześnie.
- Jeśli zażyjesz za dużo SINGULAIR, natychmiast skontaktuj się z lekarzem.
Dla dorosłych i dzieci w wieku 12 miesięcy i starszych z astmą:
- SINGULAIR należy przyjmować 1 raz dziennie wieczorem. Kontynuuj przyjmowanie leku SINGULAIR 5 mg codziennie tak długo, jak zaleci to lekarz, nawet jeśli nie występują objawy astmy.
- Należy natychmiast poinformować lekarza, jeśli objawy astmy nasilą się lub jeśli konieczne będzie częstsze stosowanie inhalatora ratunkowego w przypadku napadów astmy.
- Na wypadek ataków astmy należy zawsze mieć przy sobie inhalator ratunkowy.
- Kontynuuj przyjmowanie innych leków na astmę zgodnie z zaleceniami lekarza, chyba że lekarz zaleci zmianę sposobu przyjmowania tych leków.
Dla osób w wieku 6 lat i starszych w profilaktyce astmy wysiłkowej:
- SINGULAIR należy przyjmować co najmniej 2 godziny przed treningiem.
- Na wypadek ataków astmy należy zawsze mieć przy sobie inhalator ratunkowy.
- Jeśli pacjent przyjmuje SINGULAIR 10 mg codziennie w leczeniu przewlekłej astmy lub alergicznego nieżytu nosa, nie rób przyjąć kolejną dawkę, aby zapobiec astmie wywołanej wysiłkiem fizycznym. Porozmawiaj ze swoim lekarzem o leczeniu astmy wysiłkowej.
- Nie należy przyjmować 2 dawek SINGULAIR 5 mg w ciągu 24 godzin (1 dzień).
Dla osób w wieku 2 lat i starszych z sezonowym alergicznym nieżytem nosa lub dla osób w wieku 6 miesięcy i starszych z całorocznym alergicznym nieżytem nosa:
- SINGULAIR należy przyjmować 1 raz dziennie, o tej samej porze każdego dnia.
Czego powinienem unikać podczas stosowania SINGULAIR 10mg?
Jeśli u pacjenta występuje astma, a aspiryna nasila objawy astmy, należy nadal unikać przyjmowania aspiryny lub innych leków zwanych niesteroidowymi lekami przeciwzapalnymi (NLPZ) podczas przyjmowania leku SINGULAIR.
Jakie są możliwe skutki uboczne SINGULAIR?
SINGULAIR może powodować poważne działania niepożądane, w tym:
- Widzieć „Jakie są najważniejsze informacje, które powinienem wiedzieć o SINGULAIR 4mg?”
- Zwiększenie liczby niektórych białych krwinek (eozynofili) i możliwy stan zapalny naczyń krwionośnych w całym ciele (układowe zapalenie naczyń). Rzadko może się to zdarzyć u osób z astmą przyjmujących SINGULAIR. Czasami zdarza się to u osób, które również przyjmują doustnie lek steroidowy, który jest odstawiany lub dawka jest zmniejszana.
Poinformuj natychmiast swojego lekarza, jeśli wystąpi jeden lub więcej z tych objawów:
- uczucie mrowienia lub drętwienia rąk lub nóg
- choroba grypopodobna
- wysypka
- ciężkie zapalenie (ból i obrzęk) zatok (zapalenie zatok)
Do najczęstszych działań niepożądanych SINGULAIR należą:
- zakażenie górnych dróg oddechowych
- gorączka
- ból głowy
- ból gardła
- kaszel
- ból brzucha
- biegunka
- ból ucha lub infekcja ucha
- grypa
- katar
- infekcja zatok
To nie wszystkie możliwe działania niepożądane leku SINGULAIR. Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Jak przechowywać SINGULAIR?
- Przechowywać SINGULAIR 10 mg w temperaturze pokojowej między 68 ° F do 77 ° F (20 ° C do 25 ° C).
- Przechowywać SINGULAIR 4 mg w opakowaniu, w którym się znajduje.
- Przechowywać SINGULAIR 4 mg w suchym miejscu i chronić przed światłem.
- Przechowywać SINGULAIR i wszystkie leki w miejscu niedostępnym dla dzieci.
Ogólne informacje o bezpiecznym i skutecznym stosowaniu SINGULAIR.
Leki są czasami przepisywane do celów innych niż wymienione w Przewodniku po lekach. Nie stosować leku SINGULAIR w stanach, na które nie został przepisany. Nie należy podawać leku SINGULAIR innym osobom, nawet jeśli mają te same objawy, co Ty. Może im to zaszkodzić.
Możesz poprosić farmaceutę lub lekarza o informacje na temat SINGULAIR 10 mg, który jest przeznaczony dla pracowników służby zdrowia.
Jakie są składniki SINGULAIR?
Składnik czynny: montelukast sodu
Nieaktywne składniki:
- Granulat doustny 4 mg: mannitol, hydroksypropyloceluloza i stearynian magnezu.
- Tabletki do żucia 4 mg i 5 mg: mannitol, celuloza mikrokrystaliczna, hydroksypropyloceluloza, czerwony tlenek żelaza, kroskarmeloza sodowa, aromat wiśniowy, aspartam, stearynian magnezu.
- Osoby z fenyloketonurią: SINGULAIR 4 mg tabletki do żucia zawierają 0,674 mg fenyloalaniny i SINGULAIR tabletki do żucia 5 mg zawierają 0,842 mg fenyloalaniny.
- Tabletka 10 mg: celuloza mikrokrystaliczna, laktoza jednowodna, kroskarmeloza sodowa, hydroksypropyloceluloza i stearynian magnezu. Powłoka zawiera: hydroksypropylometylocelulozę, hydroksypropylocelulozę, dwutlenek tytanu, czerwony tlenek żelazowy, żółty tlenek żelazowy i wosk Carnauba.
Instrukcja użycia
SINGULAIR® (SING-u-lair) (montelukast sodu) granulat doustny
Niniejsza instrukcja użytkowania zawiera informacje dotyczące stosowania leku SINGULAIR 10 mg granulat doustny.
Ważna informacja:
- Przed podaniem dawki granulatu doustnego SINGULAIR należy zapoznać się z niniejszą instrukcją użycia, aby upewnić się, że granulat doustny został prawidłowo przygotowany i podany.
- Podawaj dziecku SINGULAIR granulat doustny zgodnie z zaleceniami lekarza.
- Przestań podawać SINGULAIR 5 mg i natychmiast poinformuj swojego lekarza, jeśli dziecko ma jakiekolwiek nietypowe zmiany w zachowaniu lub myśleniu.
- Kontynuuj podawanie dziecku leków na astmę zgodnie z zaleceniami, chyba że Twój lekarz zaleci zmianę sposobu podawania tych leków.
- SINGULAIR 5 mg granulat doustny można podawać z jedzeniem lub bez jedzenia.
Jak mogę podać dziecku SINGULAIR 4 mg granulat doustny?
- Nie rób otwórz opakowanie, aż będzie gotowe do użycia.
- Istnieją różne sposoby podawania leku SINGULAIR 4 mg granulat doustny. Powinieneś wybrać najlepszą metodę dla swojego dziecka:
- prosto w usta
- rozpuścić w 1 łyżeczce (5 ml) zimnego lub o temperaturze pokojowej odżywki dla niemowląt lub mleka matki
- zmieszaj z 1 łyżką jednego z następujących miękkich pokarmów w temperaturze zimnej lub pokojowej: mus jabłkowy, puree z marchwi, ryż lub lody.
- Podaj dziecku całą mieszankę w ciągu 15 minut.
- Nie przechowywać resztek mieszaniny SINGULAIR (granulek doustny zmieszany z jedzeniem, mlekiem dla niemowląt lub mlekiem matki) do późniejszego użycia. Wyrzuć niewykorzystaną część.
- Nie mieszać SINGULAIR granulatu doustnego z płynnym napojem innym niż mieszanka dla niemowląt lub mleko matki. Twoje dziecko może pić inne płyny po połknięciu mieszanki.
Jak przechowywać SINGULAIR 5mg?
- Przechowywać SINGULAIR 4 mg w temperaturze pokojowej między 68 ° F do 77 ° F (20 ° C do 25 ° C).
- Przechowuj SINGULAIR w opakowaniu, w którym się znajduje.
- Przechowywać SINGULAIR 5 mg w suchym miejscu i chronić przed światłem.
- Przechowywać SINGULAIR i wszystkie leki w miejscu niedostępnym dla dzieci.
Niniejsza instrukcja użytkowania została zatwierdzona przez amerykańską Agencję ds. Żywności i Leków
