Arimidex 1mg Anastrozole Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Arimidex i jak się go stosuje?
Arimidex 1mg to lek na receptę stosowany w leczeniu objawów raka piersi u kobiet po menopauzie. Arimidex może być stosowany samodzielnie lub z innymi lekami.
Arimidex należy do klasy leków zwanych antyneoplastycznymi, inhibitorami aromatazy.
Nie wiadomo, czy Arimidex jest bezpieczny i skuteczny u dzieci.
Jakie są możliwe skutki uboczne Arimidexu?
Arimidex może powodować poważne skutki uboczne, w tym:
- duszność,
- struktura kości,
- obrzęk gruczołów,
- mdłości,
- ból w górnej części brzucha,
- swędzący,
- zmęczenie,
- utrata apetytu,
- ciemny mocz,
- stołki w kolorze gliny,
- zażółcenie skóry lub oczu (żółtaczka),
- nagłe drętwienie lub osłabienie (zwłaszcza po jednej stronie ciała),
- nagły silny ból głowy,
- bełkotliwa wymowa,
- problemy ze wzrokiem lub równowagą,
- gorączka,
- ból gardła,
- obrzęk twarzy lub języka,
- płonący w twoich oczach,
- ból skóry i
- czerwona lub fioletowa wysypka skórna, która rozprzestrzenia się (zwłaszcza na twarzy lub górnej części ciała) z powstawaniem pęcherzy i łuszczeniem się
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Do najczęstszych skutków ubocznych Arimidex należą:
- słabość,
- uderzenia gorąca,
- uczucie drętwienia lub mrowienia w skórze,
- obrzęk kostek lub stóp,
- ból lub sztywność stawów,
- problemy z palcami podczas chwytania,
- ból gardła,
- ból głowy,
- ból pleców,
- ból kości,
- depresja,
- zmiany nastroju,
- problemy ze snem (bezsenność),
- wysokie ciśnienie krwi,
- silny ból głowy,
- rozmazany obraz,
- walenie w szyję lub uszy,
- mdłości,
- wymioty i
- łagodna wysypka
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Arimidexu. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OPIS
Tabletki ARIMIDEX (anastrozol) do podawania doustnego zawierają 1 mg anastrozolu, niesteroidowego inhibitora aromatazy. Jest on chemicznie opisywany jako 1,3-benzenodiacetonitryl, a, a, a', a'-tetrametylo-5-(1H-1,2,4-triazol-1-ilometyl). Jego wzór cząsteczkowy to C17H19N5, a jego wzór strukturalny to:
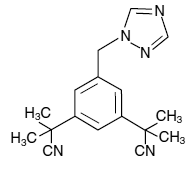
Anastrozol to białawy proszek o masie cząsteczkowej 293,4. Anastrozol ma umiarkowaną rozpuszczalność w wodzie (0,5 mg/ml w 25°C); rozpuszczalność jest niezależna od pH w zakresie fizjologicznym. Anastrozol jest dobrze rozpuszczalny w metanolu, acetonie, etanolu i tetrahydrofuranie i bardzo dobrze rozpuszczalny w acetonitrylu.
Każda tabletka zawiera jako składniki nieaktywne: laktozę, stearynian magnezu, hydroksypropylometylocelulozę, glikol polietylenowy, powidon, glikolan sodowy skrobi i dwutlenek tytanu.
WSKAZANIA
Leczenie uzupełniające
ARIMIDEX jest wskazany w leczeniu uzupełniającym kobiet po menopauzie z wczesnym rakiem piersi z obecnością receptorów hormonalnych.
Leczenie pierwszej linii
ARIMIDEX 1 mg jest wskazany do leczenia pierwszego rzutu u kobiet po menopauzie z rakiem piersi z dodatnim receptorem hormonalnym lub nieznanym receptorem hormonalnym, miejscowo zaawansowanym lub z przerzutami.
Leczenie drugiej linii
ARIMIDEX 1 mg jest wskazany w leczeniu zaawansowanego raka piersi u kobiet po menopauzie z progresją choroby po leczeniu tamoksyfenem. Pacjenci z chorobą ER-ujemną oraz pacjenci, którzy nie reagowali na wcześniejsze leczenie tamoksyfenem, rzadko reagowali na ARIMIDEX.
DAWKOWANIE I SPOSÓB PODAWANIA
Zalecana dawka
Dawka leku ARIMIDEX to jedna tabletka 1 mg przyjmowana raz na dobę. U pacjentek z zaawansowanym rakiem piersi należy kontynuować podawanie produktu ARIMIDEX 1 mg do progresji nowotworu. ARIMIDEX można przyjmować z posiłkiem lub bez posiłku.
W leczeniu uzupełniającym wczesnego raka piersi u kobiet po menopauzie optymalny czas trwania terapii nie jest znany. W badaniu ATAC ARIMIDEX 1 mg podawano przez pięć lat [patrz Studia kliniczne ].
Nie ma konieczności dostosowania dawkowania u pacjentów z zaburzeniami czynności nerek lub u pacjentów w podeszłym wieku [patrz Używaj w określonych populacjach ].
Pacjenci z niewydolnością wątroby
Nie zaleca się zmiany dawki u pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby. ARIMIDEX nie był badany u pacjentów z ciężkimi zaburzeniami czynności wątroby [patrz Stosowanie w określonych populacjach ].
JAK DOSTARCZONE
Formy dawkowania i mocne strony
Tabletki są białe, obustronnie wypukłe, powlekane zawierające 1 mg anastrozolu. Tabletki są wytłoczone z jednej strony logo składającego się z litery „A” (wielka litera) z grotem strzałki przymocowanym do stopy wysuniętej prawej nogi „A”, a na odwrocie z oznaczeniem mocy tabletki „Adx 1 ”.
Składowania i stosowania
Tabletki te są dostarczane w butelkach po 30 tabletek ( NDC 0310-0201-30).
Magazynowanie
Przechowywać w kontrolowanej temperaturze pokojowej, 20-25°C (68-77°F) [patrz USP ].
Dystrybutor: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Aktualizacja: maj 2014
SKUTKI UBOCZNE
Ciężkie działania niepożądane związane ze stosowaniem preparatu ARIMIDEX występujące u mniej niż 1 pacjenta na 10 000 to: 1) reakcje skórne, takie jak zmiany skórne, owrzodzenia lub pęcherze; 2) reakcje alergiczne z obrzękiem twarzy, ust, języka i/lub gardła. Może to powodować trudności w połykaniu i/lub oddychaniu; oraz 3) zmiany w wynikach badań krwi dotyczących czynności wątroby, w tym zapalenie wątroby z objawami, które mogą obejmować ogólne złe samopoczucie, z żółtaczką lub bez, bólem wątroby lub obrzękiem wątroby.
Do częstych działań niepożądanych (występujących z częstością ≥ 10%) u kobiet przyjmujących ARIMIDEX 1 mg należą: uderzenia gorąca, osłabienie, zapalenie stawów, ból, ból stawów, nadciśnienie, depresja, nudności i wymioty, wysypka, osteoporoza, złamania, ból pleców, bezsenność, ból głowy, ból kości, obrzęki obwodowe, nasilony kaszel, duszność, zapalenie gardła i obrzęk limfatyczny.
badaniu ATAC najczęściej zgłaszanym działaniem niepożądanym (>0,1%) prowadzącym do przerwania leczenia w obu grupach terapeutycznych były uderzenia gorąca, chociaż w grupie ARIMIDEX 1 mg było mniej pacjentów, którzy przerwali leczenie z powodu uderzeń gorąca.
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
Doświadczenie w badaniach klinicznych
Terapia adiuwantowa
Dane dotyczące działań niepożądanych terapii adiuwantowej oparte są na badaniu ATAC [patrz Studia kliniczne ]. Mediana czasu trwania leczenia uzupełniającego w celu oceny bezpieczeństwa wyniosła 59,8 miesiąca i 59,6 miesiąca u pacjentów otrzymujących odpowiednio ARIMIDEX 1 mg i tamoksyfen 20 mg.
Działania niepożądane występujące z częstością co najmniej 5% w każdej z leczonych grup podczas leczenia lub w ciągu 14 dni od zakończenia leczenia przedstawiono w Tabeli 1.
Niektóre działania niepożądane i kombinacje działań niepożądanych zostały prospektywnie przeznaczone do analizy w oparciu o znane właściwości farmakologiczne i profile działań niepożądanych obu leków (patrz Tabela 2).
Niedokrwienne zdarzenia sercowo-naczyniowe
Pomiędzy ramionami leczenia w ogólnej populacji 6186 pacjentów nie było statystycznej różnicy w niedokrwiennych zdarzeniach sercowo-naczyniowych (4% ARIMIDEX vs. 3% tamoksyfen).
W całej populacji dusznicę bolesną zgłoszono u 71/3092 (2,3%) pacjentów w ramieniu ARIMIDEX 1 mg i 51/3094 (1,6%) pacjentów w ramieniu tamoksyfenu; Zawał mięśnia sercowego zgłoszono u 37/3092 (1,2%) pacjentów w ramieniu ARIMIDEX 1 mg i 34/3094 (1,1%) pacjentów w ramieniu tamoksyfenu.
U kobiet z istniejącą wcześniej chorobą niedokrwienną serca 465/6186 (7,5%) częstość występowania niedokrwiennych incydentów sercowo-naczyniowych wynosiła 17% u pacjentów przyjmujących ARIMIDEX i 10% u pacjentów przyjmujących tamoksyfen. W tej populacji pacjentów dusznicę bolesną zgłoszono u 25/216 (11,6%) pacjentów otrzymujących ARIMIDEX i 13/249 (5,2%) pacjentów otrzymujących tamoksyfen; Zawał mięśnia sercowego zgłoszono u 2/216 (0,9%) pacjentów otrzymujących ARIMIDEX i 8/249 (3,2%) pacjentów otrzymujących tamoksyfen.
Ustalenie gęstości mineralnej kości
Wyniki badania podgrupy kości w badaniu ATAC po 12 i 24 miesiącach wykazały, że u pacjentów otrzymujących ARIMIDEX w dawce 1 mg nastąpiło średnie zmniejszenie zarówno w odcinku lędźwiowym kręgosłupa, jak i całkowitej gęstości mineralnej kości biodrowej (BMD) w porównaniu z wartościami wyjściowymi. Pacjenci otrzymujący tamoksyfen mieli średni wzrost zarówno w odcinku lędźwiowym kręgosłupa, jak i całkowitej BMD biodra w porównaniu z wartością wyjściową.
Ponieważ ARIMIDEX obniża poziom krążących estrogenów, może powodować zmniejszenie gęstości mineralnej kości.
W badaniu po wprowadzeniu do obrotu oceniano łączny wpływ produktu ARIMIDEX 1 mg i bisfosfonianu ryzedronianu na zmiany BMD i markerów resorpcji i tworzenia kości w porównaniu z wartościami początkowymi u kobiet po menopauzie z wczesnym rakiem piersi z obecnością receptorów hormonalnych. Wszyscy pacjenci otrzymywali suplementację wapniem i witaminą D. Po 12 miesiącach zaobserwowano niewielkie zmniejszenie gęstości mineralnej kości kręgosłupa lędźwiowego u pacjentów nieotrzymujących bisfosfonianów. Leczenie bisfosfonianami zachowało gęstość kości u większości pacjentów z ryzykiem złamań.
Stan kości u kobiet po menopauzie z wczesnym rakiem piersi, u których zaplanowano leczenie produktem ARIMIDEX 1 mg, należy kontrolować zgodnie z wytycznymi dotyczącymi leczenia, które są już dostępne dla kobiet po menopauzie o podobnym ryzyku złamań osteoporotycznych.
Cholesterol
Podczas badania ATAC, więcej pacjentów otrzymujących ARIMIDEX 1 mg miało podwyższony poziom cholesterolu w surowicy w porównaniu do pacjentów otrzymujących tamoksyfen (odpowiednio 9% w porównaniu z 3,5%).
W badaniu po wprowadzeniu do obrotu oceniano również potencjalny wpływ preparatu ARIMIDEX na profil lipidowy. W pierwotnej populacji analizowanej pod kątem lipidów (tylko ARIMIDEX 1 mg) nie stwierdzono klinicznie istotnej zmiany stężenia LDL-C od wartości wyjściowej do 12 miesięcy i HDL-C od wartości wyjściowej do 12 miesięcy.
W populacji drugorzędowej dla lipidów (ARIMIDEX+ryzedronian) również nie stwierdzono klinicznie istotnej zmiany stężenia LDL-C i HDL-C od wartości wyjściowej do 12 miesięcy.
obu populacjach dla lipidów nie było klinicznie istotnej różnicy w całkowitym cholesterolu (TC) lub triglicerydach w surowicy (TG) po 12 miesiącach w porównaniu z wartościami wyjściowymi.
W tym badaniu leczenie przez 12 miesięcy samym ARIMIDEKSEM 1 mg miało neutralny wpływ na profil lipidowy. Leczenie skojarzone preparatem ARIMIDEX i rizedronianem również miało neutralny wpływ na profil lipidowy.
Badanie dostarcza dowodów na to, że kobiety po menopauzie z wczesnym rakiem piersi, które mają być leczone preparatem ARIMIDEX 1 mg, powinny być leczone zgodnie z aktualnymi wytycznymi Narodowego Programu Edukacji Cholesterolowej dotyczącymi postępowania w oparciu o ryzyko sercowo-naczyniowe u poszczególnych pacjentek z podwyższonym stężeniem cholesterolu frakcji LDL.
Inne działania niepożądane
pacjentów otrzymujących ARIMIDEX występowało nasilenie chorób stawów (w tym zapalenia stawów, artrozy i bólu stawów) w porównaniu z pacjentami otrzymującymi tamoksyfen. Pacjenci otrzymujący ARIMIDEX mieli zwiększoną częstość wszystkich złamań (szczególnie złamań kręgosłupa, biodra i nadgarstka) [315 (10%)] w porównaniu z pacjentami otrzymującymi tamoksyfen [209 (7%)].
Pacjenci otrzymujący ARIMIDEX 1 mg mieli większą częstość występowania zespołu cieśni nadgarstka [78 (2,5%)] w porównaniu z pacjentami otrzymującymi tamoksyfen [22 (0,7%)].
Krwawienie z pochwy występowało częściej u pacjentek leczonych tamoksyfenem w porównaniu z pacjentkami leczonymi preparatem ARIMIDEX, odpowiednio 317 (10%) w porównaniu do 167 (5%).
U pacjentek otrzymujących preparat ARIMIDEX rzadziej występowały uderzenia gorąca, krwawienia z pochwy, upławy, nowotwór endometrium, żylne zdarzenia zakrzepowo-zatorowe i niedokrwienne zdarzenia naczyniowo-mózgowe w porównaniu z pacjentkami otrzymującymi tamoksyfen.
Mediana wyników w zakresie bezpieczeństwa po 10-letniej obserwacji z badania ATAC
Wyniki są zgodne z poprzednimi analizami.
Poważne działania niepożądane były podobne w przypadku preparatu ARIMIDEX (50%) i tamoksyfenu (51%).
- Zdarzenia sercowo-naczyniowe były zgodne ze znanymi profilami bezpieczeństwa preparatu ARIMIDEX i tamoksyfenu.
- Skumulowana częstość wszystkich pierwszych złamań (zarówno ciężkich, jak i nieciężkich, występujących w trakcie lub po leczeniu) była wyższa w grupie ARIMIDEX (15%) w porównaniu z grupą tamoksyfenu (11%). Ta zwiększona częstość pierwszych złamań podczas leczenia nie utrzymywała się w okresie obserwacji po leczeniu.
- Skumulowana częstość występowania nowych pierwotnych nowotworów była podobna w grupie ARIMIDEX 1 mg (13,7%) w porównaniu z grupą tamoksyfenu (13,9%). Zgodnie z poprzednimi analizami rak endometrium był wyższy w grupie tamoksyfenu (0,8%) w porównaniu z grupą ARIMIDEX (0,2%).
- Ogólna liczba zgonów (podczas leczenia lub poza próbą) była podobna w grupach leczenia. W grupie leczonej tamoksyfenem było więcej zgonów związanych z rakiem piersi niż w grupie leczonej preparatem ARIMIDEX 1 mg.
Terapia pierwszej linii
Działania niepożądane występujące z częstością co najmniej 5% w obu leczonych grupach badań 0030 i 0027 w trakcie lub w ciągu 2 tygodni od zakończenia leczenia przedstawiono w Tabeli 3.
Mniej częste działania niepożądane zgłaszane u pacjentów otrzymujących ARIMIDEX 1 mg l mg w badaniu 0030 lub badaniu 0027 były podobne do zgłaszanych w przypadku leczenia drugiego rzutu.
W oparciu o wyniki leczenia drugiego rzutu i ustalony profil bezpieczeństwa tamoksyfenu, przeanalizowano statystycznie częstość występowania 9 wstępnie określonych kategorii zdarzeń niepożądanych, potencjalnie związanych przyczynowo z jedną lub obiema terapiami ze względu na ich farmakologię. Nie zaobserwowano znaczących różnic między grupami leczenia.
Terapia drugiej linii
ARIMIDEX 1 mg był tolerowany w dwóch kontrolowanych badaniach klinicznych (tj. Badania 0004 i 0005), przy czym mniej niż 3,3% pacjentów leczonych preparatem ARIMIDEX i 4,0% pacjentów leczonych octanem megestrolu wycofało się z powodu działań niepożądanych.
Głównym działaniem niepożądanym, częściej występującym w przypadku preparatu ARIMIDEX niż octanu megestrolu, była biegunka. Poniżej przedstawiono działania niepożądane zgłaszane u ponad 5% pacjentów w którejkolwiek z leczonych grup w tych dwóch kontrolowanych badaniach klinicznych, niezależnie od przyczynowości:
Ciało jako całość: zespół grypy; gorączka; ból szyi; złe samopoczucie; przypadkowe obrażenia; infekcja
Układ sercowo-naczyniowy: Nadciśnienie; zakrzepowe zapalenie żył
Wątrobiany: Zwiększono Gamma GT; SGOT wzrosła; podwyższony SGPT Hematologiczny: Niedokrwistość; leukopenia
Metaboliczne i odżywcze: Zwiększona fosfataza alkaliczna; utrata wagi
Średnie poziomy całkowitego cholesterolu w surowicy wzrosły o 0,5 mmol/l wśród pacjentów otrzymujących ARIMIDEX. Wykazano, że do tych zmian przyczynia się wzrost poziomu cholesterolu LDL.
Układ mięśniowo-szkieletowy: bóle mięśni; ból stawów; złamanie patologiczne
Nerwowy: Senność; dezorientacja; bezsenność; lęk; nerwowość
Oddechowy: Zapalenie zatok; zapalenie oskrzeli; katar
Skóra i przydatki: Przerzedzenie włosów (łysienie); świąd
Układ moczowo-płciowy: Zakażenie dróg moczowych; ból biustu
Przeanalizowano statystycznie częstość występowania następujących grup działań niepożądanych potencjalnie związanych przyczynowo z jedną lub obiema terapiami ze względu na ich farmakologię: przyrost masy ciała, obrzęk, choroba zakrzepowo-zatorowa, zaburzenia żołądkowo-jelitowe, uderzenia gorąca i suchość pochwy. Te sześć grup i reakcje niepożądane uchwycone w grupach zostały określone prospektywnie. Wyniki przedstawiono w poniższej tabeli.
Doświadczenie pomarketingowe
Te działania niepożądane są zgłaszane dobrowolnie w populacji o niepewnej wielkości. Dlatego nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek. Po dopuszczeniu do obrotu produktu Arimidex zgłaszano następujące przypadki:
- Zdarzenia wątrobowo-żółciowe, w tym wzrost fosfatazy alkalicznej, aminotransferazy alaninowej, aminotransferazy asparaginianowej, gamma-GT i bilirubiny; zapalenie wątroby
- Wysypka, w tym przypadki zaburzeń śluzówkowo-skórnych, takich jak rumień wielopostaciowy i zespół Stevensa-Johnsona
- Przypadki reakcji alergicznych, w tym obrzęku naczynioruchowego, pokrzywki i anafilaksji [patrz PRZECIWWSKAZANIA ]
- Ból mięśni, palec spustowy i hiperkalcemia (ze wzrostem lub bez wzrostu parathormonu)
INTERAKCJE Z LEKAMI
Tamoksyfen
Jednoczesne podawanie anastrozolu i tamoksyfenu pacjentom z rakiem piersi zmniejszyło stężenie anastrozolu w osoczu o 27%. Jednoczesne podawanie anastrozolu i tamoksyfenu nie miało jednak wpływu na farmakokinetykę tamoksyfenu ani N-desmetylotamoksyfenu. Przy medianie okresu obserwacji wynoszącej 33 miesiące, skojarzenie ARIMIDEX-u i tamoksyfenu nie wykazało żadnej korzyści pod względem skuteczności w porównaniu z tamoksyfenem u wszystkich pacjentów, jak również w subpopulacji z dodatnim receptorem hormonalnym. To ramię leczenia zostało przerwane z udziału w badaniu [patrz Studia kliniczne ]. W oparciu o wyniki kliniczne i farmakokinetyczne z badania ATAC, tamoksyfen nie powinien być podawany z anastrozolem.
Estrogen
Leki zawierające estrogen nie powinny być stosowane z lekiem ARIMIDEX 1 mg, ponieważ mogą one osłabić jego działanie farmakologiczne.
Warfaryna
badaniu przeprowadzonym na 16 ochotnikach płci męskiej anastrozol nie zmieniał ekspozycji (mierzonej jako Cmax i AUC) ani aktywności przeciwzakrzepowej (mierzonej jako czas protrombinowy, czas częściowej tromboplastyny po aktywacji i czas trombinowy) zarówno R-, jak i S- warfaryna.
Cytochrom P450 Na podstawie wyników badań in vitro i in vivo jest mało prawdopodobne, aby jednoczesne podawanie produktu ARIMIDEX w dawce 1 mg miało wpływ na inne leki w wyniku hamowania cytochromu P450 [patrz FARMAKOLOGIA KLINICZNA ].
OSTRZEŻENIA
Zawarte jako część ŚRODKI OSTROŻNOŚCI Sekcja.
ŚRODKI OSTROŻNOŚCI
Niedokrwienne zdarzenia sercowo-naczyniowe
U kobiet z istniejącą wcześniej chorobą niedokrwienną serca podczas stosowania preparatu ARIMIDEX w badaniu ATAC zaobserwowano zwiększoną częstość występowania niedokrwiennych zdarzeń sercowo-naczyniowych (17% pacjentów przyjmujących ARIMIDEX 1 mg i 10% pacjentów przyjmujących tamoksyfen). Rozważ ryzyko i korzyści leczenia preparatem ARIMIDEX u pacjentów z istniejącą wcześniej chorobą niedokrwienną serca [patrz DZIAŁANIA NIEPOŻĄDANE ]
Efekty kości
Wyniki badania podgrupy kości w badaniu ATAC po 12 i 24 miesiącach wykazały, że u pacjentów otrzymujących ARIMIDEX zaobserwowano średni spadek zarówno w odcinku lędźwiowym kręgosłupa, jak i całkowitej gęstości mineralnej kości biodrowej (BMD) w porównaniu z wartościami wyjściowymi. Pacjenci otrzymujący tamoksyfen mieli średni wzrost zarówno w odcinku lędźwiowym kręgosłupa, jak i całkowitej BMD biodra w porównaniu z wartością wyjściową. Rozważyć monitorowanie gęstości mineralnej kości u pacjentów leczonych preparatem ARIMIDEX [patrz DZIAŁANIA NIEPOŻĄDANE ].
Cholesterol
Podczas badania ATAC, więcej pacjentów otrzymujących ARIMIDEX 1 mg miało podwyższony poziom cholesterolu w surowicy w porównaniu do pacjentów otrzymujących tamoksyfen (odpowiednio 9% w porównaniu do 3,5%) [patrz DZIAŁANIA NIEPOŻĄDANE ].
Informacje dotyczące poradnictwa dla pacjentów
Widzieć Oznakowanie pacjenta zatwierdzone przez FDA (INFORMACJE DLA PACJENTA).
Ciąża
Pacjentki należy poinformować, że ARIMIDEX 1 mg może powodować uszkodzenie płodu. Należy również poinformować, że ARIMIDEX 1 mg nie jest przeznaczony do stosowania u kobiet przed menopauzą; dlatego w przypadku zajścia w ciążę powinny przerwać stosowanie leku ARIMIDEX i natychmiast skontaktować się z lekarzem.
Reakcje alergiczne (nadwrażliwości)
Pacjentów należy poinformować o możliwości wystąpienia ciężkich reakcji alergicznych z obrzękiem twarzy, ust, języka i (lub) gardła (obrzęk naczynioruchowy), które mogą powodować trudności w połykaniu i (lub) oddychaniu, i należy natychmiast zwrócić się o pomoc lekarską.
Niedokrwienne zdarzenia sercowo-naczyniowe
Należy poinformować pacjentów z istniejącą wcześniej chorobą niedokrwienną serca, że podczas stosowania produktu ARIMIDEX w dawce 1 mg zaobserwowano zwiększoną częstość występowania zdarzeń sercowo-naczyniowych w porównaniu do stosowania tamoksyfenu. Jeśli u pacjenta wystąpi nowy lub nasilający się ból w klatce piersiowej lub duszność, należy natychmiast zwrócić się o pomoc lekarską.
Efekty kości
Pacjentów należy poinformować, że ARIMIDEX obniża poziom estrogenu. Może to prowadzić do utraty zawartości minerałów w kościach, co może zmniejszyć wytrzymałość kości. Możliwą konsekwencją obniżonej zawartości minerałów w kościach jest zwiększenie ryzyka złamań.
Cholesterol
Należy poinformować pacjentów, że podczas przyjmowania leku ARIMIDEX może wystąpić podwyższony poziom cholesterolu.
Łaskotanie, mrowienie lub drętwienie
Pacjentów należy poinformować, że jeśli odczuwają łaskotanie, mrowienie lub drętwienie, powinni powiadomić swojego lekarza.
Tamoksyfen
Pacjentom należy zalecić, aby nie przyjmowali leku ARIMIDEX z tamoksyfenem.
Pominięte dawki
Poinformuj pacjentów, że jeśli pominą dawkę, weź ją, gdy tylko sobie o tym przypomni. Jeśli zbliża się pora przyjęcia kolejnej dawki, należy pominąć pominiętą dawkę i przyjąć następną regularnie zaplanowaną dawkę. Pacjenci nie powinni przyjmować dwóch dawek jednocześnie.
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Konwencjonalne badanie kancerogenezy u szczurów w dawkach od 1,0 do 25 mg/kg/dobę (około 10 do 243 razy większych od maksymalnej dawki dobowej zalecanej dla człowieka w przeliczeniu na mg/m2) podawanych przez zgłębnik doustny przez okres do 2 lat wykazało zwiększenie częstość występowania gruczolaka i raka wątrobowokomórkowego i polipów podścieliska macicy u kobiet oraz gruczolaka tarczycy u mężczyzn po podaniu dużych dawek. Zaobserwowano zależne od dawki zwiększenie częstości występowania przerostu jajników i macicy u kobiet. Przy dawce 25 mg/kg/dobę, poziomy AUC0-24 h w osoczu szczurów były 110 do 125 razy wyższe niż poziomy obserwowane u ochotniczek po menopauzie przy zalecanej dawce. Oddzielne badanie rakotwórczości na myszach, którym podawano doustnie dawki od 5 do 50 mg/kg/dobę (około 24 do 243 razy większe od maksymalnej dawki dobowej zalecanej dla człowieka w przeliczeniu na mg/m2) przez okres do 2 lat, wykazało wzrost częstości występowania łagodnych nowotwory z komórek podścieliska jajnika, komórek nabłonkowych i ziarnistych przy wszystkich poziomach dawek. U samic myszy zaobserwowano również zależny od dawki wzrost częstości występowania przerostu jajników. Te zmiany w jajnikach są uważane za specyficzne dla gryzoni skutki hamowania aromatazy i mają wątpliwe znaczenie dla ludzi. Częstość występowania mięsaka limfatycznego była zwiększona u mężczyzn i kobiet po podaniu dużych dawek. Przy dawce 50 mg/kg/dobę, poziomy AUC w osoczu myszy były 35 do 40 razy wyższe niż poziom wykazywany u ochotniczek po menopauzie przy zalecanej dawce.
testach in vitro (testy na bakteriach Amesa i E. coli, test mutacji genu CHO-K1) nie wykazano działania mutagennego ARIMIDEX w dawce 1 mg, ani działania klastogennego in vitro (aberracje chromosomowe w ludzkich limfocytach), ani in vivo (test mikrojądrowy u szczurów). .
Doustne podawanie anastrozolu samicom szczurów (od 2 tygodnia przed kryciem do siódmego dnia ciąży) powodowało znaczną częstość występowania niepłodności i zmniejszenie liczby żywotnych ciąż w dawce 1 mg/kg/dobę (około 10-krotność zalecanej dawki u ludzi w przeliczeniu na mg/m2) i 9 razy wyższe niż AUC0-24 godz. stwierdzane u ochotniczek po menopauzie przy zalecanej dawce). Utrata komórek jajowych lub płodu przed implantacją była zwiększona przy dawkach równych lub większych niż 0,02 mg/kg/dobę (około jedna piąta zalecanej dawki dla ludzi w przeliczeniu na mg/m2). Przywrócenie płodności obserwowano po 5-tygodniowym okresie niedawkowania, który następował po 3 tygodniach dawkowania. Nie wiadomo, czy te działania obserwowane u samic szczurów wskazują na zaburzenia płodności u ludzi.
Badania z wielokrotnymi dawkami u szczurów, którym podawano anastrozol przez 6 miesięcy w dawkach równych lub większych niż 1 mg/kg mc./dobę (które dały Cssmax i AUC 0-24 h anastrozolu w osoczu były 19 i 9 razy wyższe niż odpowiednie wartości stwierdzone po menopauzie ochotników w zalecanej dawce) spowodowało przerost jajników i obecność torbieli pęcherzykowych. Ponadto w 6-miesięcznych badaniach u samic psów, którym podawano dawki równe lub większe niż 1 mg/kg/dobę (co dawało Cssmax i AUC0-24 godz. anastrozolu w osoczu, było 22 razy i 16 razy wyższe niż odpowiednio wartości stwierdzone u kobiet po menopauzie w zalecanej dawce). Nie wiadomo, czy ten wpływ na narządy rozrodcze zwierząt jest związany z zaburzeniami płodności u kobiet przed menopauzą.
Używaj w określonych populacjach
Ciąża
Kategoria ciąży X [Widzieć PRZECIWWSKAZANIA ]
ARIMIDEX może powodować uszkodzenie płodu, gdy jest podawany kobiecie w ciąży i nie zapewnia korzyści klinicznych kobietom przed menopauzą z rakiem piersi. ARIMIDEX jest przeciwwskazany u kobiet w ciąży lub mogących zajść w ciążę. W badaniach na zwierzętach anastrozol powodował niepowodzenie ciąży, zwiększoną utratę ciąży i oznaki opóźnionego rozwoju płodu. Nie przeprowadzono badań dotyczących stosowania preparatu ARIMIDEX 1 mg u kobiet w ciąży. Jeśli ARIMIDEX 1 mg jest stosowany w okresie ciąży lub jeśli pacjentka zajdzie w ciążę w trakcie przyjmowania tego leku, pacjentkę należy poinformować o potencjalnym zagrożeniu dla płodu i potencjalnym ryzyku utraty ciąży.
badaniach reprodukcji na zwierzętach ciężarne szczury i króliki otrzymywały anastrozol w trakcie organogenezy w dawkach równych lub większych niż 1 (szczury) i 1/3 (króliki) zalecanej dawki u ludzi w przeliczeniu na mg/m². U obu gatunków anastrozol przenikał przez łożysko i występowała zwiększona utrata ciąży (zwiększona utrata przed i/lub po implantacji, zwiększona resorpcja i zmniejszona liczba żywych płodów). U szczurów efekty te były zależne od dawki, a masa łożyska była znacznie zwiększona. Fetotoksyczność, w tym opóźnienie rozwoju płodu (tj. niepełne skostnienie i obniżona masa ciała płodu), wystąpiła u szczurów po dawkach anastrozolu, które powodowały 19-krotnie wyższe stężenia w osoczu niż stężenia w surowicy u ludzi po dawce terapeutycznej (AUC 0-24 godz. 9 razy większe). . U królików anastrozol powodował niepowodzenie ciąży w dawkach równych lub większych niż 16-krotność zalecanej dawki u ludzi w przeliczeniu na mg/m2 [patrz Toksykologia i/lub Farmakologia Zwierząt ].
Matki karmiące
Nie wiadomo, czy anastrozol przenika do mleka ludzkiego. Ponieważ wiele leków przenika do mleka ludzkiego oraz ze względu na rakotwórczość wykazaną przez anastrozol w badaniach na zwierzętach lub możliwość wystąpienia poważnych działań niepożądanych u karmionych niemowląt, należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać stosowanie leku, biorąc pod uwagę znaczenie leku dla matki.
Zastosowanie pediatryczne
Badania kliniczne z udziałem dzieci i młodzieży obejmowały badanie kontrolowane placebo u chłopców w wieku dojrzewania z ginekomastią oraz jednoramienne badanie u dziewcząt z zespołem McCune-Albrighta i postępującym przedwczesnym dojrzewaniem. Nie wykazano skuteczności preparatu ARIMIDEX 1 mg w leczeniu ginekomastii pokwitania u dorastających chłopców oraz w leczeniu przedwczesnego dojrzewania u dziewcząt z zespołem McCune-Albrighta.
Badanie ginekomastii
Do randomizowanego, podwójnie zaślepionego, kontrolowanego placebo, wieloośrodkowego badania włączono 80 chłopców z ginekomastią pokwitania w wieku od 11 do 18 lat. Pacjenci zostali losowo przydzieleni do dziennego schematu podawania produktu ARIMIDEX 1 mg lub placebo. Po 6 miesiącach leczenia nie było statystycznie istotnej różnicy w odsetku pacjentów, u których wystąpiło ≥50% zmniejszenie ginekomastii (pierwotna analiza skuteczności). Drugorzędowe analizy skuteczności (bezwzględna zmiana objętości piersi, odsetek pacjentów, u których wystąpiło jakiekolwiek zmniejszenie obliczonej objętości ginekomastii, ustąpienie bólu piersi) były zgodne z pierwotną analizą skuteczności. Stężenia estradiolu w surowicy w 6. miesiącu leczenia zmniejszyły się o 15,4% w grupie ARIMIDEX i 4,5% w grupie placebo.
Działania niepożądane, które badacze ocenili jako związane z leczeniem, wystąpiły u 16,3% pacjentów leczonych preparatem ARIMIDEX i u 8,1% pacjentów otrzymujących placebo, przy czym najczęściej były to trądzik (7% ARIMIDEX i 2,7% placebo) i ból głowy (7 % ARIMIDEX 1 mg i 0% placebo); wszystkie inne działania niepożądane wykazały niewielkie różnice między grupami leczenia. Jeden pacjent leczony lekiem ARIMIDEX 1 mg przerwał badanie z powodu powiększenia jąder. Średnia zmiana objętości jądra po odjęciu wartości początkowej po 6 miesiącach leczenia wyniosła + 6,6 ± 7,9 cm3 u pacjentów leczonych preparatem ARIMIDEX i +5,2 ± 8,0 cm3 w grupie placebo.
Badanie zespołu McCune-Albright
Przeprowadzono wieloośrodkowe, jednoramienne, otwarte badanie z udziałem 28 dziewcząt w wieku od 2 do
pięciu pacjentów (18%) wystąpiły działania niepożądane, które uznano za prawdopodobnie związane ze stosowaniem leku ARIMIDEX. Były to nudności, trądzik, bóle kończyn, zwiększona aktywność aminotransferazy alaninowej i asparaginianowej oraz alergiczne zapalenie skóry.
Farmakokinetyka u pacjentów pediatrycznych
Po wielokrotnym podaniu 1 mg raz na dobę u dzieci i młodzieży średni czas do osiągnięcia maksymalnego stężenia anastrozolu wynosił 1 godzinę. Średnie (zakres) parametry rozdysponowania anastrozolu u pacjentów pediatrycznych zostały opisane przez CL/F 1,54 l/h (0,77-4,53 l/h) i V/F 98,4 l (50,7-330,0 l). Okres półtrwania w końcowej fazie eliminacji wynosił 46,8 h, co było podobne do obserwowanego u kobiet po menopauzie leczonych anastrozolem z powodu raka piersi. Na podstawie analizy farmakokinetyki populacyjnej, farmakokinetyka anastrozolu była podobna u chłopców z ginekomastią pokwitania i dziewcząt z zespołem McCune-Albrighta.
Zastosowanie geriatryczne
badaniach 0030 i 0027 około 50% pacjentów miało 65 lat lub więcej. Pacjenci w wieku ≥ 65 lat mieli umiarkowanie lepszą odpowiedź guza i czas do progresji nowotworu niż pacjenci w wieku
W badaniu ATAC 45% pacjentów było w wieku 65 lat lub starszych. Skuteczność ARIMIDEX 1 mg w porównaniu z tamoksyfenem u pacjentów w wieku 65 lat lub starszych (N=1413 dla ARIMIDEXu i N=1410 dla tamoksyfenu, współczynnik ryzyka dla przeżycia wolnego od choroby wyniósł 0,93 [95% CI: 0,80; 1,08]) mniejsza niż skuteczność obserwowana u pacjentów w wieku poniżej 65 lat (N=1712 dla preparatu ARIMIDEX i N=1706 dla tamoksyfenu, współczynnik ryzyka dla przeżycia wolnego od choroby wyniósł 0,79 [95% CI: 0,67; 0,94]).
Wiek nie ma wpływu na farmakokinetykę anastrozolu.
Zaburzenia czynności nerek
Ponieważ tylko około 10% anastrozolu jest wydalane w postaci niezmienionej z moczem, zaburzenie czynności nerek nie wpływa na całkowity klirens. Dostosowanie dawkowania u pacjentów z zaburzeniami czynności nerek nie jest konieczne [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ].
Niewydolność wątroby
Stężenia anastrozolu w osoczu u osób z marskością wątroby mieściły się w zakresie stężeń obserwowanych u zdrowych osób we wszystkich badaniach klinicznych. Dlatego też nie jest konieczne dostosowanie dawki u pacjentów ze stabilną marskością wątroby. ARIMIDEX nie był badany u pacjentów z ciężkimi zaburzeniami czynności wątroby [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ].
PRZEDAWKOWAĆ
Przeprowadzono badania kliniczne preparatu ARIMIDEX, do 60 mg w pojedynczej dawce podawanej zdrowym ochotnikom płci męskiej oraz do 10 mg na dobę podawanej kobietom po menopauzie z zaawansowanym rakiem piersi; te dawki były tolerowane. Nie ustalono pojedynczej dawki leku ARIMIDEX 1 mg powodującej objawy zagrażające życiu. Nie ma swoistego antidotum na przedawkowanie, a leczenie musi być objawowe. W przypadku przedawkowania należy wziąć pod uwagę, że mogło zostać przyjętych wiele leków. Wymioty mogą być wywołane, gdy pacjent jest czujny. Dializa może być pomocna, ponieważ ARIMIDEX nie wiąże się silnie z białkami. Wskazane jest ogólne leczenie podtrzymujące, w tym częste monitorowanie parametrów życiowych i ścisła obserwacja pacjenta.
PRZECIWWSKAZANIA
Kobiety w ciąży i przed menopauzą
ARIMIDEX 1 mg może powodować uszkodzenie płodu, gdy jest podawany kobiecie w ciąży i nie zapewnia korzyści klinicznych kobietom przed menopauzą z rakiem piersi. ARIMIDEX 1 mg jest przeciwwskazany u kobiet w ciąży lub mogących zajść w ciążę. Nie ma odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży stosujących preparat ARIMIDEX. Jeśli ARIMIDEX 1 mg jest stosowany w okresie ciąży lub jeśli pacjentka zajdzie w ciążę podczas przyjmowania tego leku, pacjentkę należy poinformować o potencjalnym zagrożeniu dla płodu lub potencjalnym ryzyku poronienia [patrz Stosowanie w określonych populacjach ].
Nadwrażliwość
ARIMIDEX 1 mg jest przeciwwskazany u każdego pacjenta, u którego wystąpiła reakcja nadwrażliwości na lek lub na którąkolwiek substancję pomocniczą. Obserwowane reakcje obejmują anafilaksję, obrzęk naczynioruchowy i pokrzywkę [patrz DZIAŁANIA NIEPOŻĄDANE ]
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Wzrost wielu nowotworów piersi jest stymulowany lub podtrzymywany przez estrogeny.
kobiet po menopauzie estrogeny pochodzą głównie z działania enzymu aromatazy, który przekształca androgeny nadnerczowe (przede wszystkim androstendion i testosteron) do estronu i estradiolu. Tłumienie biosyntezy estrogenu w tkankach obwodowych iw samej tkance nowotworowej można zatem osiągnąć poprzez specyficzne hamowanie enzymu aromatazy.
Anastrozol jest selektywnym niesteroidowym inhibitorem aromatazy. Znacząco obniża stężenie estradiolu w surowicy i nie ma wykrywalnego wpływu na tworzenie kortykosteroidów nadnerczowych ani aldosteronu.
Farmakodynamika
Wpływ na Estradiol
Średnie stężenia estradiolu w surowicy oceniano w wielokrotnych dobowych badaniach dawkowania 0,5, 1, 3, 5 i 10 mg ARIMIDEXU u kobiet po menopauzie z zaawansowanym rakiem piersi. Dla wszystkich dawek zaobserwowano klinicznie istotne zahamowanie estradiolu w surowicy. Dawki 1 mg i wyższe powodowały supresję średnich stężeń estradiolu w surowicy do dolnej granicy wykrywalności (3,7 pmol/l). Zalecana dzienna dawka, ARIMIDEX 1 mg, zmniejszała estradiol o około 70% w ciągu 24 godzin io około 80% po 14 dniach codziennego podawania. Tłumienie estradiolu w surowicy utrzymywało się przez okres do 6 dni po zaprzestaniu codziennego podawania produktu ARIMIDEX 1 mg.
Nie badano wpływu leku ARIMIDEX 1 mg na kobiety przed menopauzą z wczesnym lub zaawansowanym rakiem piersi. Ponieważ aromatyzacja androgenów nadnerczowych nie jest znaczącym źródłem estradiolu u kobiet przed menopauzą, ARIMIDEX nie powinien obniżać poziomu estradiolu u kobiet przed menopauzą.
Wpływ na kortykosteroidy
badaniach z wielokrotnym dobowym dawkowaniem 3, 5 i 10 mg selektywność anastrozolu była oceniana poprzez badanie wpływu na syntezę kortykosteroidów. We wszystkich dawkach anastrozol nie wpływał na wydzielanie kortyzolu ani aldosteronu na początku badania ani w odpowiedzi na ACTH. W przypadku anastrozolu nie jest konieczna terapia zastępcza glikokortykosteroidami lub mineralokortykosteroidami.
Inne efekty endokrynologiczne
W wielokrotnych badaniach z dawkowaniem dobowym dawek 5 i 10 mg mierzono hormon tyreotropowy (TSH); podczas podawania produktu ARIMIDEX nie stwierdzono wzrostu stężenia TSH. ARIMIDEX nie wykazuje bezpośredniego działania progestagenowego, androgennego ani estrogenowego u zwierząt, ale zaburza poziom krążących progesteronu, androgenów i estrogenów.
Farmakokinetyka
Wchłanianie
Hamowanie aktywności aromatazy jest spowodowane przede wszystkim anastrozolem, lekiem macierzystym. Wchłanianie anastrozolu jest szybkie, a maksymalne stężenie w osoczu zwykle występuje w ciągu 2 godzin po podaniu na czczo. Badania z radioznakowanym lekiem wykazały, że anastrozol podawany doustnie jest dobrze wchłaniany do krążenia ogólnego. Pokarm zmniejsza szybkość, ale nie ogólny stopień wchłaniania anastrozolu. Średnie Cmax anastrozolu zmniejszyło się o 16%, a mediana Tmax była opóźniona z 2 do 5 godzin, gdy anastrozol był podawany 30 minut po posiłku. Farmakokinetyka anastrozolu jest liniowa w zakresie dawek od 1 do 20 mg i nie zmienia się po wielokrotnym podawaniu. Farmakokinetyka anastrozolu była podobna u pacjentów i zdrowych ochotników.
Dystrybucja
Stężenia w osoczu w stanie stacjonarnym są około 3- do 4-krotnie wyższe niż stężenia obserwowane po podaniu pojedynczej dawki produktu ARIMIDEX. Stężenia w osoczu zbliżają się do poziomów w stanie stacjonarnym po około 7 dniach podawania raz na dobę. Anastrozol wiąże się w 40% z białkami osocza w zakresie terapeutycznym.
Metabolizm
Metabolizm anastrozolu następuje poprzez N-dealkilację, hydroksylację i glukuronidację. W ludzkim osoczu i moczu zidentyfikowano trzy metabolity anastrozolu (triazol, koniugat glukuronidowy hydroksyanastrozolu i sam koniugat glukuronidowy anastrozolu). Główny krążący metabolit anastrozolu, triazol, nie wykazuje aktywności farmakologicznej.
Anastrozol hamował reakcje katalizowane przez cytochrom P450 1A2, 2C8/9 i 3A4 in vitro z wartościami Ki, które były około 30 razy wyższe niż średnie wartości Cmax w stanie stacjonarnym obserwowane po dobowej dawce 1 mg. Anastrozol nie miał wpływu hamującego na reakcje katalizowane przez cytochrom P450 2A6 lub 2D6 in vitro. Podawanie pojedynczej dawki 30 mg/kg lub wielokrotnej dawki 10 mg/kg anastrozolu zdrowym osobom nie miało wpływu na klirens antypiryny ani na odzysk metabolitów antypiryny w moczu.
Wydalanie
Osiemdziesiąt pięć procent znakowanego radioaktywnie anastrozolu odzyskano w kale i moczu. Metabolizm wątrobowy odpowiada za około 85% eliminacji anastrozolu. Eliminacja nerkowa stanowi około 10% całkowitego klirensu. Średni okres półtrwania anastrozolu w fazie eliminacji wynosi 50 godzin.
Wpływ płci i wieku
Farmakokinetykę anastrozolu badano u ochotniczek po menopauzie i pacjentek z rakiem piersi. W okresie od 80 lat nie zaobserwowano żadnych skutków związanych z wiekiem.
Wpływ rasy
Poziomy estradiolu i siarczanu estronu w surowicy były podobne u kobiet rasy japońskiej i kaukaskiej po menopauzie, które otrzymywały 1 mg anastrozolu dziennie przez 16 dni. Średnie minimalne stężenia anastrozolu w osoczu w stanie stacjonarnym u kobiet rasy kaukaskiej i japońskich kobiet po menopauzie wynosiły odpowiednio 25,7 i 30,4 ng/ml.
Skutki niewydolności nerek
Farmakokinetykę anastrozolu badano u osób z zaburzeniami czynności nerek. Klirens nerkowy anastrozolu zmniejszał się proporcjonalnie do klirensu kreatyniny i był o około 50% mniejszy u ochotników z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny DAWKOWANIE I SPOSÓB PODAWANIA oraz Stosowanie w określonych populacjach ].
Skutki niewydolności wątroby
Farmakokinetykę anastrozolu badano u pacjentów z marskością wątroby związaną z nadużywaniem alkoholu. Pozorny klirens po podaniu doustnym (CL/F) anastrozolu był o około 30% niższy u osób ze stabilną marskością wątroby niż u osób z grupy kontrolnej z prawidłową czynnością wątroby. Jednak te stężenia w osoczu nadal mieściły się w zakresie wartości obserwowanych u zdrowych osób. Nie badano wpływu ciężkich zaburzeń czynności wątroby. Nie ma konieczności dostosowania dawki w przypadku stabilnej marskości wątroby [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz Używaj w określonych populacjach ].
Toksykologia i/lub farmakologia zwierząt
Toksykologia reprodukcyjna
Stwierdzono, że anastrozol przenika przez łożysko po podaniu doustnym 0,1 mg/kg szczurom i królikom (odpowiednio około 1 i 1,9-krotność zalecanej dawki u ludzi w przeliczeniu na mg/m2). Badania na szczurach i królikach w dawkach równych lub większych niż 0,1 i 0,02 mg/kg/dobę, odpowiednio (odpowiednio około 1 i 1/3 zalecanej dawki u ludzi w przeliczeniu na mg/m²), podawanych w okresie organogeneza wykazała, że anastrozol zwiększał utratę ciąży (zwiększoną liczbę poronień przed i (lub) po implantacji, zwiększoną resorpcję i zmniejszoną liczbę żywych płodów); skutki były zależne od dawki u szczurów. Masa łożyska znacznie wzrosła u szczurów przy dawkach 0,1 mg/kg/dobę lub większych.
szczurów, którym podawano dawki 1 mg/kg/dobę (co dawało Cssmax i AUC 0-24 h anastrozolu w osoczu było 19-krotnie i 9 razy wyższe niż odpowiednie wartości stwierdzone u ochotniczek po menopauzie przy zalecanej dawce). Nie ma dowodów na działanie teratogenne u szczurów, którym podawano dawki do 1,0 mg/kg/dobę. U królików anastrozol powodował niepowodzenie ciąży w dawkach równych lub większych niż 1,0 mg/kg/dobę (około 16-krotność zalecanej dawki u ludzi w przeliczeniu na mg/m2); nie było dowodów na teratogenność u królików, którym podawano 0,2 mg/kg/dobę (około 3-krotność zalecanej dawki u ludzi w przeliczeniu na mg/m2).
Studia kliniczne
Leczenie uzupełniające raka piersi u kobiet po menopauzie
wieloośrodkowym, podwójnie zaślepionym badaniu (ATAC) randomizowano 9366 kobiet po menopauzie z operacyjnym rakiem piersi do leczenia uzupełniającego preparatem ARIMIDEX 1 mg dziennie, tamoksyfenem 20 mg dziennie lub połączeniem tych dwóch terapii przez pięć lat lub do nawrotu choroby.
Pierwszorzędowym punktem końcowym badania był czas przeżycia wolny od choroby (tj. czas do wystąpienia wznowy odległej lub miejscowej, raka drugiej piersi lub zgonu z jakiejkolwiek przyczyny). Drugorzędowe punkty końcowe badania obejmowały przeżycie wolne od choroby odległej, częstość występowania raka piersi po przeciwnej stronie i przeżycie całkowite. Przy medianie okresu obserwacji wynoszącej 33 miesiące skojarzenie ARIMIDEX-u i tamoksyfenu nie wykazało żadnej korzyści pod względem skuteczności w porównaniu z tamoksyfenem u wszystkich pacjentów, jak również w subpopulacji z dodatnim receptorem hormonalnym. To ramię leczenia zostało przerwane z badania. W oparciu o wyniki kliniczne i farmakokinetyczne z badania ATAC, tamoksyfen nie powinien być podawany z anastrozolem [patrz INTERAKCJE Z LEKAMI ].
Cechy demograficzne i inne cechy wyjściowe były podobne w trzech grupach leczenia (patrz Tabela 7).
Pacjenci w dwóch ramionach monoterapii w badaniu ATAC byli leczeni przez medianę 60 miesięcy (5 lat) i obserwowani przez medianę 68 miesięcy. Przeżycie wolne od choroby w populacji ITT było statystycznie istotnie lepsze [współczynnik ryzyka (HR) = 0,87, 95% CI: 0,78, 0,97, p=0,0127] w ramieniu ARIMIDEX w porównaniu z ramieniem z tamoksyfenem. W subpopulacji receptorów hormonalnych, stanowiącej około 84% badanych pacjentów, przeżycie wolne od choroby również uległo istotnej statystycznie poprawie (HR = 0,83, 95% CI: 0,73, 0,94, p=0,0049) w ramieniu ARIMIDEX 1 mg w porównaniu z grupą ramię tamoksyfenu.
Rycina 1: Przeżycie wolne od choroby Krzywa przeżycia Kaplana-Meiera dla wszystkich pacjentów randomizowanych do grupy otrzymującej ARIMIDEX 1 mg lub monoterapię tamoksyfenem w badaniu ATAC (Intent-to-Treat) 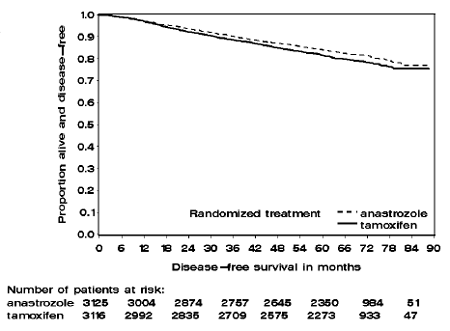
Rycina 2: Przeżycie wolne od choroby dla subpopulacji z dodatnim receptorem hormonalnym pacjentów randomizowanych do monoterapii ARIMIDEX lub tamoksyfenem w badaniu ATAC 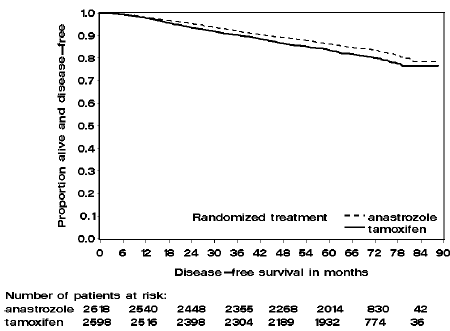
Dane dotyczące przeżycia z 68-miesięcznym okresem obserwacji przedstawiono w Tabeli 9.
W grupie pacjentów, którzy przeszli wcześniej chemioterapię adjuwantową (n=698 dla preparatu ARIMIDEX 1 mg i N=647 dla tamoksyfenu), współczynnik ryzyka przeżycia bez choroby wyniósł 0,91 (95% CI: 0,73 do 1,13) w ramieniu ARIMIDEX w porównaniu z ramię tamoksyfenu.
Częstość poszczególnych zdarzeń w populacji ITT i subpopulacji z dodatnim receptorem hormonalnym opisano w Tabeli 8.
Podsumowanie wyników skuteczności badania przedstawiono w Tabeli 9.
Mediana 10-letniej obserwacji Wyniki dotyczące skuteczności z badania ATAC
W późniejszej analizie badania ATAC pacjenci w dwóch ramionach monoterapii byli obserwowani przez medianę 120 miesięcy (10 lat). Pacjenci otrzymywali badany lek przez medianę 60 miesięcy (5 lat) (patrz Tabela 10).
Rycina 3: Przeżycie wolne od choroby Krzywa przeżycia Kaplana-Meiera dla wszystkich pacjentów zrandomizowanych do monoterapii ARIMIDEX lub tamoksyfenem w badaniu ATAC (intent-to-treat)a 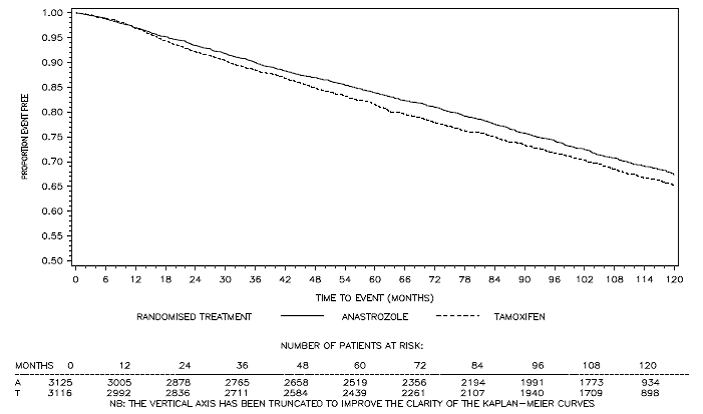
a Odsetek pacjentów z obserwacją po 120 miesiącach wyniósł 29,4%.
Rycina 4: Przeżycie wolne od choroby dla subpopulacji z dodatnim receptorem hormonalnym pacjentów randomizowanych do grupy otrzymującej ARIMIDEX 1 mg lub monoterapię tamoksyfenem w badaniu ATAC 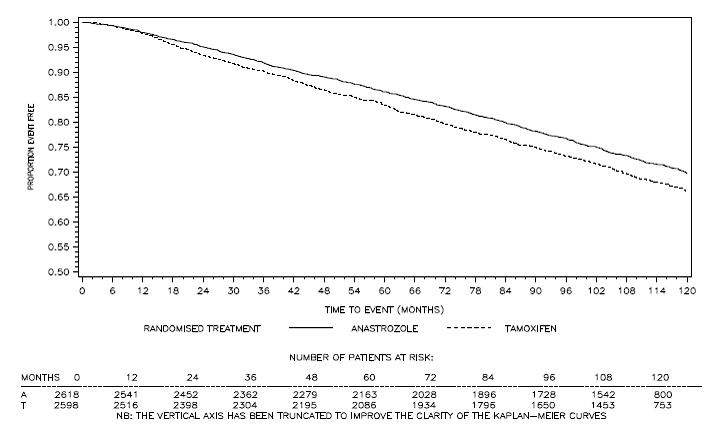
bOdsetek pacjentów ze 120-miesięcznym okresem obserwacji wyniósł 29,8%.
Terapia pierwszego rzutu u kobiet po menopauzie z zaawansowanym rakiem piersi
Przeprowadzono dwa podwójnie ślepe, kontrolowane badania kliniczne o podobnym projekcie (0030, badanie północnoamerykańskie i 0027, badanie głównie europejskie) w celu oceny skuteczności preparatu ARIMIDEX 1 mg w porównaniu z tamoksyfenem jako terapii pierwszego rzutu w przypadku obecności receptorów hormonalnych lub receptorów hormonalnych. nieznany miejscowo zaawansowany lub przerzutowy rak piersi u kobiet po menopauzie. Łącznie 1021 pacjentów w wieku od 30 do 92 lat zostało losowo przydzielonych do leczenia próbnego. Pacjenci zostali losowo przydzieleni do grupy otrzymującej 1 mg produktu ARIMIDEX 1 mg raz na dobę lub 20 mg tamoksyfenu raz na dobę. Pierwszorzędowymi punktami końcowymi w obu badaniach były czas do progresji guza, odsetek obiektywnych odpowiedzi guza i bezpieczeństwo.
Dane demograficzne i inne cechy wyjściowe, w tym pacjenci z chorobą mierzalną i niemierzalną, pacjenci, którzy otrzymali wcześniej leczenie uzupełniające, miejsce wystąpienia przerzutów i pochodzenie etniczne były podobne w obu grupach terapeutycznych w obu badaniach. Poniższa tabela podsumowuje stan receptorów hormonalnych na początku dla wszystkich randomizowanych pacjentów w badaniach 0030 i 0027.
W przypadku pierwszorzędowych punktów końcowych badanie 0030 wykazało, że ARIMIDEX miał statystycznie istotną przewagę nad tamoksyfenem (p=0,006) pod względem czasu do progresji nowotworu; odsetek obiektywnych odpowiedzi guza był podobny dla preparatu ARIMIDEX 1 mg i tamoksyfenu. Badanie 0027 wykazało, że ARIMIDEX 1 mg i tamoksyfen miały podobne obiektywne wskaźniki odpowiedzi guza i czas do progresji guza (patrz Tabela 12 i Ryciny 5 i 6).
Tabela 12 poniżej podsumowuje wyniki badania 0030 i badania 0027 dla pierwszorzędowych punktów końcowych skuteczności.
Rycina 5: Prawdopodobieństwo Kaplana-Meiera czasu do progresji choroby dla wszystkich randomizowanych pacjentów (z zamiarem leczenia) w Badaniu 0030 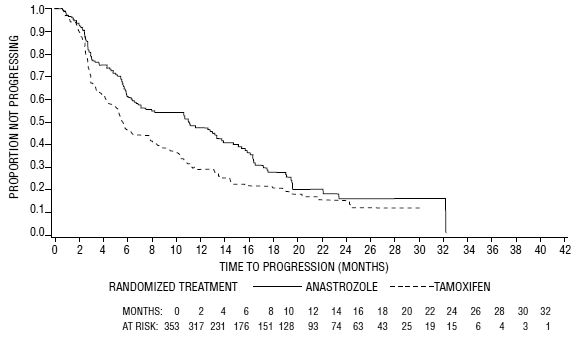
Rycina 6: Prawdopodobieństwo Kaplana-Meiera czasu do progresji dla wszystkich randomizowanych pacjentów (z zamiarem leczenia) w Badaniu 0027 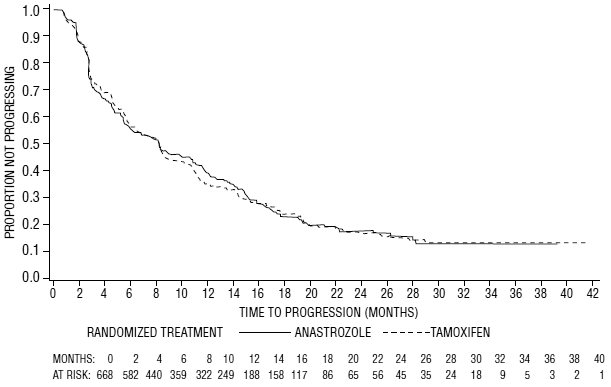
Wyniki drugorzędowych punktów końcowych potwierdzały wyniki pierwszorzędowych punktów końcowych skuteczności. W obu badaniach wystąpiło zbyt mało zgonów w grupach terapeutycznych, aby można było wyciągnąć wnioski na temat różnic w całkowitym przeżyciu.
Terapia drugiej linii u kobiet po menopauzie z zaawansowanym rakiem piersi, u których doszło do progresji choroby po terapii tamoksyfenem
Anastrozol badano w dwóch kontrolowanych badaniach klinicznych (0004, badanie północnoamerykańskie; 0005, badanie głównie europejskie) u kobiet po menopauzie z zaawansowanym rakiem piersi, u których doszło do progresji choroby po leczeniu tamoksyfenem zaawansowanego lub wczesnego raka piersi. Niektórzy z pacjentów otrzymywali również wcześniej leczenie cytotoksyczne. Większość pacjentów była ER-dodatni; mniejsza frakcja była ER-nieznana lub ER-ujemna; pacjenci bez ER kwalifikowali się do badania tylko wtedy, gdy mieli pozytywną odpowiedź na tamoksyfen. Zakwalifikowani pacjenci z mierzalną i niemierzalną chorobą zostali losowo przydzieleni do grupy otrzymującej pojedynczą dawkę dobową 1 mg lub 10 mg preparatu ARIMIDEX lub 40 mg octanu megestrolu cztery razy na dobę. Badania były prowadzone metodą podwójnie ślepej próby w odniesieniu do preparatu ARIMIDEX. Czas do progresji i odsetek obiektywnej odpowiedzi (tylko pacjenci z mierzalną chorobą można uznać za pacjentów z częściową odpowiedzią) były głównymi zmiennymi skuteczności. Wskaźniki obiektywnych odpowiedzi obliczono na podstawie kryteriów Union Internationale Contre le Cancer (UICC). Obliczono również wskaźnik przedłużonej (ponad 24 tygodnie) stabilnej choroby, wskaźnik progresji i przeżycie.
Oba badania obejmowały ponad 375 pacjentów; dane demograficzne i inne cechy wyjściowe były podobne dla trzech grup leczenia w każdym badaniu. Pacjenci w badaniu 0005 lepiej zareagowali na wcześniejsze leczenie tamoksyfenem. Spośród włączonych pacjentów, którzy byli wcześniej leczeni tamoksyfenem z powodu zaawansowanej choroby (58% w Badaniu 0004; 57% w Badaniu 0005), 18% tych pacjentów w Badaniu 0004 i 42% w Badaniu 0005 zgłosiło odpowiedź głównego badacza. W badaniu 0004, 81% pacjentów było ER-dodatnich, 13% było ER-nieznanych, a 6% ER-ujemnych. W Badaniu 0005 58% pacjentów było ER-dodatnich, 37% było ER-nieznanych, a 5% ER-ujemnych. W Badaniu 0004, 62% pacjentów miało mierzalną chorobę w porównaniu do 79% w Badaniu 0005. Miejsca występowania przerzutów były podobne w grupach terapeutycznych w każdym badaniu. Średnio 40% pacjentów miało przerzuty do tkanek miękkich; 60% miało przerzuty do kości; a 40% miało przerzuty trzewne (15% do wątroby).
Wyniki skuteczności z obu badań były podobne do przedstawionych w Tabeli 13. W obu badaniach nie było istotnych różnic między grupami leczenia w odniesieniu do żadnego z parametrów skuteczności wymienionych w poniższej tabeli.
Po połączeniu danych z dwóch kontrolowanych badań, wskaźniki obiektywnych odpowiedzi i mediana czasu do progresji i zgonu były podobne u pacjentów przydzielonych losowo do grupy ARIMIDEX 1 mg i octanu megestrolu. W tych danych nie ma wskazań, że ARIMIDEX 10 mg jest lepszy niż ARIMIDEX 1 mg.
INFORMACJA O PACJENCIE
ARIMIDEKS® A-rim-eh-dex (anastrozol) tabletki do podawania doustnego
Jakie są najważniejsze informacje, które powinienem wiedzieć o firmie ARIMIDEX?
ARIMIDEX może powodować poważne działania niepożądane, w tym:
- choroba serca. Kobiety z wczesnym rakiem piersi, które w wywiadzie cierpiały na zablokowanie tętnic serca (choroba niedokrwienna serca) i które przyjmują ARIMIDEX 1 mg, mogą mieć nasilone objawy zmniejszonego przepływu krwi do serca w porównaniu z podobnymi kobietami, które przyjmują tamoksyfen.
Należy natychmiast uzyskać pomoc medyczną, jeśli podczas leczenia lekiem ARIMIDEX wystąpi lub nasili się ból w klatce piersiowej lub duszność.
Co to jest ARIMIDEKS?
ARIMIDEX 1mg to lek na receptę stosowany u kobiet po menopauzie („zmiana życia”) w celu:
- leczenie wczesnego raka piersi
- po operacji
- u kobiet, u których rak piersi ma receptory hormonalne
- pierwsze leczenie raka piersi, który rozprzestrzenił się na pobliskie tkanki lub węzły chłonne (lokalnie zaawansowane) lub rozprzestrzenił się na inne części ciała (przerzuty), u kobiet, u których rak piersi ma receptory hormonalne lub receptory hormonalne nie są znane
- leczenie zaawansowanego raka piersi, jeśli nowotwór rozrósł się lub choroba rozprzestrzeniła się po terapii tamoksyfenem
ARIMIDEX 1 mg nie działa u kobiet z rakiem piersi, które nie przeszły menopauzy (kobiety przed menopauzą).
Kto nie powinien przyjmować leku ARIMIDEX?
Nie należy stosować leku ARIMIDEX 1 mg, jeśli:
- są w ciąży lub mogą zajść w ciążę. ARIMIDEX może zaszkodzić nienarodzonemu dziecku. Jeśli pacjentka zajdzie w ciążę podczas przyjmowania leku ARIMIDEX, należy natychmiast poinformować o tym lekarza.
- nie przeszła menopauzy (są przed menopauzą)
- jeśli wystąpiła ciężka reakcja alergiczna na anastrozol lub którykolwiek ze składników leku ARIMIDEX. Pełny wykaz składników leku ARIMIDEX znajduje się na końcu tej ulotki. Objawy ciężkiej reakcji alergicznej na ARIMIDEX obejmują: obrzęk twarzy, warg, języka lub gardła, trudności w oddychaniu lub przełykaniu, pokrzywkę i swędzenie.
O czym powinienem powiedzieć lekarzowi przed przyjęciem leku ARIMIDEX 1 mg?
Przed przyjęciem leku ARIMIDEX należy poinformować lekarza, jeśli:
- nie przeszły menopauzy. Porozmawiaj z lekarzem, jeśli nie jesteś pewien.
- masz lub miałeś problem z sercem
- powiedziano, że masz przerzedzenie kości lub osłabienie (osteoporoza)
- mieć wysoki poziom cholesterolu
- masz jakiekolwiek inne schorzenia
- są w ciąży lub planują zajść w ciążę. ARIMIDEX może zaszkodzić nienarodzonemu dziecku. Zobacz „Kto nie powinien przyjmować leku ARIMIDEX?”
- karmisz piersią lub planujesz karmić piersią. Nie wiadomo, czy ARIMIDEX przenika do mleka matki. Ty i twój lekarz powinniście zdecydować, czy będziecie przyjmować lek ARIMIDEX 1 mg, czy karmić piersią. Nie powinieneś robić obu.
Poinformuj lekarza o wszystkich przyjmowanych lekach, w tym leki na receptę i bez recepty, witaminy i suplementy ziołowe. Szczególnie powiedz swojemu lekarzowi, jeśli przyjmujesz:
- tamoksyfen. Nie powinieneś brać ARIMIDEKS jeśli przyjmujesz tamoksyfen. Przyjmowanie leku ARIMIDEX 1 mg z tamoksyfenem może obniżyć ilość leku ARIMIDEX 1 mg we krwi i może spowodować, że lek ARIMIDEX 1 mg nie będzie działał tak dobrze.
- Leki zawierające estrogen. ARIMIDEX 1 mg może nie działać, jeśli jest przyjmowany z którymkolwiek z tych leków:
- hormonalna terapia zastępcza
- tabletki antykoncepcyjne
- kremy estrogenowe
- pierścienie dopochwowe
- czopki dopochwowe
Poznaj leki, które przyjmujesz. Zachowaj ich listę, aby pokazać lekarzowi i farmaceucie, gdy otrzymasz nowy lek.
Jak powinienem przyjmować ARIMIDEX?
- Lek ARIMIDEX należy przyjmować zgodnie z zaleceniami lekarza.
- Należy kontynuować przyjmowanie leku ARIMIDEX, dopóki lekarz nie zaleci przerwania leczenia.
- ARIMIDEX 1 mg można przyjmować z posiłkiem lub bez posiłku.
- Jeśli pominiesz dawkę, zażyj ją tak szybko, jak sobie przypomnisz. Jeśli zbliża się pora przyjęcia następnej dawki, pomiń pominiętą dawkę. Przyjmij następną regularnie zaplanowaną dawkę. Nie należy przyjmować dwóch dawek jednocześnie.
W przypadku zażycia zbyt dużej dawki leku ARIMIDEX 1 mg należy natychmiast skontaktować się z lekarzem lub udać się na izbę przyjęć najbliższego szpitala.
Jakie są możliwe skutki uboczne leku ARIMIDEX?
ARIMIDEX może powodować poważne działania niepożądane, w tym:
- Widzieć „Jakie są najważniejsze informacje, które powinienem wiedzieć o ARIMIDEKSIE?”
- przerzedzenie kości lub osłabienie (osteoporoza). ARIMIDEX 1 mg obniża poziom estrogenów w organizmie, co może powodować cieńsze i słabsze kości. Może to zwiększyć ryzyko złamań, zwłaszcza kręgosłupa, biodra i nadgarstka. Twój lekarz może zlecić badanie gęstości mineralnej kości
- przed rozpoczęciem i w trakcie leczenia lekiem ARIMIDEX w celu sprawdzenia zmian kostnych.
- podwyższony poziom cholesterolu we krwi (tłuszcz we krwi). Lekarz może zlecić badania krwi w celu sprawdzenia stężenia cholesterolu podczas przyjmowania leku ARIMIDEX.
- reakcje skórne. Należy przerwać przyjmowanie leku ARIMIDEX 1 mg i natychmiast skontaktować się z lekarzem, jeśli wystąpią jakiekolwiek zmiany skórne, owrzodzenia lub pęcherze.
- ciężkie reakcje alergiczne. Natychmiast uzyskaj pomoc medyczną, jeśli otrzymasz:
- obrzęk twarzy, ust, języka lub gardła
- kłopoty z połykaniem lub oddychaniem
- problemy z wątrobą. ARIMIDEX 1 mg może powodować zapalenie wątroby i zmiany w wynikach badań czynności wątroby. Twój lekarz może to sprawdzić. Należy przerwać przyjmowanie leku ARIMIDEX 1 mg i natychmiast skontaktować się z lekarzem jeśli u pacjenta występują którekolwiek z tych oznak lub objawów problemów z wątrobą:
- ogólne uczucie złego samopoczucia
- zażółcenie skóry lub białek oczu
- ból po prawej stronie brzucha (brzuch)
Częste działania niepożądane u kobiet przyjmujących ARIMIDEX 1 mg obejmują:
- uderzenia gorąca
- słabość
- bóle stawów
- ból stawów, sztywność lub obrzęk (zapalenie stawów)
- ból
- ból gardła
- wysokie ciśnienie krwi
- depresja
- nudności i wymioty
- wysypka
- ból pleców
- problemy ze snem
- ból kości
- ból głowy
- obrzęk nóg, kostek lub stóp
- zwiększony kaszel
- duszność
- nagromadzenie płynu limfatycznego w tkankach chorego ramienia (obrzęk limfatyczny)
ARIMIDEX może również powodować łaskotanie, mrowienie lub drętwienie skóry.
Należy poinformować lekarza, jeśli wystąpią jakiekolwiek objawy niepożądane, które Cię niepokoją lub które nie ustępują.
To nie wszystkie możliwe działania niepożądane leku ARIMIDEX. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Jak przechowywać ARIMIDEX 1mg?
- Przechowywać ARIMIDEX 1 mg w temperaturze pokojowej między 68 ° F do 77 ° F (20 ° C do 25 ° C).
Lek ARIMIDEX i wszystkie leki należy przechowywać w miejscu niedostępnym dla dzieci.
Ogólne informacje o bezpiecznym i skutecznym stosowaniu ARIMIDEX.
Czasami leki są przepisywane do celów innych niż wymienione w ulotce informacyjnej dla pacjenta. Nie należy przyjmować leku ARIMIDEX 1 mg w stanach, na które nie został przepisany. Nie należy podawać leku ARIMIDEX innym osobom, nawet jeśli mają takie same objawy jak ty. Może im to zaszkodzić.
Jeśli chcesz uzyskać więcej informacji, porozmawiaj ze swoim lekarzem. Możesz poprosić farmaceutę lub lekarza o informacje na temat leku ARIMIDEX, które są przeznaczone dla pracowników służby zdrowia. Aby uzyskać więcej informacji, zadzwoń pod numer 1-866-992-9276 lub odwiedź stronę www.ARIMIDEX.com.
Jakie są składniki ARIMIDEX?
Składnik czynny: anastrozol
Nieaktywne składniki: laktoza, stearynian magnezu, hydroksypropylometyloceluloza, glikol polietylenowy, powidon, glikolan sodowy skrobi i dwutlenek tytanu.
