Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Diflucan i jak się go stosuje?
Diflucan to lek na receptę stosowany w leczeniu objawów infekcji grzybiczych. Diflucan 50mg może być stosowany samodzielnie lub z innymi lekami.
Diflucan 100mg należy do klasy leków przeciwgrzybiczych.
Jakie są skutki uboczne Diflucan 150mg?
Diflucan 100mg może powodować poważne skutki uboczne, w tym:
- szybkie lub mocno bijące bicie serca,
- trzepotać w piersi,
- duszność,
- nagłe zawroty głowy,
- gorączka,
- dreszcze,
- bóle,
- Objawy grypy,
- łatwe siniaczenie lub krwawienie,
- niezwykła słabość,
- drgawki (drgawki),
- wysypka lub zmiany skórne,
- utrata apetytu,
- ból w górnej części brzucha,
- ciemny mocz,
- stolec w kolorze gliny i
- zażółcenie oczu lub skóry (żółtaczka)
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Diflucan to:
- mdłości,
- ból brzucha,
- biegunka,
- rozstrój żołądka,
- ból głowy,
- zawroty głowy i
- zmiany w poczuciu smaku
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Diflucanu. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OPIS
DIFLUCAN® (flukonazol), pierwszy z nowej podklasy syntetycznych triazolowych środków przeciwgrzybiczych, jest dostępny w postaci tabletek do podawania doustnego, jako proszek do sporządzania zawiesiny doustnej.
Flukonazol jest oznaczony chemicznie jako alkohol 2,4-difluoro-α,α1-bis(1H-1,2,4-triazol-1-ilometylo)benzylowy o wzorze empirycznym C13H12F2N6O i masie cząsteczkowej 306,3. Wzór strukturalny to:
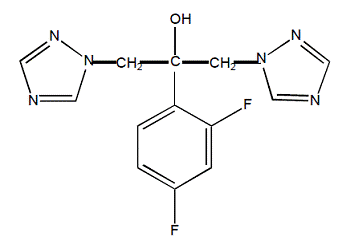
Flukonazol to białe, krystaliczne ciało stałe, które jest słabo rozpuszczalne w wodzie i soli fizjologicznej.
Tabletki DIFLUCAN zawierają 50, 100, 150 lub 200 mg flukonazolu i następujące nieaktywne składniki: celuloza mikrokrystaliczna, bezwodny dwuzasadowy fosforan wapnia, powidon, kroskarmeloza sodowa, barwnik aluminiowy FD&C Red No. 40 i stearynian magnezu.
DIFLUCAN do zawiesiny doustnej zawiera 350 mg lub 1400 mg flukonazolu i następujące składniki nieaktywne: sacharozę, dwuwodny cytrynian sodu, bezwodny kwas cytrynowy, benzoesan sodu, dwutlenek tytanu, koloidalny dwutlenek krzemu, gumę ksantanową i naturalny aromat pomarańczowy. Po rekonstytucji w 24 ml wody destylowanej lub wody oczyszczonej (USP), każdy ml odtworzonej zawiesiny zawiera 10 mg lub 40 mg flukonazolu.
WSKAZANIA
DIFLUCAN (flukonazol) jest wskazany w leczeniu:
- Kandydoza pochwy (infekcje drożdżakowe pochwy wywołane przez Candida).
- Kandydoza jamy ustnej i gardła i przełyku. W otwartych badaniach nieporównawczych obejmujących stosunkowo niewielką liczbę pacjentów, DIFLUCAN był również skuteczny w leczeniu zakażeń dróg moczowych wywołanych przez Candida, zapalenia otrzewnej i ogólnoustrojowych zakażeń wywołanych przez Candida, w tym kandydemii, rozsianej kandydozy i zapalenia płuc.
- Kryptokokowe zapalenie opon mózgowych. Przed przepisaniem DIFLUCAN (flukonazol) pacjentom z AIDS z kryptokokowym zapaleniem opon mózgowych należy zapoznać się z Studia kliniczne Sekcja. Nie przeprowadzono badań porównujących DIFLUCAN 150 mg z amfoterycyną B u pacjentów niezakażonych HIV.
Profilaktyka
DIFLUCAN jest również wskazany w celu zmniejszenia częstości występowania kandydozy u pacjentów poddawanych przeszczepieniu szpiku kostnego, którzy otrzymują chemioterapię cytotoksyczną i (lub) radioterapię.
Próbki do hodowli grzybów i innych odpowiednich badań laboratoryjnych (serologicznych, histopatologicznych) należy pobrać przed rozpoczęciem leczenia w celu wyizolowania i zidentyfikowania drobnoustrojów sprawczych. Terapię można rozpocząć przed poznaniem wyników hodowli i innych badań laboratoryjnych; jednak, gdy wyniki te staną się dostępne, należy odpowiednio dostosować leczenie przeciwinfekcyjne.
DAWKOWANIE I SPOSÓB PODAWANIA
Dawkowanie i podawanie u dorosłych
Pojedyncza dawka
Kandydoza pochwy
Zalecana dawka preparatu DIFLUCAN w leczeniu kandydozy pochwy wynosi 150 mg w pojedynczej dawce doustnej.
Wielokrotna dawka
PONIEWAŻ WCHŁANIANIE DOUSTNE JEST SZYBKIE I PRAWIE KOMPLETNE, DZIENNA DAWKA DIFLUKANU (FLUKONAZOL) JEST TAKIE SAME DLA PODANIA DOUSTNEGO (TABLETKI I ZAWIESINA) I DOŻYLNEGO. Na ogół w pierwszym dniu leczenia zaleca się dawkę nasycającą dwa razy większą od dawki dobowej, aby w drugim dniu leczenia stężenie w osoczu było bliskie stanu stacjonarnego.
Dzienna dawka preparatu DIFLUCAN 100 mg w leczeniu infekcji innych niż kandydoza pochwy powinna być oparta na zakażającym organizmie i reakcji pacjentki na terapię. Leczenie należy kontynuować do czasu, gdy parametry kliniczne lub badania laboratoryjne wykażą ustąpienie aktywnego zakażenia grzybiczego. Nieodpowiedni okres leczenia może prowadzić do nawrotu aktywnej infekcji. Pacjenci z AIDS i kryptokokowym zapaleniem opon mózgowo-rdzeniowych lub nawracającą kandydozą jamy ustnej i gardła zwykle wymagają leczenia podtrzymującego, aby zapobiec nawrotom.
Kandydoza jamy ustnej i gardła
Zalecana dawka preparatu DIFLUCAN w kandydozie jamy ustnej i gardła wynosi 200 mg pierwszego dnia, a następnie 100 mg raz na dobę. Kliniczne objawy kandydozy jamy ustnej i gardła zwykle ustępują w ciągu kilku dni, ale leczenie należy kontynuować przez co najmniej 2 tygodnie, aby zmniejszyć prawdopodobieństwo nawrotu.
Kandydoza przełyku
Zalecana dawka preparatu DIFLUCAN 200 mg w leczeniu kandydozy przełyku wynosi 200 mg pierwszego dnia, a następnie 100 mg raz na dobę. Można stosować dawki do 400 mg/dzień, w oparciu o ocenę medyczną odpowiedzi pacjenta na terapię. Pacjenci z kandydozą przełyku powinni być leczeni przez co najmniej trzy tygodnie i co najmniej dwa tygodnie po ustąpieniu objawów.
Zakażenia ogólnoustrojowe Candida
W przypadku ogólnoustrojowych zakażeń Candida, w tym kandydemii, rozsianej kandydozy i zapalenia płuc, nie ustalono optymalnej dawki terapeutycznej i czasu trwania leczenia. W otwartych, nieporównawczych badaniach małej liczby pacjentów stosowano dawki do 400 mg na dobę.
Infekcje dróg moczowych i zapalenie otrzewnej
W leczeniu zakażeń dróg moczowych wywołanych przez Candida i zapalenia otrzewnej w otwartych badaniach nieporównawczych z udziałem niewielkiej liczby pacjentów stosowano dawki dobowe od 50 do 200 mg.
Kryptokokowe zapalenie opon mózgowych
Zalecana dawka w leczeniu ostrego kryptokokowego zapalenia opon mózgowo-rdzeniowych wynosi 400 mg pierwszego dnia, a następnie 200 mg raz na dobę. Można zastosować dawkę 400 mg raz dziennie, w oparciu o ocenę medyczną odpowiedzi pacjenta na terapię. Zalecany czas trwania leczenia początkowego leczenia kryptokokowego zapalenia opon mózgowo-rdzeniowych wynosi od 10 do 12 tygodni po uzyskaniu ujemnego wyniku posiewu płynu mózgowo-rdzeniowego. Zalecana dawka preparatu DIFLUCAN 150 mg w celu zahamowania nawrotu kryptokokowego zapalenia opon mózgowo-rdzeniowych u pacjentów z AIDS wynosi 200 mg raz na dobę.
Profilaktyka u pacjentów poddawanych transplantacji szpiku kostnego
Zalecana dzienna dawka preparatu DIFLUCAN w zapobieganiu kandydozie u pacjentów poddawanych przeszczepieniu szpiku kostnego wynosi 400 mg raz na dobę. Pacjenci, u których przewiduje się ciężką granulocytopenię (mniej niż 500 neutrofili/mm3) powinni rozpocząć profilaktykę DIFLUCAN na kilka dni przed przewidywanym początkiem neutropenii i kontynuować ją przez 7 dni po tym, jak liczba neutrofili wzrośnie powyżej 1000 komórek/mm3.
Dawkowanie i podawanie u dzieci
Poniższy schemat równoważności dawek powinien zasadniczo zapewniać równoważną ekspozycję u dzieci i dorosłych:
Doświadczenie ze stosowaniem preparatu DIFLUCAN u noworodków ogranicza się do badań farmakokinetycznych u wcześniaków. (Widzieć FARMAKOLOGIA KLINICZNA .) W oparciu o wydłużony okres półtrwania obserwowany u wcześniaków (wiek ciążowy od 26 do 29 tygodni), dzieci te w pierwszych dwóch tygodniach życia powinny otrzymywać taką samą dawkę (mg/kg), jak u starszych dzieci, ale podawać co 72 godziny. Po pierwszych dwóch tygodniach dzieciom tym należy podawać dawkę raz dziennie. Brak dostępnych informacji dotyczących farmakokinetyki preparatu DIFLUCAN u noworodków urodzonych o czasie.
Kandydoza jamy ustnej i gardła
Zalecana dawka preparatu DIFLUCAN 150 mg w leczeniu kandydozy jamy ustnej i gardła u dzieci wynosi 6 mg/kg w pierwszym dniu, a następnie 3 mg/kg raz na dobę. Leczenie należy podawać przez co najmniej 2 tygodnie, aby zmniejszyć prawdopodobieństwo nawrotu.
Kandydoza przełyku
leczeniu kandydozy przełyku zalecana dawka preparatu DIFLUCAN u dzieci wynosi 6 mg/kg w pierwszym dniu, a następnie 3 mg/kg raz na dobę. Można stosować dawki do 12 mg/kg/dzień, w oparciu o ocenę medyczną odpowiedzi pacjenta na terapię. Pacjenci z kandydozą przełyku powinni być leczeni przez co najmniej trzy tygodnie i co najmniej 2 tygodnie po ustąpieniu objawów.
Zakażenia ogólnoustrojowe Candida
W leczeniu kandydemii i rozsianych infekcji Candida, w otwartym, nieporównawczym badaniu małej liczby dzieci stosowano dawki dobowe od 6 do 12 mg/kg/dobę.
Kryptokokowe zapalenie opon mózgowych
leczeniu ostrego kryptokokowego zapalenia opon mózgowych zalecana dawka wynosi 12 mg/kg pierwszego dnia, a następnie 6 mg/kg raz na dobę. Można zastosować dawkę 12 mg/kg raz dziennie, w oparciu o ocenę medyczną odpowiedzi pacjenta na terapię. Zalecany czas trwania leczenia początkowego leczenia kryptokokowego zapalenia opon mózgowo-rdzeniowych wynosi od 10 do 12 tygodni po uzyskaniu ujemnego wyniku posiewu płynu mózgowo-rdzeniowego. W celu zahamowania nawrotu kryptokokowego zapalenia opon mózgowych u dzieci z AIDS zalecana dawka preparatu DIFLUCAN wynosi 6 mg/kg raz na dobę.
Dawkowanie u pacjentów z zaburzeniami czynności nerek
Flukonazol jest usuwany głównie przez nerki w postaci niezmienionej. Nie ma potrzeby dostosowywania leczenia pojedynczą dawką w przypadku kandydozy pochwy ze względu na zaburzenia czynności nerek. U pacjentów z zaburzeniami czynności nerek, którzy będą otrzymywać wielokrotne dawki preparatu DIFLUCAN, należy podać początkową dawkę nasycającą od 50 mg do 400 mg. Po podaniu dawki nasycającej dawkę dobową (zgodnie ze wskazaniem) należy ustalić na podstawie poniższej tabeli:
Pacjenci poddawani hemodializie powinni otrzymywać 100% zalecanej dawki po każdej hemodializie; w dniach bez dializy pacjenci powinni otrzymywać zmniejszoną dawkę w zależności od ich klirensu kreatyniny.
Są to sugerowane modyfikacje dawki na podstawie farmakokinetyki po podaniu wielu dawek. W zależności od stanu klinicznego może być konieczne dalsze dostosowanie.
Gdy kreatynina w surowicy jest jedyną dostępną miarą czynności nerek, do oszacowania klirensu kreatyniny u dorosłych należy zastosować następujący wzór (na podstawie płci, masy ciała i wieku pacjenta):
Psy: Waga (kg) ≤ (140 – wiek)/ 72 ≤ kreatynina w surowicy (mg/100 ml)
Suki: 0,85 × powyżej wartości
Chociaż farmakokinetyka flukonazolu nie była badana u dzieci z niewydolnością nerek, zmniejszenie dawki u dzieci z niewydolnością nerek powinno być analogiczne do zalecanego dla dorosłych. Do oszacowania klirensu kreatyniny u dzieci można użyć następującego wzoru:
× długość liniowa lub wzrost (cm)/ kreatynina w surowicy (mg/100 ml)
(Gdzie K=0,55 dla dzieci w wieku powyżej 1 roku i 0,45 dla niemowląt.)
Administracja
DIFLUCAN 100mg jest podawany doustnie. DIFLUCAN można przyjmować z jedzeniem lub bez jedzenia.
Wskazówki dotyczące mieszania zawiesiny doustnej
Przygotuj zawiesinę w momencie dozowania w następujący sposób: postukaj butelką, aż cały proszek zacznie swobodnie spływać. Aby rozpuścić, dodaj 24 ml wody destylowanej lub wody oczyszczonej (USP) do butelki z flukonazolem i energicznie wstrząśnij, aby zawiesić proszek. Każda butelka dostarczy 35 ml zawiesiny. Stężenia odtworzonych zawiesin są następujące:
Uwaga: Przed użyciem dobrze wstrząsnąć zawiesiną doustną. Odtworzoną zawiesinę należy przechowywać w temperaturze od 86°F (30 °C) do 41°F (5°C) i wyrzucić niewykorzystaną porcję po 2 tygodniach. Chronić przed zamarzaniem.
JAK DOSTARCZONE
DIFLUCAN 100 mg tabletki Różowe tabletki trapezowe zawierające 50, 100 lub 200 mg flukonazolu są pakowane w butelki lub blistry z dawką jednostkową. Tabletki 150 mg flukonazolu są różowe i owalne, zapakowane w blistrze z pojedynczą dawką.
Tabletki DIFLUCAN są dostarczane w następujący sposób:
DIFLUCAN 50 mg tabletki : Grawerowane „DIFLUCAN” i „50” z przodu oraz „ROERIG” z tyłu.
NDC 0049-3410-30 Butelki 30
DIFLUCAN 100 mg tabletki : Grawerowane „DIFLUCAN” i „100” z przodu oraz „ROERIG” z tyłu.
NDC 0049-3420-30 Butelki 30 NDC 0049-3420-41 Opakowanie jednostkowe 100
DIFLUCAN 150 mg tabletki : Grawerowane „DIFLUCAN” i „150” z przodu oraz „ROERIG” z tyłu.
NDC 0049-3500-79 Opakowanie jednostkowe po 1
DIFLUCAN 200 mg tabletki : Grawerowane „DIFLUCAN” i „200” z przodu oraz „ROERIG” z tyłu.
NDC 0049-3430-30 Butelki 30 NDC 0049-3430-41 Opakowanie jednostkowe 100
Magazynowanie
Przechowuj tabletki w temperaturze poniżej 86 ° F (30 ° C).
DIFLUCAN 100 mg do zawiesiny doustnej : DIFLUCAN do zawiesiny doustnej jest dostarczany w postaci proszku o smaku pomarańczowym, co zapewnia zawartość 35 ml na butelkę w następujący sposób:
NDC 0049-3440-19 Flukonazol 350 mg na butelkę NDC 0049-3450-19 Flukonazol 1400 mg na butelkę
Magazynowanie
Przechowuj suchy proszek w temperaturze poniżej 86°F (30 °C). Sporządzoną zawiesinę przechowywać w temperaturze od 86°F (30 °C) do 41 °F (5 °C) i wyrzucić niewykorzystaną porcję po 2 tygodniach. Chronić przed zamarzaniem.
Dystrybutor: Roerig Division of Pfizer Inc., NY, NY 10017. Aktualizacja: październik 2021
SKUTKI UBOCZNE
DIFLUCAN jest na ogół dobrze tolerowany.
U niektórych pacjentów, zwłaszcza z poważnymi chorobami podstawowymi, takimi jak AIDS i nowotwory, podczas leczenia flukonazolem i lekami porównawczymi obserwowano zmiany w wynikach testów czynności nerek i hematologicznych oraz zaburzenia czynności wątroby, ale znaczenie kliniczne i związek z leczeniem są niepewne.
U pacjentek otrzymujących pojedynczą dawkę na kandydozę pochwy
Podczas porównawczych badań klinicznych przeprowadzonych w Stanach Zjednoczonych 448 pacjentek z kandydozą pochwy leczono preparatem DIFLUCAN w dawce pojedynczej 150 mg. Ogólna częstość występowania działań niepożądanych prawdopodobnie związanych ze stosowaniem preparatu DIFLUCAN wynosiła 26%. U 422 pacjentów otrzymujących aktywne środki porównawcze częstość występowania wyniosła 16%. Najczęstszymi zdarzeniami niepożądanymi związanymi z leczeniem zgłaszanymi u pacjentek, które otrzymały pojedynczą dawkę 150 mg flukonazolu z powodu zapalenia pochwy, były ból głowy (13%), nudności (7%) i ból brzucha (6%). Inne działania niepożądane zgłaszane z częstością równą lub większą niż 1% obejmowały biegunkę (3%), niestrawność (1%), zawroty głowy (1%) i zaburzenia smaku (1%). Większość zgłoszonych działań niepożądanych miała nasilenie łagodne do umiarkowanego. Rzadko zgłaszano obrzęk naczynioruchowy i reakcję anafilaktyczną podczas wprowadzania do obrotu.
U pacjentów otrzymujących wielokrotne dawki z powodu innych infekcji
Szesnaście procent z ponad 4000 pacjentów leczonych DIFLUCAN (flukonazolem) w badaniach klinicznych trwających 7 dni lub więcej doświadczyło działań niepożądanych. Leczenie przerwano u 1,5% pacjentów z powodu niepożądanych zdarzeń klinicznych oraz u 1,3% pacjentów z powodu nieprawidłowych wyników badań laboratoryjnych.
Kliniczne zdarzenia niepożądane zgłaszano częściej u pacjentów zakażonych HIV (21%) niż u pacjentów niezakażonych HIV (13%); jednak wzorce u pacjentów zakażonych i niezakażonych HIV były podobne. Odsetki pacjentów przerywających terapię z powodu klinicznych działań niepożądanych były podobne w obu grupach (1,5%).
Następujące kliniczne zdarzenia niepożądane związane z leczeniem wystąpiły z częstością 1% lub większą u 4048 pacjentów otrzymujących DIFLUCAN 50 mg przez 7 lub więcej dni w badaniach klinicznych: nudności 3,7%, ból głowy 1,9%, wysypka skórna 1,8%, wymioty 1,7%, ból brzucha ból 1,7%, biegunka 1,5%.
wątrobowo-żółciowy
połączonych badaniach klinicznych i doświadczeniach z wprowadzaniem do obrotu występowały rzadkie przypadki ciężkich reakcji wątrobowych podczas leczenia preparatem DIFLUCAN. (Widzieć OSTRZEŻENIA .) Spektrum tych reakcji wątrobowych wahało się od łagodnego, przejściowego podwyższenia aktywności aminotransferaz do klinicznego zapalenia wątroby, cholestazy i piorunującej niewydolności wątroby, w tym zgonów. Odnotowano przypadki śmiertelnych reakcji ze strony wątroby, które występowały głównie u pacjentów z poważnymi chorobami podstawowymi (głównie AIDS lub nowotwór złośliwy) i często podczas przyjmowania wielu jednocześnie leków. U pacjentów bez innych możliwych do zidentyfikowania czynników ryzyka wystąpiły przemijające reakcje wątrobowe, w tym zapalenie wątroby i żółtaczka. W każdym z tych przypadków czynność wątroby powracała do wartości wyjściowych po odstawieniu preparatu DIFLUCAN.
dwóch badaniach porównawczych oceniających skuteczność preparatu DIFLUCAN w hamowaniu nawrotu kryptokokowego zapalenia opon mózgowo-rdzeniowych zaobserwowano statystycznie istotny wzrost mediany poziomu AST (SGOT) od wartości początkowej 30 j.m./l do 41 j.m./l w jednym badaniu i 34 IU/L do 66 IU/L w drugiej. Ogólna częstość zwiększenia aktywności aminotransferaz w surowicy ponad 8-krotność górnej granicy normy wynosiła około 1% u pacjentów leczonych flukonazolem w badaniach klinicznych. Zwiększenia te wystąpiły u pacjentów z ciężką chorobą podstawową, głównie z AIDS lub nowotworami złośliwymi, z których większość otrzymywała jednocześnie wiele leków, w tym wiele, o których wiadomo, że są hepatotoksyczne. Częstość występowania nieprawidłowo podwyższonej aktywności aminotransferaz w surowicy była większa u pacjentów przyjmujących DIFLUCAN jednocześnie z co najmniej jednym z następujących leków: ryfampicyną, fenytoiną, izoniazydem, kwasem walproinowym lub doustnymi środkami hipoglikemizującymi zawierającymi pochodne sulfonylomocznika.
Doświadczenie pomarketingowe
Ponadto w okresie po wprowadzeniu produktu do obrotu wystąpiły następujące zdarzenia niepożądane.
immunologiczne: W rzadkich przypadkach zgłaszano anafilaksję (w tym obrzęk naczynioruchowy, obrzęk twarzy i świąd).
Ciało jako całość: Astenia, zmęczenie, gorączka, złe samopoczucie.
Układ sercowo-naczyniowy: Wydłużenie odstępu QT, torsade de pointes. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Ośrodkowy układ nerwowy: Drgawki, zawroty głowy.
Hematopoetyczne i limfatyczne: Leukopenia, w tym neutropenia i agranulocytoza, małopłytkowość.
Metaboliczny: Hipercholesterolemia, hipertriglicerydemia, hipokaliemia.
Przewód pokarmowy: Cholestaza, suchość w ustach, uszkodzenie komórek wątroby, niestrawność, wymioty.
Inne zmysły: Perwersja smaku.
Układ mięśniowo-szkieletowy: bóle mięśni.
System nerwowy: Bezsenność, parestezje, senność, drżenie, zawroty głowy.
Skóra i przydatki: Ostra uogólniona osutka krostkowa, wysypka polekowa, w tym wysypka polekowa, wzmożona potliwość, złuszczające choroby skóry, w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, reakcja polekowa z eozynofilią i objawami ogólnoustrojowymi (DRESS) (patrz OSTRZEŻENIA ), łysienie.
Działania niepożądane u dzieci
Wzór i częstość występowania zdarzeń niepożądanych i nieprawidłowości laboratoryjnych odnotowanych podczas pediatrycznych badań klinicznych są porównywalne z obserwowanymi u dorosłych.
W badaniach klinicznych fazy II/III przeprowadzonych w Stanach Zjednoczonych i Europie 577 pacjentów pediatrycznych w wieku od 1 dnia do 17 lat leczono preparatem DIFLUCAN w dawkach do 15 mg/kg/dobę przez okres do 1616 dni. Trzynaście procent dzieci doświadczyło działań niepożądanych związanych z leczeniem. Najczęściej zgłaszanymi zdarzeniami były wymioty (5%), ból brzucha (3%), nudności (2%) i biegunka (2%). Leczenie przerwano u 2,3% pacjentów z powodu niepożądanych zdarzeń klinicznych oraz u 1,4% pacjentów z powodu nieprawidłowych wyników badań laboratoryjnych. Większość nieprawidłowości laboratoryjnych związanych z leczeniem stanowiła podwyższona aktywność aminotransferaz lub fosfatazy alkalicznej.
Odsetek pacjentów ze skutkami ubocznymi związanymi z leczeniem
INTERAKCJE Z LEKAMI
(Widzieć PRZECIWWSKAZANIA .) Flukonazol jest umiarkowanym inhibitorem CYP2C9 i CYP3A4. Flukonazol jest również silnym inhibitorem CYP2C19. Pacjenci leczeni preparatem DIFLUCAN, którzy są również jednocześnie leczeni lekami o wąskim oknie terapeutycznym metabolizowanymi przez CYP2C9 i CYP3A4, powinni być monitorowani pod kątem działań niepożądanych związanych z jednocześnie podawanymi lekami. Oprócz obserwowanych/udokumentowanych interakcji wymienionych poniżej, istnieje ryzyko zwiększonego stężenia w osoczu innych związków metabolizowanych przez CYP2C9, CYP2C19 i CYP3A4 jednocześnie podawanych z flukonazolem. Dlatego należy zachować ostrożność podczas stosowania tych kombinacji, a pacjentów należy dokładnie monitorować. Działanie hamujące enzymy flukonazolu utrzymuje się 4 do 5 dni po przerwaniu leczenia flukonazolem ze względu na długi okres półtrwania flukonazolu. Zaobserwowano klinicznie lub potencjalnie istotne interakcje leków między preparatem DIFLUCAN 200 mg a następującymi lekami/klasami, które opisano bardziej szczegółowo poniżej:
Alfentanyl
W badaniu zaobserwowano zmniejszenie klirensu i objętości dystrybucji, a także wydłużenie t½ alfentanylu po jednoczesnym leczeniu flukonazolem. Możliwym mechanizmem działania jest hamowanie CYP3A4 przez flukonazol. Może być konieczne dostosowanie dawki alfentanylu.
Amiodaron
Jednoczesne podawanie flukonazolu z amiodaronem może powodować wydłużenie odstępu QT. Należy zachować ostrożność, jeśli konieczne jest jednoczesne stosowanie flukonazolu i amiodaronu, zwłaszcza dużych dawek flukonazolu (800 mg).
Amitryptylina, Nortryptylina
Flukonazol nasila działanie amitryptyliny i nortryptyliny. 5-Nortryptylinę i (lub) S-amitryptylinę można oznaczać na początku leczenia skojarzonego i po 1 tygodniu. W razie potrzeby należy dostosować dawkowanie amitryptyliny/nortryptyliny.
Amfoterycyna B
Jednoczesne podawanie flukonazolu i amfoterycyny B zakażonym myszom zdrowym i immunosupresyjnym wykazało następujące wyniki: niewielki addytywny efekt przeciwgrzybiczy w zakażeniu układowym Candida albicans, brak interakcji w zakażeniu wewnątrzczaszkowym Cryptococcus neoformans oraz antagonizm obu leków w zakażeniu układowym A fumigatus. Kliniczne znaczenie wyników uzyskanych w tych badaniach nie jest znane.
Azytromycyna
W otwartym, randomizowanym, trójczynnikowym badaniu krzyżowym z udziałem 18 zdrowych osób oceniano wpływ pojedynczej doustnej dawki 1200 mg azytromycyny na farmakokinetykę pojedynczej doustnej dawki 800 mg flukonazolu, a także wpływ flukonazolu na farmakokinetykę azytromycyny. Nie stwierdzono istotnych interakcji farmakokinetycznych między flukonazolem a azytromycyną.
Blokery kanału wapniowego
Niektórzy antagoniści kanału wapniowego (nifedypina, isradypina, amlodypina, werapamil i felodypina) są metabolizowane przez CYP3A4. Flukonazol może zwiększać ogólnoustrojową ekspozycję antagonistów kanału wapniowego. Zaleca się częste monitorowanie zdarzeń niepożądanych.
Karbamazepina
Flukonazol hamuje metabolizm karbamazepiny i zaobserwowano wzrost stężenia karbamazepiny w surowicy o 30%. Istnieje ryzyko rozwoju toksyczności karbamazepiny. Może być konieczne dostosowanie dawki karbamazepiny w zależności od pomiarów stężenia/efektu.
Celekoksyb
Podczas jednoczesnego leczenia flukonazolem (200 mg na dobę) i celekoksybem (200 mg), Cmax i AUC celekoksybu wzrosły odpowiednio o 68% i 134%. W połączeniu z flukonazolem może być konieczna połowa dawki celekoksybu.
Antykoagulanty typu kumaryny
Czas protrombinowy może ulec wydłużeniu u pacjentów otrzymujących jednocześnie DIFLUCAN 150 mg i antykoagulanty typu kumaryny. Po wprowadzeniu produktu leczniczego do obrotu, podobnie jak w przypadku innych azolowych leków przeciwgrzybiczych, zgłaszano krwawienia (siniaki, krwawienie z nosa, krwawienia z przewodu pokarmowego, krwiomocz i smoliste stolce) w związku z wydłużeniem czasu protrombinowego u pacjentów otrzymujących flukonazol jednocześnie z warfaryną. Zaleca się dokładne monitorowanie czasu protrombinowego u pacjentów otrzymujących DIFLUCAN 50 mg i antykoagulanty typu kumaryny. Może być konieczne dostosowanie dawki warfaryny. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Cyklofosfamid
Terapia skojarzona z cyklofosfamidem i flukonazolem powoduje wzrost stężenia bilirubiny i kreatyniny w surowicy. Kombinację można stosować biorąc pod uwagę zwiększone ryzyko wzrostu stężenia bilirubiny i kreatyniny w surowicy.
Cyklosporyna
DIFLUCAN 100 mg znacząco zwiększa stężenie cyklosporyny u pacjentów po przeszczepieniu nerki z zaburzeniami czynności nerek lub bez. U pacjentów otrzymujących DIFLUCAN i cyklosporynę zaleca się dokładne monitorowanie stężenia cyklosporyny i kreatyniny w surowicy. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .) Ta kombinacja może być stosowana przez zmniejszenie dawki cyklosporyny w zależności od stężenia cyklosporyny.
Fentanyl
Zgłoszono jeden śmiertelny przypadek możliwej interakcji fentanylu z flukonazolem. Autor ocenił, że pacjent zmarł z powodu zatrucia fentanylem. Ponadto w randomizowanym badaniu krzyżowym z udziałem 12 zdrowych ochotników wykazano, że flukonazol znacznie opóźnił eliminację fentanylu. Podwyższone stężenie fentanylu może prowadzić do depresji oddechowej.
Inhibitory reduktazy HMG-CoA
Ryzyko miopatii i rabdomiolizy wzrasta, gdy flukonazol jest podawany jednocześnie z inhibitorami reduktazy HMG-CoA metabolizowanymi przez CYP3A4, takimi jak atorwastatyna i symwastatyna, lub przez CYP2C9, takimi jak fluwastatyna. Jeśli konieczne jest jednoczesne leczenie, należy obserwować pacjenta pod kątem objawów miopatii i rabdomiolizy oraz monitorować aktywność kinazy kreatyninowej. Inhibitory reduktazy HMG-CoA należy odstawić w przypadku zaobserwowania znacznego wzrostu kinazy kreatyninowej lub rozpoznania lub podejrzenia miopatii/rabdomiolizy.
Hydrochlorotiazyd
W badaniu interakcji farmakokinetycznych jednoczesne podawanie wielokrotnych dawek hydrochlorotiazydu zdrowym ochotnikom otrzymującym flukonazol zwiększało stężenie flukonazolu w osoczu o 40%. Efekt o takim nasileniu nie powinien powodować konieczności zmiany schematu dawkowania flukonazolu u pacjentów otrzymujących jednocześnie leki moczopędne.
Ibrutinib
Umiarkowane inhibitory CYP3A4, takie jak flukonazol, mogą zwiększać stężenie ibrutynibu w osoczu i zwiększać ryzyko działań niepożądanych związanych z ibrutynibem. Jeśli ibrutynib i flukonazol są podawane jednocześnie, należy zmniejszyć dawkę ibrutynibu zgodnie z zaleceniami zawartymi w ulotce ibrutynibu, a pacjenta należy często monitorować pod kątem jakichkolwiek działań niepożądanych związanych z ibrutynibem.
Lemborexant
Jednoczesne podawanie flukonazolu zwiększało Cmax i AUC lemboreksanta odpowiednio około 1,6- i 4,2-krotnie, co powinno zwiększać ryzyko wystąpienia działań niepożądanych, takich jak senność. Należy unikać jednoczesnego stosowania preparatu DIFLUCAN z lemborexantem.
Losartan
Flukonazol hamuje metabolizm losartanu do jego aktywnego metabolitu (E-31 74), który jest odpowiedzialny za większość antagonizmu z receptorem angiotensyny II, który występuje podczas leczenia losartanem. Pacjenci powinni stale monitorować ciśnienie krwi.
Metadon
Flukonazol może zwiększać stężenie metadonu w surowicy. Może być konieczne dostosowanie dawki metadonu.
Niesteroidowe leki przeciwzapalne
Wartości Cmax i AUC flurbiprofenu były zwiększone odpowiednio o 23% i 81% w przypadku jednoczesnego podawania z flukonazolem w porównaniu z podawaniem samego flurbiprofenu. Podobnie, Cmax i AUC farmakologicznie czynnego izomeru [S-(+)-ibuprofenu] były zwiększone odpowiednio o 15% i 82%, gdy flukonazol podawano jednocześnie z racemicznym ibuprofenem (400 mg) w porównaniu z podawaniem samego racemicznego ibuprofenu.
Chociaż nie zostało to szczegółowo zbadane, flukonazol może potencjalnie zwiększać ogólnoustrojową ekspozycję na inne niesteroidowe leki przeciwzapalne (NLPZ) metabolizowane przez CYP2C9 (np. naproksen, lornoksykam, meloksykam, diklofenak). Zaleca się częste monitorowanie zdarzeń niepożądanych i toksyczności związanych z NLPZ. Może być konieczne dostosowanie dawkowania NLPZ.
Olaparyb
Umiarkowane inhibitory CYP3A4, takie jak flukonazol, zwiększają stężenie olaparybu w osoczu; jednoczesne stosowanie nie jest zalecane. Jeśli nie można uniknąć takiego połączenia, należy zmniejszyć dawkę olaparybu zgodnie z instrukcją zawartą w informacji o przepisywaniu leku LYNPARZA® (Olaparib).
Doustne środki antykoncepcyjne
Przeprowadzono dwa badania farmakokinetyczne złożonego doustnego środka antykoncepcyjnego z zastosowaniem wielokrotnych dawek flukonazolu. W badaniu flukonazolu 50 mg nie stwierdzono istotnego wpływu na poziom hormonów, podczas gdy przy dawce 200 mg na dobę AUC etynyloestradiolu i lewonorgestrelu wzrosły odpowiednio o 40% i 24%. Dlatego jest mało prawdopodobne, aby wielokrotne stosowanie flukonazolu w tych dawkach miało wpływ na skuteczność złożonego doustnego środka antykoncepcyjnego.
Hipoglikemia w jamie ustnej
Klinicznie istotna hipoglikemia może być wywołana przez stosowanie preparatu DIFLUCAN z doustnymi lekami hipoglikemizującymi; zgłoszono jeden przypadek zgonu z powodu hipoglikemii w związku ze skojarzonym stosowaniem preparatu DIFLUCAN 150 mg i gliburydu. DIFLUCAN zmniejsza metabolizm tolbutamidu, gliburydu i glipizydu oraz zwiększa stężenie tych środków w osoczu. Gdy DIFLUCAN 100 mg jest stosowany jednocześnie z tymi lub innymi doustnymi lekami hipoglikemizującymi zawierającymi pochodne sulfonylomocznika, należy dokładnie monitorować stężenie glukozy we krwi iw razie potrzeby dostosować dawkę pochodnej sulfonylomocznika. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Fenytoina
DIFLUCAN zwiększa stężenie fenytoiny w osoczu. Zaleca się dokładne monitorowanie stężenia fenytoiny u pacjentów otrzymujących DIFLUCAN 50 mg i fenytoinę. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Pimozyd
Chociaż nie badano tego in vitro ani in vivo, jednoczesne podawanie flukonazolu z pimozydem może powodować zahamowanie metabolizmu pimozydu. Zwiększone stężenia pimozydu w osoczu mogą prowadzić do wydłużenia odstępu QT i rzadkich przypadków torsade de pointes. Jednoczesne podawanie flukonazolu i pimozydu jest przeciwwskazane.
Prednizon
Zgłoszono przypadek, w którym u pacjenta z przeszczepioną wątrobą, leczonego prednizonem, wystąpiła ostra niewydolność kory nadnerczy po przerwaniu 3-miesięcznej terapii flukonazolem. Odstawienie flukonazolu prawdopodobnie spowodowało wzmożoną aktywność CYP3A4, co doprowadziło do zwiększenia metabolizmu prednizonu. Pacjenci długotrwale leczeni flukonazolem i prednizonem powinni być uważnie obserwowani pod kątem niewydolności kory nadnerczy po odstawieniu flukonazolu.
Chinidyna
Chociaż nie badano tego in vitro ani in vivo, jednoczesne podawanie flukonazolu z chinidyną może spowodować zahamowanie metabolizmu chinidyny. Stosowanie chinidyny wiąże się z wydłużeniem odstępu QT i rzadkimi występowaniem torsade de pointes. Jednoczesne podawanie flukonazolu i chinidyny jest przeciwwskazane. (Widzieć PRZECIWWSKAZANIA .)
Ryfabutin
Istnieją doniesienia, że w przypadku jednoczesnego podawania flukonazolu i ryfabutyny występują interakcje, które prowadzą do zwiększenia stężenia ryfabutyny w surowicy do 80%. Istnieją doniesienia o zapaleniu błony naczyniowej oka u pacjentów, którym jednocześnie podawano flukonazol i ryfabutynę. Pacjenci otrzymujący jednocześnie ryfabutynę i flukonazol powinni być dokładnie monitorowani. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
ryfampicyna
Ryfampicyna zwiększa metabolizm jednocześnie podawanego preparatu DIFLUCAN. W zależności od okoliczności klinicznych należy rozważyć zwiększenie dawki preparatu DIFLUCAN 200 mg, gdy jest on podawany z ryfampicyną. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Sakwinawir
Flukonazol zwiększa AUC sakwinawiru o około 50%, Cmax o około 55% i zmniejsza klirens sakwinawiru o około 50% z powodu hamowania metabolizmu wątrobowego sakwinawiru przez CYP3A4 i hamowania glikoproteiny P. Może być konieczne dostosowanie dawki sakwinawiru.
Krótko działające benzodiazepiny
Po podaniu doustnym midazolamu flukonazol powodował znaczne zwiększenie stężenia midazolamu i działania psychomotoryczne. Wydaje się, że ten wpływ na midazolam jest bardziej wyraźny po podaniu doustnym flukonazolu niż po podaniu dożylnym. Jeśli jednocześnie z flukonazolem podawane są krótko działające benzodiazepiny, które są metabolizowane przez układ cytochromu P450, należy rozważyć zmniejszenie dawki benzodiazepin, a pacjentów należy odpowiednio monitorować. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Syrolimus
Flukonazol zwiększa stężenie syrolimusa w osoczu, prawdopodobnie poprzez hamowanie metabolizmu syrolimusa za pośrednictwem CYP3A4 i glikoproteiny P. Ta kombinacja może być stosowana z dostosowaniem dawki sirolimusa w zależności od pomiaru działania/stężenia.
Takrolimus
Flukonazol może nawet pięciokrotnie zwiększać stężenie w surowicy takrolimusu podawanego doustnie z powodu hamowania metabolizmu takrolimusu przez CYP3A4 w jelitach. Nie zaobserwowano istotnych zmian farmakokinetycznych po podaniu takrolimusu dożylnie. Zwiększone poziomy takrolimusu były związane z nefrotoksycznością. Dawkę takrolimusu podawanego doustnie należy zmniejszyć w zależności od stężenia takrolimusu. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Teofilina
DIFLUCAN 50mg zwiększa stężenie teofiliny w surowicy. Zaleca się dokładne monitorowanie stężenia teofiliny w surowicy u pacjentów otrzymujących DIFLUCAN 100 mg i teofilinę. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Tofacytynib
Ekspozycja ogólnoustrojowa na tofacytynib zwiększa się, gdy tofacytynib jest podawany jednocześnie z flukonazolem. Zmniejszyć dawkę tofacytynibu podczas jednoczesnego podawania z flukonazolem (tj. z 5 mg dwa razy na dobę do 5 mg raz na dobę zgodnie z instrukcją na etykiecie XELJANZ [tofacitinib]). (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Tolwaptan
Ekspozycja osocza na tolwaptan jest znacznie zwiększona (200% w AUC; 80% w Cmax), gdy tolwaptan, substrat CYP3A4, jest podawany jednocześnie z flukonazolem, umiarkowanym inhibitorem CYP3A4. Ta interakcja może skutkować ryzykiem znacznego nasilenia działań niepożądanych związanych z tolwaptanem, zwłaszcza znacznej diurezy, odwodnienia i ostrej niewydolności nerek. Jeśli tolwaptan i flukonazol są podawane jednocześnie, dawkę tolwaptanu należy zmniejszyć zgodnie z zaleceniami zawartymi w informacji o przepisaniu tolwaptanu, a pacjenta należy często monitorować pod kątem wszelkich działań niepożądanych związanych z tolwaptanem.
Triazolam
Flukonazol zwiększa AUC triazolamu (pojedyncza dawka) o około 50%, Cmax o 20% do 32% i zwiększa t½ o 25% do 50% z powodu hamowania metabolizmu triazolamu. Może być konieczne dostosowanie dawki HALCION.
Alkaloidy Vinca
Chociaż nie badano tego, flukonazol może zwiększać stężenie alkaloidów barwinka (np. winkrystyny i winblastyny) w osoczu i prowadzić do neurotoksyczności, co prawdopodobnie jest spowodowane hamującym działaniem na CYP3A4.
Witamina A
Na podstawie opisu przypadku u jednego pacjenta otrzymującego terapię skojarzoną kwasem all-trans-retinoidowym (kwasowa forma witaminy A) i flukonazolem, wystąpiły działania niepożądane związane z ośrodkowym układem nerwowym (OUN) w postaci guza rzekomego mózgu, który ustąpił po przerwanie leczenia flukonazolem. Można stosować to połączenie, ale należy pamiętać o występowaniu działań niepożądanych związanych z ośrodkowym układem nerwowym.
Worykonazol
Należy unikać jednoczesnego podawania worykonazolu i flukonazolu. Zaleca się monitorowanie zdarzeń niepożądanych i toksyczności związanej z worykonazolem; zwłaszcza, jeśli worykonazol zostanie rozpoczęty w ciągu 24 godzin od ostatniej dawki flukonazolu. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków .)
Zydowudyna
Flukonazol zwiększa Cmax i AUC zydowudyny odpowiednio o 84% i 74% z powodu zmniejszenia klirensu zydowudyny po podaniu doustnym o około 45%. Okres półtrwania zydowudyny był również wydłużony o około 128% po leczeniu skojarzonym z flukonazolem. Pacjentów otrzymujących to połączenie należy monitorować pod kątem wystąpienia działań niepożądanych związanych z zydowudyną. Można rozważyć zmniejszenie dawki zydowudyny.

Lekarze powinni być świadomi, że nie przeprowadzono badań interakcji z lekami innymi niż wymienione w części FARMAKOLOGIA KLINICZNA, ale takie interakcje mogą wystąpić.
OSTRZEŻENIA
ŚRODKI OSTROŻNOŚCI
Ogólny
Niektóre azole, w tym flukonazol, były związane z wydłużeniem odstępu QT na elektrokardiogramie. Flukonazol powoduje wydłużenie odstępu QT poprzez hamowanie prądu kanału potasowego prostownika (Ikr). Wydłużenie odstępu QT spowodowane przez inne produkty lecznicze (takie jak amiodaron) może zostać wzmocnione poprzez hamowanie cytochromu P450 (CYP) 3A4. (Widzieć ŚRODKI OSTROŻNOŚCI : Interakcje leków .) Podczas nadzoru po wprowadzeniu do obrotu rzadko występowały przypadki wydłużenia odstępu QT i torsade de pointes u pacjentów przyjmujących flukonazol. Większość z tych doniesień dotyczyła ciężko chorych pacjentów z wieloma zakłócającymi czynnikami ryzyka, takimi jak strukturalna choroba serca, zaburzenia elektrolitowe i jednoczesne przyjmowanie leków, które mogły mieć swój udział. Pacjenci z hipokaliemią i zaawansowaną niewydolnością serca są narażeni na zwiększone ryzyko wystąpienia zagrażających życiu arytmii komorowych i torsade de pointes.
Flukonazol należy podawać ostrożnie pacjentom z tymi potencjalnie proarytmicznymi stanami.
Jednoczesne stosowanie flukonazolu i erytromycyny może zwiększać ryzyko kardiotoksyczności (wydłużony odstęp QT, torsade de pointes) i w konsekwencji nagłej śmierci sercowej. Tego połączenia należy unikać.
Flukonazol należy podawać ostrożnie pacjentom z zaburzeniami czynności nerek.
U pacjentów otrzymujących azole, w tym flukonazol, zgłaszano niedoczynność nadnerczy. U pacjentów otrzymujących flukonazol zgłaszano odwracalne przypadki niewydolności nadnerczy.
DIFLUCAN 100 mg proszek do sporządzania zawiesiny doustnej zawiera sacharozę i nie powinien być stosowany u pacjentów z dziedziczną fruktozą, zespołem złego wchłaniania glukozy/galaktozy oraz niedoborem sacharazy-izomaltazy.
Podczas prowadzenia pojazdów lub obsługiwania maszyn należy wziąć pod uwagę, że czasami mogą wystąpić zawroty głowy lub drgawki.
Pojedyncza dawka
Wygodę i skuteczność jednodawkowej doustnej tabletki flukonazolu w leczeniu drożdżaków pochwy należy porównać z dopuszczalnością większej częstości występowania działań niepożądanych związanych z lekiem po zastosowaniu preparatu DIFLUCAN (26%) w porównaniu ze środkami dopochwowymi (16%) w USA porównawcze badania kliniczne. (Widzieć DZIAŁANIA NIEPOŻĄDANE oraz Studia kliniczne .)
Toksykologia niekliniczna
Karcynogeneza, mutageneza i upośledzenie płodności
Flukonazol nie wykazał działania rakotwórczego u myszy i szczurów leczonych doustnie przez 24 miesiące w dawkach 2,5 mg/kg/dobę, 5 mg/kg/dobę lub 10 mg/kg/dobę (około 2 do 7 razy więcej niż zalecana dawka u ludzi ). Samce szczurów, którym podawano 5 mg/kg/dzień i 10 mg/kg/dzień, miały zwiększoną częstość występowania gruczolaków wątrobowokomórkowych.
Flukonazol, z aktywacją metaboliczną lub bez, był ujemny w testach na mutagenność w czterech szczepach S. typhimurium oraz w mysim układzie chłoniaka L5178Y. Badania cytogenetyczne in vivo (komórki mysiego szpiku kostnego po doustnym podaniu flukonazolu) oraz in vitro (ludzkie limfocyty wystawione na działanie flukonazolu w stężeniu 1000 μg/ml) nie wykazały mutacji chromosomowych.
Flukonazol nie wpływał na płodność samców i samic szczurów, którym podawano doustnie dawki dobowe 5 mg/kg, 10 mg/kg lub 20 mg/kg lub dawki pozajelitowe 5 mg/kg, 25 mg/kg lub 75 mg /kg, chociaż początek porodu był nieco opóźniony przy 20 mg/kg PO. W badaniu dożylnym w okresie okołoporodowym u szczurów otrzymujących dawki 5 mg/kg, 20 mg/kg i 40 mg/kg, dystocję i wydłużenie porodu obserwowano u kilku samic otrzymujących dawkę 20 mg/kg (około 5 do 15 razy większą niż zalecana dawka u ludzi). ) i 40 mg/kg, ale nie przy 5 mg/kg. Zaburzenia porodu były odzwierciedlone w nieznacznym wzroście liczby martwo urodzonych młodych i zmniejszeniu przeżywalności noworodków przy tych poziomach dawek. Wpływ na poród u szczurów jest zgodny z właściwościami obniżania poziomu estrogenów specyficznymi dla gatunku wywołanymi przez duże dawki flukonazolu. Takiej zmiany hormonalnej nie obserwowano u kobiet leczonych flukonazolem. (Widzieć FARMAKOLOGIA KLINICZNA .)
Ciąża
Efekty teratogenne
Możliwość uszkodzenia płodu
Należy unikać stosowania w ciąży, z wyjątkiem pacjentek z ciężkimi lub potencjalnie zagrażającymi życiu zakażeniami grzybiczymi, u których flukonazol może być stosowany, jeśli przewidywane korzyści przewyższają możliwe ryzyko dla płodu. W kilku opublikowanych opisach przypadków opisano wzorzec wyraźnych wad wrodzonych u niemowląt narażonych w okresie życia płodowego na matczyne duże dawki flukonazolu (400-800 mg/dobę) przez większość lub przez cały pierwszy trymestr. Te zgłoszone anomalie są podobne do tych obserwowanych w badaniach na zwierzętach. U kobiet w wieku rozrodczym leczonych preparatem DIFLUCAN w dawce 400 do 800 mg/dobę należy rozważyć skuteczne środki antykoncepcyjne, które należy stosować przez cały okres leczenia oraz przez około 1 tydzień (5 do 6 okresów półtrwania) po podaniu ostatniej dawki. Jeśli DIFLUCAN jest stosowany w okresie ciąży lub jeśli pacjentka zajdzie w ciążę podczas przyjmowania leku, pacjentkę należy poinformować o potencjalnym zagrożeniu dla płodu. Na podstawie retrospektywnych badań epidemiologicznych sugerowano samoistne poronienia i wady wrodzone jako potencjalne ryzyko związane ze stosowaniem 150 mg flukonazolu w pojedynczej lub wielokrotnej dawce w pierwszym trymestrze ciąży. Nie ma odpowiednich i dobrze kontrolowanych badań produktu DIFLUCAN 150 mg u kobiet w ciąży. (Widzieć OSTRZEŻENIA : Możliwość uszkodzenia płodu .)
Dane ludzkie
Opisy przypadków opisują charakterystyczny i rzadki wzorzec wad wrodzonych u niemowląt, których matki otrzymywały duże dawki (400 do 800 mg/dobę) flukonazolu przez większość lub przez cały pierwszy trymestr ciąży. Cechy obserwowane u tych niemowląt obejmują brachycefalię, nieprawidłową twarz, nieprawidłowy rozwój czaszki, rozszczep podniebienia, wygięcie kości udowej, cienkie żebra i kości długie, artrogrypozę i wrodzoną chorobę serca. Efekty te są podobne do obserwowanych w badaniach na zwierzętach.
Badania epidemiologiczne sugerują potencjalne ryzyko samoistnych poronień i wad wrodzonych u niemowląt, których matki były leczone 150 mg flukonazolu w dawce pojedynczej lub wielokrotnej w pierwszym trymestrze, ale te badania epidemiologiczne mają ograniczenia i wyniki te nie zostały potwierdzone w kontrolowanych badaniach klinicznych. próby.
Dane zwierząt
Flukonazol podawano doustnie ciężarnym królikom podczas organogenezy w dwóch badaniach w dawkach odpowiednio 5 mg/kg, 10 mg/kg i 20 mg/kg oraz 5 mg/kg, 25 mg/kg i 75 mg/kg. Przyrost masy ciała matki był zaburzony przy wszystkich poziomach dawek (około 0,25 do 4-krotności dawki klinicznej 400 mg w oparciu o porównanie powierzchni ciała [BSA]), a poronienia występowały przy 75 mg/kg (około 4-krotność dawki klinicznej 400 mg w oparciu o porównanie BSA); nie zaobserwowano działań niepożądanych na płód.
kilku badaniach, w których ciężarne szczury otrzymywały flukonazol doustnie podczas organogenezy, przyrost masy ciała matki był zaburzony, a masa łożyska wzrosła do 25 mg/kg. Nie było wpływu na płód przy 5 mg/kg lub 10 mg/kg; przy dawkach 25 mg/kg i 50 mg/kg i wyższych obserwowano wzrost wariantów anatomicznych płodu (żebra nadliczbowe, poszerzenie miedniczek nerkowych) i opóźnienia w kostnieniu. W dawkach od 80 do 320 mg/kg (około 2 do 8 razy więcej niż dawka kliniczna 400 mg na podstawie BSA) śmiertelność zarodków u szczurów była zwiększona, a nieprawidłowości płodu obejmowały faliste żebra, rozszczep podniebienia i nieprawidłowe kostnienie twarzoczaszki. Efekty te są zgodne z hamowaniem syntezy estrogenów u szczurów i mogą być wynikiem znanego wpływu obniżonego estrogenu na ciążę, organogenezę i poród.
Matki karmiące
Na podstawie danych z badania z udziałem 10 kobiet karmiących piersią, które tymczasowo lub na stałe przerwały karmienie piersią od 5 dni do 19 miesięcy po porodzie, flukonazol był obecny w małych stężeniach w mleku matki po podaniu pojedynczej dawki 150 mg. Szacunkowa dobowa dawka flukonazolu dla niemowląt z mleka matki (przy założeniu średniego spożycia mleka 150 ml/kg/dobę) na podstawie średniego szczytowego stężenia w mleku (2,61 mcg/ml [zakres: 1,57 do 3,65 mcg/ml] 5,2 godziny po dawka) wynosiła 0,39 mg/kg/dobę, co stanowi około 13% zalecanej dawki pediatrycznej w leczeniu kandydozy jamy ustnej i gardła. (Oznaczona dawka pediatryczna wynosi 6 mg/kg/dobę pierwszego dnia, a następnie 3 mg/kg/dobę; szacunkowa dawka dla niemowląt wynosi 13% dawki podtrzymującej 3 mg/kg/dobę). Brak danych dotyczących stężenia flukonazolu w mleku po wielokrotnym podaniu lub po podaniu dużych dawek flukonazolu. W opublikowanym badaniu obejmującym 96 kobiet karmiących piersią, które leczono flukonazolem w dawce 150 mg co drugi dzień (średnio 7,3 kapsułek [zakres od 1 do 29 kapsułek]) z powodu drożdżaków piersi związanych z laktacją, nie stwierdzono żadnych poważnych działań niepożądanych u niemowląt. Należy zachować ostrożność podając DIFLUCAN kobiecie karmiącej.
Zastosowanie pediatryczne
Otwarte, randomizowane, kontrolowane badanie wykazało, że preparat DIFLUCAN 100 mg jest skuteczny w leczeniu kandydozy jamy ustnej i gardła u dzieci w wieku od 6 miesięcy do 13 lat. (Widzieć Studia kliniczne .)
Stosowanie preparatu DIFLUCAN 200 mg u dzieci z kryptokokowym zapaleniem opon mózgowo-rdzeniowych, zapaleniem przełyku wywołanym przez Candida lub ogólnoustrojowymi zakażeniami wywołanymi przez Candida jest poparte skutecznością wykazaną dla tych wskazań u dorosłych oraz wynikami kilku małych nieporównawczych badań klinicznych u dzieci. Ponadto badania farmakokinetyczne u dzieci (patrz FARMAKOLOGIA KLINICZNA ) ustaliły proporcjonalność dawki między dziećmi i dorosłymi. (Widzieć DAWKOWANIE I SPOSÓB PODAWANIA .)
nieporównawczym badaniu z udziałem dzieci z poważnymi ogólnoustrojowymi zakażeniami grzybiczymi, z których większość była kandydemią, skuteczność preparatu DIFLUCAN była podobna do tej zgłaszanej w leczeniu kandydemii u dorosłych. Spośród 17 pacjentów z kandydemią potwierdzoną posiewem, 11 z 14 (79%) z objawami początkowymi (3 były bezobjawowe) wyleczono klinicznie; 13/15 (87%) ocenianych pacjentów miało mikologiczne wyleczenie pod koniec leczenia, ale u dwóch z tych pacjentów nastąpił nawrót odpowiednio po 10 i 18 dniach po zaprzestaniu leczenia.
Skuteczność preparatu DIFLUCAN w hamowaniu kryptokokowego zapalenia opon mózgowo-rdzeniowych była skuteczna u 4 z 5 dzieci leczonych w badaniu „compassionate use” flukonazolu w leczeniu zagrażającej życiu lub poważnej grzybicy. Brak informacji dotyczących skuteczności flukonazolu w pierwotnym leczeniu kryptokokowego zapalenia opon mózgowych u dzieci.
Profil bezpieczeństwa preparatu DIFLUCAN 200 mg u dzieci badano u 577 dzieci w wieku od 1 dnia do 17 lat, które otrzymywały dawki od 1 do 15 mg/kg/dobę przez 1 do 1616 dni. (Widzieć DZIAŁANIA NIEPOŻĄDANE .)
Skuteczność preparatu DIFLUCAN nie została ustalona u niemowląt w wieku poniżej 6 miesięcy. (Widzieć FARMAKOLOGIA KLINICZNA .) Niewielka liczba pacjentów (29) w wieku od 1 dnia do 6 miesięcy była bezpiecznie leczona preparatem DIFLUCAN.
Zastosowanie geriatryczne
pacjentów bez AIDS działania niepożądane prawdopodobnie związane z leczeniem flukonazolem zgłaszano u mniejszej liczby pacjentów w wieku 65 lat i starszych (9%, n=339) niż u młodszych pacjentów (14%, n=2240). Jednak nie było spójnej różnicy między starszymi i młodszymi pacjentami w odniesieniu do indywidualnych skutków ubocznych. Spośród najczęściej zgłaszanych (>1%) działań niepożądanych wysypka, wymioty i biegunka występowały u większego odsetka starszych pacjentów. Podobny odsetek starszych pacjentów (2,4%) i młodszych (1,5%) przerwał leczenie flukonazolem z powodu działań niepożądanych. Z doświadczenia po wprowadzeniu produktu do obrotu wynika, że spontaniczne zgłoszenia niedokrwistości i ostrej niewydolności nerek występowały częściej u pacjentów w wieku 65 lat lub starszych niż u pacjentów w wieku od 12 do 65 lat. Ze względu na dobrowolny charakter zgłoszeń oraz naturalny wzrost częstości występowania niedokrwistości i niewydolności nerek u osób starszych nie jest jednak możliwe ustalenie związku przyczynowego z ekspozycją na lek.
Kontrolowane badania kliniczne flukonazolu nie obejmowały wystarczającej liczby pacjentów w wieku 65 lat i starszych, aby ocenić, czy w każdym ze wskazań reagują oni inaczej niż u młodszych pacjentów. Inne zgłoszone doświadczenia kliniczne nie wykazały różnic w odpowiedziach między pacjentami w podeszłym wieku i młodszymi.
Flukonazol jest usuwany głównie przez nerki w postaci niezmienionej. Ponieważ u pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo upośledzenia czynności nerek, należy zachować ostrożność, aby dostosować dawkę na podstawie klirensu kreatyniny. Przydatne może być monitorowanie czynności nerek. (Widzieć FARMAKOLOGIA KLINICZNA oraz DAWKOWANIE I SPOSÓB PODAWANIA .)
PRZEDAWKOWAĆ
Istnieją doniesienia o przedawkowaniu flukonazolu, któremu towarzyszyły omamy i zachowania paranoidalne.
W przypadku przedawkowania należy wdrożyć leczenie objawowe (z leczeniem podtrzymującym i płukaniem żołądka, jeśli jest to klinicznie wskazane).
Flukonazol jest w dużej mierze wydalany z moczem. 3-godzinna sesja hemodializy zmniejsza stężenie w osoczu o około 50%.
myszy i szczurów otrzymujących bardzo duże dawki flukonazolu objawy kliniczne u obu gatunków obejmowały zmniejszoną motorykę i oddychanie, opadanie powiek, łzawienie, ślinienie, nietrzymanie moczu, utratę odruchu postawy i sinicę; śmierć była czasami poprzedzona konwulsjami klonicznymi.
PRZECIWWSKAZANIA
DIFLUCAN (flukonazol) jest przeciwwskazany u pacjentów z nadwrażliwością na flukonazol lub na którąkolwiek substancję pomocniczą. Brak informacji dotyczących nadwrażliwości krzyżowej między flukonazolem a innymi azolowymi lekami przeciwgrzybiczymi. Należy zachować ostrożność przepisując DIFLUCAN pacjentom z nadwrażliwością na inne azole. Jednoczesne podawanie innych leków, o których wiadomo, że wydłużają odstęp QT i które są metabolizowane przez enzym CYP3A4, takich jak erytromycyna, pimozyd i chinidyna, jest przeciwwskazane u pacjentów otrzymujących flukonazol. (Widzieć FARMAKOLOGIA KLINICZNA : Badania interakcji leków oraz ŚRODKI OSTROŻNOŚCI .)
FARMAKOLOGIA KLINICZNA
Farmakokinetyka i metabolizm
Właściwości farmakokinetyczne flukonazolu są podobne po podaniu dożylnym lub doustnym. U zdrowych ochotników biodostępność podawanego doustnie flukonazolu wynosi ponad 90% w porównaniu z podaniem dożylnym. Biorównoważność została ustalona między tabletką 100 mg a obydwoma mocami zawiesin przy podawaniu w pojedynczej dawce 200 mg.
Maksymalne stężenie w osoczu (Cmax) u zdrowych ochotników na czczo występuje między 1 a 2 godzinami, a okres półtrwania w końcowej fazie eliminacji z osocza wynosi około 30 godzin (zakres: 20 do 50 godzin) po podaniu doustnym.
U zdrowych ochotników na czczo, podanie pojedynczej doustnej dawki 400 mg DIFLUCAN (flukonazol) prowadzi do średniego Cmax wynoszącego 6,72 µg/ml (zakres: 4,12 do 8,08 µg/ml), a po pojedynczych dawkach doustnych od 50 do 400 mg flukonazolu Stężenia w osoczu i pole pod krzywą zależności stężenia w osoczu od czasu (AUC) są proporcjonalne do dawki.
Dane Cmax i AUC z badania wpływu pokarmu obejmującego podawanie tabletek DIFLUCAN (flukonazol) zdrowym ochotnikom na czczo i z posiłkiem o dużej zawartości tłuszczu wskazują, że pokarm nie wpływa na ekspozycję na lek. Dlatego DIFLUCAN można przyjmować niezależnie od posiłków. (Widzieć DAWKOWANIE I SPOSÓB PODAWANIA .)
Stężenia w stanie stacjonarnym są osiągane w ciągu 5 do 10 dni po podaniu doustnym dawek od 50 do 400 mg raz na dobę. Podanie dawki nasycającej (w 1. dniu) dwukrotnie większej od zwykłej dawki dobowej powoduje, że stężenia w osoczu zbliżają się do stanu stacjonarnego do drugiego dnia. Pozorna objętość dystrybucji flukonazolu jest zbliżona do całkowitej objętości wody w organizmie. Wiązanie z białkami osocza jest niskie (11 do 12%). Po jednorazowym lub wielokrotnym podaniu doustnym przez okres do 14 dni flukonazol przenika do wszystkich badanych płynów ustrojowych (patrz Tabela poniżej ). U zdrowych ochotników stężenia flukonazolu w ślinie były równe lub nieco większe niż stężenia w osoczu, niezależnie od dawki, drogi lub czasu trwania dawkowania. U pacjentów z rozstrzeniem oskrzeli stężenie flukonazolu w plwocinie po podaniu pojedynczej dawki doustnej 150 mg było równe stężeniu w osoczu zarówno po 4, jak i 24 godzinach od podania dawki. U pacjentów z grzybiczym zapaleniem opon mózgowo-rdzeniowych stężenie flukonazolu w płynie mózgowo-rdzeniowym (PMR) wynosi około 80% odpowiednich stężeń w osoczu.
Pojedyncza doustna dawka 150 mg flukonazolu podana 27 pacjentkom przeniknęła do tkanki pochwy, w wyniku czego stosunek tkanka:osocze wahał się od 0,94 do 1,14 w ciągu pierwszych 48 godzin po podaniu.
Pojedyncza doustna dawka 150 mg flukonazolu podana 14 pacjentkom przeniknęła do wydzieliny pochwowej, w wyniku czego stosunek płyn: osocze wahał się od 0,36 do 0,71 w ciągu pierwszych 72 godzin po podaniu.
zdrowych ochotników flukonazol jest usuwany głównie przez nerki, a około 80% podanej dawki pojawia się w moczu w postaci niezmienionej. Około 11% dawki jest wydalane z moczem w postaci metabolitów.
Zmniejszenie czynności nerek znacząco wpływa na farmakokinetykę flukonazolu. Istnieje odwrotna zależność między okresem półtrwania w fazie eliminacji a klirensem kreatyniny. U pacjentów z zaburzeniami czynności nerek może być konieczne zmniejszenie dawki preparatu DIFLUCAN. (Widzieć DAWKOWANIE I SPOSÓB PODAWANIA .) 3-godzinna sesja hemodializy zmniejsza stężenie w osoczu o około 50%.
U zdrowych ochotników podawanie preparatu DIFLUCAN (dawki w zakresie od 200 mg do 400 mg raz na dobę przez okres do 14 dni) wiązało się z niewielkim i niespójnym wpływem na stężenia testosteronu, stężenia endogennych kortykosteroidów oraz odpowiedź kortyzolu stymulowaną hormonem adrenokortykotropowym (ACTH).
Farmakokinetyka u dzieci
dzieci zgłoszono następujące dane farmakokinetyczne {Średnia (%cv)}:
W badaniach tych wiek nie miał wpływu na klirens skorygowany o masę ciała. Stwierdzono, że średni klirens u dorosłych wynosi 0,23 (17%) ml/min/kg.
U wcześniaków (wiek ciążowy od 26 do 29 tygodni) średni (%cv) klirens w ciągu 36 godzin od urodzenia wynosił 0,180 (35%, N=7) ml/min/kg, który z czasem wzrastał do średnio 0,218 ( 31%, N=9) ml/min/kg sześć dni później i 0,333 (56%, N=4) ml/min/kg 12 dni później. Podobnie okres półtrwania wynosił 73,6 godziny i zmniejszał się z czasem do średniej 53,2 godziny sześć dni później i 46,6 godziny 12 dni później.
Farmakokinetyka u osób starszych
Badanie farmakokinetyczne przeprowadzono z udziałem 22 osób w wieku 65 lat lub starszych otrzymujących pojedynczą dawkę doustną 50 mg flukonazolu. Dziesięciu z tych pacjentów otrzymywało jednocześnie leki moczopędne. Cmax wyniosło 1,54 µg/ml i wystąpiło 1,3 godziny po podaniu dawki. Średnia wartość AUC wynosiła 76,4 ± 20,3 µg•h/ml, a średni końcowy okres półtrwania 46,2 godziny. Te wartości parametrów farmakokinetycznych są wyższe niż analogiczne wartości zgłaszane dla normalnych młodych ochotników płci męskiej. Jednoczesne podawanie leków moczopędnych nie zmieniało znacząco AUC ani Cmax. Ponadto klirens kreatyniny (74 ml/min), odsetek leku odzyskanego w postaci niezmienionej w moczu (0 do 24 godzin, 22%) oraz szacunkowy klirens nerkowy flukonazolu (0,124 ml/min/kg) u osób w podeszłym wieku były na ogół niższe. niż młodszych wolontariuszy. Wydaje się zatem, że zmiana rozmieszczenia flukonazolu u osób starszych jest związana z charakterystyczną dla tej grupy obniżoną czynnością nerek. Wykres okresu półtrwania w końcowej fazie eliminacji każdego pacjenta w porównaniu z klirensem kreatyniny w porównaniu z przewidywanym okresem półtrwania – krzywa klirensu kreatyniny uzyskana od osób zdrowych i osób z różnym stopniem niewydolności nerek wskazuje, że 21 z 22 osób mieściło się w 95% granica ufności przewidywanego okresu półtrwania krzywych klirensu kreatyniny. Wyniki te są zgodne z hipotezą, że wyższe wartości parametrów farmakokinetycznych obserwowane u osób w podeszłym wieku w porównaniu z normalnymi młodymi ochotnikami płci męskiej wynikają z oczekiwanego upośledzenia czynności nerek u osób w podeszłym wieku.
Badania interakcji leków
(Widzieć INTERAKCJE Z LEKAMI )
Doustne środki antykoncepcyjne
Doustne środki antykoncepcyjne podawano w pojedynczej dawce zarówno przed, jak i po doustnym podaniu preparatu DIFLUCAN 50 mg raz na dobę przez 10 dni 10 zdrowym kobietom. Nie było istotnej różnicy w AUC etynyloestradiolu lub lewonorgestrelu po podaniu 50 mg DIFLUCAN. Średni wzrost AUC etynyloestradiolu wyniósł 6% (zakres: –47 do 108%), a AUC lewonorgestrelu zwiększyło się o 17% (zakres: –33 do 141%).
drugim badaniu dwadzieścia pięć zdrowych kobiet otrzymywało dzienne dawki zarówno tabletek 200 mg DIFLUCAN 150 mg, jak i placebo przez dwa, dziesięciodniowe okresy. Cykle leczenia odbywały się w odstępie jednego miesiąca, przy czym wszyscy pacjenci otrzymywali DIFLUCAN w jednym cyklu i placebo w drugim. Kolejność leczenia w badaniu była losowa. Pojedyncze dawki doustnej tabletki antykoncepcyjnej zawierającej lewonorgestrel i etynyloestradiol podawano w ostatnim dniu leczenia (dzień 10) obu cykli. Po podaniu 200 mg preparatu DIFLUCAN średni procentowy wzrost AUC dla lewonorgestrelu w porównaniu z placebo wyniósł 25% (zakres: -12 do 82%), a średni procentowy wzrost dla etynyloestradiolu w porównaniu z placebo wyniósł 38% (zakres: – 11 do 101%). Oba te wzrosty były statystycznie istotnie różne od placebo.
trzecim badaniu oceniano potencjalną interakcję podawania raz w tygodniu 300 mg flukonazolu 21 zdrowym kobietom stosującym doustne środki antykoncepcyjne zawierające etynyloestradiol i noretyndron. W tym kontrolowanym placebo, podwójnie zaślepionym, randomizowanym, dwukierunkowym badaniu naprzemiennym, przeprowadzonym w trzech cyklach doustnych środków antykoncepcyjnych, podawanie flukonazolu powodowało niewielki wzrost średnich wartości AUC etynyloestradiolu i noretyndronu w porównaniu z podobnym dawkowaniem placebo. Średnie AUC etynyloestradiolu i noretyndronu wzrosły odpowiednio o 24% (95% przedział CI: 18 do 31%) i 13% (95% przedział CI: 8 do 18%), w porównaniu z placebo. Leczenie flukonazolem nie powodowało zmniejszenia AUC etynyloestradiolu u żadnego osobnika w tym badaniu w porównaniu z dawkowaniem placebo. Poszczególne wartości AUC noretyndronu zmniejszyły się bardzo nieznacznie (
Cymetydyna
DIFLUCAN 100 mg podano w pojedynczej dawce doustnej w monoterapii i dwie godziny po pojedynczej dawce 400 mg cymetydyny sześciu zdrowym ochotnikom płci męskiej. Po podaniu cymetydyny nastąpiło znaczne zmniejszenie AUC i Cmax flukonazolu. Wystąpiło średnie ± SD zmniejszenie AUC flukonazolu o 13% ± 11% (zakres: –3,4 do –31%), a Cmax zmniejszyło się o 19% ± 14% (zakres: –5 do –40). %). Jednak podawanie dożylne cymetydyny w dawce 600 mg do 900 mg w ciągu czterech godzin (od godziny przed do 3 godzin po podaniu pojedynczej dawki doustnej 200 mg preparatu DIFLUCAN) nie miało wpływu na biodostępność ani farmakokinetykę flukonazolu u 24 zdrowych ochotników płci męskiej. .
Środek zobojętniający kwas
Podanie Maalox® (20 ml) 14 normalnym ochotnikom płci męskiej bezpośrednio przed pojedynczą dawką 100 mg DIFLUCAN nie miało wpływu na wchłanianie lub eliminację flukonazolu.
Hydrochlorotiazyd
Jednoczesne podawanie doustne 100 mg DIFLUCAN i 50 mg hydrochlorotiazydu przez 10 dni 13 zdrowym ochotnikom powodowało istotne zwiększenie AUC i Cmax flukonazolu w porównaniu do samego DIFLUCAN. Wystąpiło średnie ± SD zwiększenie AUC i Cmax flukonazolu odpowiednio o 45% ± 31% (zakres: 19 do 114%) i 43% ± 31% (zakres: 19 do 122%). Zmiany te przypisuje się średniemu ± SD zmniejszenia klirensu nerkowego o 30% ± 12% (zakres: od -10 do 50%).
ryfampicyna
Podanie pojedynczej doustnej dawki 200 mg produktu DIFLUCAN 200 mg po 15 dniach ryfampicyny podawanej w dawce 600 mg na dobę ośmiu zdrowym ochotnikom płci męskiej spowodowało istotne zmniejszenie AUC flukonazolu i znaczne zwiększenie pozornego klirensu flukonazolu po podaniu doustnym. Wystąpiło średnie ± SD zmniejszenie AUC flukonazolu o 23% ± 9% (zakres: od -13 do -42%). Pozorny klirens flukonazolu po podaniu doustnym wzrósł o 32% ± 17% (zakres: 16 do 72%). Okres półtrwania flukonazolu zmniejszył się z 33,4 ± 4,4 godziny do 26,8 ± 3,9 godziny. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Warfaryna
Po podaniu pojedynczej dawki warfaryny (15 mg) 13 zdrowym ochotnikom płci męskiej po podaniu doustnym preparatu DIFLUCAN 200 mg na dobę przez 14 dni wystąpił istotny wzrost odpowiedzi protrombinowej (obszar pod krzywą protrombinową w funkcji czasu w funkcji czasu) w porównaniu z podawaniem samej warfaryny. Wystąpił średni ± SD wzrost odpowiedzi protrombinowej w czasie (obszar pod krzywą protrombinową czas-czas) o 7% ± 4% (zakres: -2 do 13%). (Widzieć ŚRODKI OSTROŻNOŚCI .) Średnia jest oparta na danych od 12 podmiotów, ponieważ jeden z 13 podmiotów doświadczył 2-krotnego wzrostu swojej odpowiedzi w czasie protrombinowym.
Fenytoina
AUC fenytoiny określono po 4 dniach podawania fenytoiny (200 mg dziennie, doustnie przez 3 dni, a następnie 250 mg dożylnie dla jednej dawki) zarówno z, jak i bez flukonazolu (doustnie DIFLUCAN 200 mg dziennie przez 16 dni) u 10 zdrowych mężczyzn wolontariusze. Wystąpił znaczny wzrost AUC fenytoiny. Średni ± SD wzrost AUC fenytoiny wyniósł 88% ± 68% (zakres: 16 do 247%). Bezwzględna wielkość tej interakcji jest nieznana ze względu na wewnętrznie nieliniową dyspozycję fenytoiny. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Cyklosporyna
AUC i Cmax cyklosporyny określono przed i po podaniu flukonazolu w dawce 200 mg na dobę przez 14 dni u ośmiu pacjentów po przeszczepieniu nerki, którzy byli leczeni cyklosporyną przez co najmniej 6 miesięcy i otrzymywali stałą dawkę cyklosporyny przez co najmniej 6 tygodni. Po podaniu flukonazolu wystąpił istotny wzrost AUC, Cmax, Cmin (stężenie dobowe) cyklosporyny (stężenie 24-godzinne) oraz znaczne zmniejszenie pozornego klirensu po podaniu doustnym. Średni wzrost AUC o ± SD wyniósł 92% ± 43% (zakres: 18 do 147%). Cmax wzrosło o 60% ± 48% (zakres: –5 do 133%). Cmax wzrosło o 157% ± 96% (zakres: od 33 do 360%). Pozorny klirens w jamie ustnej zmniejszył się o 45% ± 15% (zakres: od -15 do -60%). (Widzieć ŚRODKI OSTROŻNOŚCI .)
Zydowudyna
Stężenia zydowudyny w osoczu oznaczono dwukrotnie (przed i po flukonazolu w dawce 200 mg na dobę przez 15 dni) u 13 ochotników z AIDS lub ARC, którzy otrzymywali stałą dawkę zydowudyny przez co najmniej dwa tygodnie. Po podaniu flukonazolu wystąpił znaczny wzrost AUC zydowudyny. Średni wzrost AUC o ± SD wyniósł 20% ± 32% (zakres: â--27 do 104%). Stosunek metabolitu GZDV do leku macierzystego istotnie zmniejszył się po podaniu flukonazolu, z 7,6 ± 3,6 do 5,7 ± 2,2.
Teofilina
Farmakokinetykę teofiliny określono na podstawie pojedynczej dożylnej dawki aminofiliny (6 mg/kg) przed i po doustnym podaniu 200 mg flukonazolu na dobę przez 14 dni 16 zdrowym ochotnikom płci męskiej. Wystąpiły znaczne zwiększenie AUC, Cmax i okresu półtrwania teofiliny z odpowiednim zmniejszeniem klirensu. Średnia ± SD AUC teofiliny wzrosła o 21% ± 16% (zakres: -5 do 48%). Cmax wzrosło o 13% ± 17% (zakres: –13 do 40%). Klirens teofiliny zmniejszył się o 16% ± 11% (zakres: -32 do 5%). Okres półtrwania teofiliny wzrósł z 6,6 ± 1,7 godziny do 7,9 ± 1,5 godziny. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Chinidyna
Chociaż nie badano tego in vitro ani in vivo, jednoczesne podawanie flukonazolu z chinidyną może spowodować zahamowanie metabolizmu chinidyny. Stosowanie chinidyny wiąże się z wydłużeniem odstępu QT i rzadkimi występowaniem torsade de pointes. Jednoczesne podawanie flukonazolu i chinidyny jest przeciwwskazane. (Widzieć PRZECIWWSKAZANIA oraz ŚRODKI OSTROŻNOŚCI .)
Hipoglikemia w jamie ustnej
Wpływ flukonazolu na farmakokinetykę doustnych leków hipoglikemizujących pochodnych sulfonylomocznika, tolbutamidu, glipizydu i gliburydu, oceniano w trzech badaniach kontrolowanych placebo u zdrowych ochotników. Wszyscy badani otrzymywali samą sulfonylomocznik jako pojedynczą dawkę i ponownie jako pojedynczą dawkę po podawaniu DIFLUCAN 100 mg dziennie przez 7 dni. W tych trzech badaniach u 22/46 (47,8%) pacjentów leczonych preparatem DIFLUCAN i 9/22 (40,1%) pacjentów otrzymujących placebo wystąpiły objawy odpowiadające hipoglikemii. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Tolbutamid
U 13 zdrowych ochotników płci męskiej po podaniu flukonazolu zaobserwowano znaczny wzrost AUC i Cmax tolbutamidu (500 mg dawka pojedyncza). Wystąpił średni ± SD wzrost AUC tolbutamidu o 26% ± 9% (zakres: 12 do 39%). Cmax tolbutamidu wzrosło o 11% ± 9% (zakres: -6 do 27%). (Widzieć ŚRODKI OSTROŻNOŚCI .)
Glipizid
AUC i Cmax glipizydu (2,5 mg dawka pojedyncza) były znacząco zwiększone po podaniu flukonazolu 13 zdrowym ochotnikom płci męskiej. Wystąpił średni ± SD wzrost AUC o 49% ± 13% (zakres: 27 do 73%) i wzrost Cmax o 19% ± 23% (zakres: â–11 do 79%). (Widzieć ŚRODKI OSTROŻNOŚCI .)
Glyburyd
AUC i Cmax gliburydu (pojedyncza dawka 5 mg) były znacząco zwiększone po podaniu flukonazolu 20 zdrowym ochotnikom płci męskiej. Wystąpił średni ± SD wzrost AUC o 44% ± 29% (zakres: â–13 do 115%) i wzrost Cmax o 19% ± 19% (zakres: â–23 do 62%). Pięciu pacjentów wymagało doustnego podania glukozy po spożyciu gliburydu po 7 dniach podawania flukonazolu. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Ryfabutin
Opublikowano doniesienia o interakcji, gdy flukonazol jest podawany jednocześnie z ryfabutyną, prowadząc do zwiększenia stężenia ryfabutyny w surowicy. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Takrolimus
Opublikowano doniesienia, że w przypadku jednoczesnego podawania flukonazolu i takrolimusu występują interakcje, które prowadzą do zwiększenia stężenia takrolimusu w surowicy. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Midazolam
Wpływ flukonazolu na farmakokinetykę i farmakodynamikę midazolamu zbadano w randomizowanym, krzyżowym badaniu z udziałem 12 ochotników. W badaniu badani przyjmowali placebo lub 400 mg flukonazolu w 1. dniu, a następnie 200 mg dziennie od 2. do 6. dnia. Ponadto pierwszego dnia podawano doustnie dawkę 7,5 mg midazolamu, podawano dożylnie 0,05 mg/kg mc. czwartego dnia i 7,5 mg doustnie szóstego dnia. Flukonazol zmniejszał klirens midazolamu podanego dożylnie o 51%. W pierwszym dniu podawania flukonazol zwiększał AUC i Cmax midazolamu odpowiednio o 259% i 150%. W szóstym dniu podawania flukonazol zwiększał AUC i Cmax midazolamu odpowiednio o 259% i 74%. Efekty psychomotoryczne midazolamu były istotnie nasilone po podaniu doustnym midazolamu, ale nie zmieniły się znacząco po podaniu dożylnym midazolamu.
celu określenia wpływu drogi podania flukonazolu na interakcję między flukonazolem i midazolamem przeprowadzono drugie randomizowane, podwójnie pozorowane, kontrolowane placebo, krzyżowe badanie w trzech fazach. W każdej fazie badanym podawano doustnie 400 mg flukonazolu i dożylnie sól fizjologiczną; doustne placebo i dożylne flukonazol 400 mg; oraz doustne placebo i dożylny roztwór soli. Doustną dawkę 7,5 mg midazolamu podano po podaniu flukonazolu/placebo. AUC i Cmax midazolamu były istotnie wyższe po podaniu doustnym niż dożylnym podaniu flukonazolu. Doustny flukonazol zwiększał AUC i Cmax midazolamu odpowiednio o 272% i 129%. Flukonazol podawany dożylnie zwiększał AUC i Cmax midazolamu odpowiednio o 244% i 79%. Zarówno doustny, jak i dożylny flukonazol nasilał działanie farmakodynamiczne midazolamu. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Azytromycyna
otwartym, randomizowanym, trójczynnikowym badaniu krzyżowym z udziałem 18 zdrowych osób oceniano wpływ pojedynczej dawki doustnej 800 mg flukonazolu na farmakokinetykę pojedynczej dawki doustnej 1200 mg azytromycyny, a także wpływ azytromycyny na farmakokinetykę flukonazolu. Nie stwierdzono istotnych interakcji farmakokinetycznych między flukonazolem a azytromycyną.
Worykonazol
Worykonazol jest substratem zarówno dla izoenzymów CYP2C9, jak i CYP3A4. Jednoczesne podawanie doustnego worykonazolu (400 mg co 12 godzin przez 1 dzień, następnie 200 mg co 12 godzin przez 2,5 dnia) i doustnego flukonazolu (400 mg pierwszego dnia, następnie 200 mg co 24 godziny przez 4 dni) spowodowało wzrost Cmax i AUCτ worykonazolu o średnio odpowiednio 57% (90% CI: 20% do 107%), i 79% (90% CI: 40% do 128%). W kolejnym badaniu klinicznym z udziałem 8 zdrowych mężczyzn zmniejszenie dawki i (lub) częstości podawania worykonazolu i flukonazolu nie wyeliminowało ani nie zmniejszyło tego działania. Nie zaleca się jednoczesnego podawania worykonazolu i flukonazolu w jakiejkolwiek dawce. Zaleca się ścisłe monitorowanie zdarzeń niepożądanych związanych ze stosowaniem worykonazolu, jeśli worykonazol jest stosowany kolejno po flukonazolu, zwłaszcza w ciągu 24 godzin od ostatniej dawki flukonazolu. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Tofacytynib
Jednoczesne podawanie flukonazolu (400 mg w dniu 1. i 200 mg raz na dobę przez 6 dni [dni 2.-7]) i tofacytynibu (30 mg w pojedynczej dawce w dniu 5.) u zdrowych osób powodowało zwiększenie średnich wartości AUC i Cmax tofacytynibu o około 79% (90% CI: 64% do 96%) i 27% (90% CI: 12% do 44%) w porównaniu do podawania samego tofacytynibu. (Widzieć ŚRODKI OSTROŻNOŚCI .)
Mikrobiologia
Mechanizm akcji
Flukonazol jest wysoce selektywnym inhibitorem enzymu zależnego od cytochromu P450 grzyba, 14-α-demetylazy lanosterolu. Enzym ten przekształca lanosterol w ergosterol. Późniejsza utrata normalnych steroli koreluje z akumulacją 14-α-metylosteroli w grzybach i może być odpowiedzialna za fungistatyczne działanie flukonazolu. Demetylacja komórek ssaków jest znacznie mniej wrażliwa na hamowanie przez flukonazol.
Opór
Potencjał rozwoju oporności na flukonazol jest dobrze znany. Izolaty grzybów wykazujące zmniejszoną wrażliwość na inne azole mogą również wykazywać zmniejszoną wrażliwość na flukonazol. Częstość rozwoju lekooporności różnych grzybów, dla których ten lek jest wskazany, nie jest znana.
Oporność na flukonazol może wynikać ze zmiany jakości lub ilości docelowego enzymu (14-α-demetylazy lanosterolu), ograniczonego dostępu do celu leku lub kombinacji tych mechanizmów.
Mutacje punktowe w genie (ERG11) kodującym docelowy enzym prowadzą do zmienionego celu o zmniejszonym powinowactwie do azoli. Nadekspresja ERG11 powoduje wytwarzanie wysokich stężeń docelowego enzymu, stwarzając potrzebę wyższych wewnątrzkomórkowych stężeń leku do hamowania wszystkich cząsteczek enzymu w komórce.
Drugi główny mechanizm lekooporności obejmuje aktywny wypływ flukonazolu z komórki poprzez aktywację dwóch typów transporterów wielolekowych; główne facylitatory (kodowane przez geny MDR) i te z nadrodziny kaset wiążących ATP (kodowane przez geny CDR). Regulacja w górę genu MDR prowadzi do oporności na flukonazol, podczas gdy regulacja w górę genów CDR może prowadzić do oporności na wiele azoli.
Oporność u Candida glabrata zwykle obejmuje regulację w górę genów CDR, prowadzącą do oporności na wiele azoli. W przypadku izolatów, w których minimalne stężenie hamujące (MIC) jest sklasyfikowane jako pośrednie (16 do 32 μg/ml), zalecana jest najwyższa dawka flukonazolu.
Należy uznać, że Candida krusei jest oporny na flukonazol. Wydaje się, że oporność u C. krusei jest pośredniczona przez zmniejszoną wrażliwość docelowego enzymu na hamowanie przez czynnik.
Istnieją doniesienia o przypadkach nadkażenia gatunkami Candida innymi niż C. albicans, które często są z natury niewrażliwe na DIFLUCAN (np. Candida krusei). Takie przypadki mogą wymagać alternatywnej terapii przeciwgrzybiczej.
Aktywność przeciwbakteryjna
Wykazano, że flukonazol działa na większość izolatów następujących drobnoustrojów: zarówno in vitro, jak i w zakażeniach klinicznych.
Candida albicans Candida glabrata (Wiele izolatów jest średnio wrażliwych) Candida parapsilosis Candida tropicalis Cryptococcus neoformans
Dostępne są następujące dane in vitro, ale ich znaczenie kliniczne jest nieznane. Co najmniej 90% następujących grzybów wykazuje in vitro MIC mniejsze lub równe wartości granicznej wrażliwości dla flukonazolu (https://www.fda.gov/STIC) wobec izolatów podobnego rodzaju lub grupy organizmów. Jednak skuteczność flukonazolu w leczeniu zakażeń klinicznych wywołanych przez te grzyby nie została ustalona w odpowiednich i dobrze kontrolowanych badaniach klinicznych.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Należy uznać, że Candida krusei jest oporny na flukonazol. Wydaje się, że oporność u C. krusei jest pośredniczona przez zmniejszoną wrażliwość docelowego enzymu na hamowanie przez czynnik.
Istnieją doniesienia o przypadkach nadkażenia gatunkami Candida innymi niż C. albicans, które często są z natury niewrażliwe na DIFLUCAN (np. Candida krusei). Takie przypadki mogą wymagać alternatywnej terapii przeciwgrzybiczej.
Testy podatności
Szczegółowe informacje dotyczące kryteriów interpretacyjnych testu wrażliwości i powiązanych metod badawczych oraz standardów kontroli jakości uznanych przez FDA dla tego leku można znaleźć na stronie: https://www.fda.gov/STIC.
Studia kliniczne
Kryptokokowe zapalenie opon mózgowych
W wieloośrodkowym badaniu porównującym DIFLUCAN (200 mg/dobę) z amfoterycyną B (0,3 mg/kg/dobę) w leczeniu kryptokokowego zapalenia opon mózgowych u pacjentów z AIDS, analiza wieloczynnikowa wykazała trzy czynniki przed leczeniem, które przewidywały zgon w trakcie leczenia: nieprawidłowe stan psychiczny, miano antygenu kryptokokowego płynu mózgowo-rdzeniowego większe niż 1:1024 i liczba białych krwinek w płynie mózgowo-rdzeniowym poniżej 20 komórek/mm³. Śmiertelność wśród pacjentów z grupy wysokiego ryzyka wyniosła odpowiednio 33% i 40% dla pacjentów z amfoterycyną B i DIFLUCAN (p=0,58), z całkowitą liczbą zgonów 14% (9 z 63 pacjentów) i 18% (24 z 131 pacjentów) w 2 ramionach badanie (p=0,48). Optymalne dawki i schematy leczenia dla pacjentów z ostrym kryptokokowym zapaleniem opon mózgowo-rdzeniowych i wysokim ryzykiem niepowodzenia leczenia pozostają do ustalenia. (Saag i wsp. N Engl J Med 1992; 326:83-9.)
Kandydoza pochwy
Stanach Zjednoczonych przeprowadzono dwa odpowiednie i dobrze kontrolowane badania z użyciem tabletki 150 mg. W obu przypadkach wyniki schematu flukonazolu były porównywalne z schematem kontrolnym (klotrimazol lub mikonazol dopochwowo przez 7 dni) zarówno klinicznie, jak i statystycznie w ciągu jednego miesiąca po leczeniu.
Wskaźnik wyleczeń terapeutycznych, definiowany jako całkowite ustąpienie objawów kandydozy pochwy (wyleczenie kliniczne), wraz z ujemnym wynikiem badania KOH i ujemnym wynikiem posiewu na Candida (eradykacja mikrobiologiczna), wyniósł 55% zarówno w grupie flukonazolu, jak i preparatów dopochwowych. Grupa.
Około trzy czwarte włączonych do badania pacjentek miało ostre zapalenie pochwy (
W grupie flukonazolu zgłoszono znacznie więcej zdarzeń żołądkowo-jelitowych niż w grupie produktów dopochwowych. Większość zdarzeń miała charakter łagodny do umiarkowanego. Ponieważ flukonazol podawano w pojedynczej dawce, nie nastąpiło przerwanie leczenia.
Studia pediatryczne
Kandydoza jamy ustnej i gardła
Przeprowadzono otwarte badanie porównawcze skuteczności i bezpieczeństwa stosowania preparatu DIFLUCAN (2 do 3 mg/kg/dobę) i doustnej nystatyny (400 000 j.m. 4 razy na dobę) u dzieci z obniżoną odpornością z kandydozą jamy ustnej i gardła. Wskaźniki odpowiedzi klinicznej i mikologicznej były wyższe u dzieci leczonych flukonazolem.
Wyleczenie kliniczne pod koniec leczenia zgłoszono u 86% pacjentów leczonych flukonazolem w porównaniu z 46% pacjentów leczonych nystatyną. Pod względem mikologicznym, 76% pacjentów leczonych flukonazolem miało eradykację drobnoustroju zakaźnego w porównaniu z 11% pacjentów leczonych nystatyną.
Odsetek pacjentów z klinicznym nawrotem 2 tygodnie po zakończeniu leczenia wynosił 14% dla pacjentów otrzymujących DIFLUCAN i 16% dla pacjentów otrzymujących nystatynę. Po 4 tygodniach od zakończenia leczenia odsetek pacjentów z klinicznym nawrotem wynosił 22% dla DIFLUCAN 150 mg i 23% dla nystatyny.
INFORMACJA O PACJENCIE
DIFLUKAN® (barwnik-FLEW-kan) (flukonazol) Tabletki
Ta ulotka zawiera ważne informacje na temat preparatu DIFLUCAN. Nie ma zastępować instrukcji lekarza. Przeczytaj uważnie te informacje przed przyjęciem leku DIFLUCAN. Zapytaj swojego lekarza, jeśli nie rozumiesz żadnej z tych informacji lub chcesz dowiedzieć się więcej o DIFLUCAN.
Co to jest DIFLUCAN 100mg?
DIFLUCAN to lek na receptę stosowany w leczeniu drożdżaków pochwy wywołanych przez drożdżaki zwane Candida. DIFLUCAN 150mg pomaga zatrzymać zbyt dużo drożdży w pochwie, dzięki czemu infekcja drożdżakowa zniknie.
DIFLUCAN 150 mg różni się od innych metod leczenia drożdżaków pochwy, ponieważ jest to tabletka przyjmowana doustnie. DIFLUCAN stosuje się również w innych dolegliwościach. Jednak ta ulotka dotyczy tylko stosowania leku DIFLUCAN 50 mg w przypadku drożdżaków pochwy. Aby uzyskać informacje na temat stosowania leku DIFLUCAN 200mg z innych powodów, zapytaj swojego lekarza. Informacje na temat drożdżaków pochwy znajdują się w punkcie tej ulotki.
Co to jest drożdżyca pochwy?
To normalne, że w pochwie znajduje się pewna ilość drożdży. Czasami w pochwie zaczyna rosnąć zbyt dużo drożdży, co może powodować infekcję drożdżakową. Infekcje drożdżakowe pochwy są powszechne. Około trzy na cztery dorosłe kobiety będą miały co najmniej jedną drożdżycę pochwy w ciągu swojego życia.
Niektóre leki i schorzenia mogą zwiększyć prawdopodobieństwo wystąpienia infekcji drożdżakowej. Jeśli jesteś w ciąży, masz cukrzycę, stosujesz pigułki antykoncepcyjne lub przyjmujesz antybiotyki, możesz mieć infekcje drożdżakowe częściej niż inne kobiety. Higiena osobista i niektóre rodzaje odzieży mogą zwiększyć szanse na zakażenie drożdżakami. Zapytaj swojego lekarza o wskazówki, co możesz zrobić, aby zapobiec infekcjom drożdżakowym pochwy. Jeśli masz drożdżycę pochwy, możesz mieć jeden z następujących objawów:
- swędzący
- uczucie pieczenia podczas oddawania moczu
- zaczerwienienie
- ból
- gęsta biała wydzielina z pochwy, która wygląda jak twarożek
Nie należy przyjmować leku DIFLUCAN.
- przyjmować następujące leki:
- chinidyna
- erytromycyna
- pimozyd
- jesteś uczulony na flukonazol, substancję czynną leku DIFLUCAN 50mg lub którykolwiek ze składników leku DIFLUCAN. Pełna lista składników preparatu DIFLUCAN znajduje się na końcu tej ulotki informacyjnej dla pacjenta.
Przed przyjęciem leku DIFLUCAN należy poinformować lekarza o wszystkich swoich schorzeniach, jeśli:
- masz problemy z wątrobą
- masz problemy z nerkami
- masz problemy z sercem, w tym zaburzenia rytmu serca;
- mają hipokaliemię (niski poziom potasu)
- są w ciąży lub planują zajść w ciążę. Należy natychmiast poinformować lekarza o zajściu w ciążę podczas przyjmowania leku DIFLUCAN. Ty i Twój lekarz zdecydujecie, czy DIFLUCAN 100mg jest dla Ciebie odpowiedni. Jeśli pacjentka może zajść w ciążę, powinna stosować metodę kontroli urodzeń (antykoncepcji) podczas przyjmowania leku DIFLUCAN i przez 1 tydzień po przyjęciu ostatniej dawki.
- karmisz piersią lub planujesz karmić piersią. DIFLUCAN może przenikać do mleka matki. Porozmawiaj ze swoim lekarzem o najlepszym sposobie karmienia dziecka podczas przyjmowania leku DIFLUCAN.
Przed rozpoczęciem stosowania leku DIFLUCAN należy poinformować lekarza o wszystkich przyjmowanych lekach, w tym leki na receptę i bez recepty, witaminy i suplementy ziołowe. Szczególnie powiedz swojemu lekarzowi, jeśli bierzesz:
- leki przeciwcukrzycowe, takie jak gliburyd, tolbutamid, glipizyd
- leki na ciśnienie krwi, takie jak hydrochlorotiazyd, losartan, amlodypina, werapamil nifedypina lub felodypina
- leki rozrzedzające krew, takie jak warfaryna
- cyklosporyna, takrolimus lub sirolimus (stosowane w celu zapobiegania odrzuceniu przeszczepów narządów)
- ryfampicyna lub ryfabutyna na gruźlicę
- fenytoina lub karbamazepina do kontrolowania napadów
- teofilina do kontrolowania astmy
- chinidyna (stosowana w korygowaniu zaburzeń rytmu serca)
- amiodaron (stosowany w leczeniu nierównych rytmów serca „arytmii”)
- amitryptylina lub nortryptylina na depresję
- pimozyd na choroby psychiczne
- amfoterycyna B lub worykonazol w zakażeniach grzybiczych
- erytromycyna na infekcje bakteryjne
- olaparyb, cyklofosfamid lub alkaloidy barwinka, takie jak winkrystyna lub winblastyna do leczenia raka
- fentanyl, alfentanyl lub metadon na przewlekły ból
- ibrutynib stosowany w leczeniu raka krwi
- lemborexant, stosowany w leczeniu bezsenności
- leki obniżające poziom lipidów, takie jak atorwastatyna, simwastatyna i fluwastatyna
- niesteroidowe leki przeciwzapalne, w tym celekoksyb, ibuprofen i naproksen
- prednizon, steroid stosowany w leczeniu chorób skóry, przewodu pokarmowego, hematologicznych lub oddechowych
- leki przeciwwirusowe stosowane w leczeniu HIV, takie jak sakwinawir lub zydowudyna
- tofacytynib na reumatoidalne zapalenie stawów
- suplement diety z witaminą A
- tolwaptan stosowany w leczeniu hiponatremii (niskiego stężenia sodu we krwi) lub w celu spowolnienia pogarszania się czynności nerek
Ponieważ istnieje wiele nazw marek tych leków, skontaktuj się z lekarzem lub farmaceutą, jeśli masz jakiekolwiek pytania.
Jak powinienem zażywać DIFLUCAN?
- Przyjmuj DIFLUCAN dokładnie zgodnie z zaleceniami lekarza.
- Lek DIFLUCAN 100 mg należy przyjmować doustnie z posiłkiem lub bez posiłku.
- W przypadku zażycia zbyt dużej dawki leku DIFLUCAN 50 mg należy natychmiast skontaktować się z lekarzem lub udać się do najbliższej izby przyjęć.
Czego powinienem unikać podczas przyjmowania leku DIFLUCAN 150mg?
DIFLUCAN może powodować zawroty głowy i drgawki. Nie należy prowadzić pojazdów ani obsługiwać maszyn do czasu poznania wpływu leku DIFLUCAN na pacjenta.
Jakie są możliwe skutki uboczne DIFLUCAN 150mg?
DIFLUCAN 50mg może powodować poważne skutki uboczne, w tym:
- poważne problemy z wątrobą. niektórych osób z poważnymi problemami zdrowotnymi wystąpiły poważne problemy z wątrobą, które stały się zagrożeniem dla życia lub spowodowały śmierć podczas przyjmowania leku DIFLUCAN. Czasami te problemy z wątrobą można odwrócić po zaprzestaniu przyjmowania leku DIFLUCAN. Poinformuj natychmiast swojego lekarza, jeśli masz objawy poważnych problemów z wątrobą, w tym:
- ciemny kolor moczu
- silne swędzenie skóry
- zażółcenie skóry i oczu (żółtaczka)
- jasne stołki
- zmęczenie
- wymioty
- utrata apetytu
- poważne reakcje alergiczne: W rzadkich przypadkach podczas przyjmowania leku DIFLUCAN występowały ciężkie reakcje alergiczne (anafilaksja). Należy natychmiast przerwać przyjmowanie leku DIFLUCAN 50 mg, skontaktować się z lekarzem lub udać się do najbliższej szpitalnej izby przyjęć, jeśli wystąpią jakiekolwiek oznaki lub objawy reakcji alergicznej, w tym:
- duszność
- gorączka
- obrzęk powiek
- kaszel
- wysypka skórna, pokrzywka, pęcherze lub złuszczanie skóry
- twarz, usta, szyja lub jakakolwiek inna część ciała
- świszczący oddech
- pulsowanie serca lub uszu
- dreszcze
- poważne problemy skórne. niektórych osób z poważnymi problemami zdrowotnymi wystąpiły poważne problemy skórne, które spowodowały śmierć podczas przyjmowania leku DIFLUCAN. Należy natychmiast poinformować lekarza, jeśli podczas przyjmowania leku DIFLUCAN wystąpi wysypka.
Najczęstsze skutki uboczne DIFLUCAN 200mg to:
- ból głowy
- zawroty głowy
- biegunka
- ból brzucha
- nudności lub rozstrój żołądka
- zmiany w smaku potraw
Inne skutki uboczne obejmują:
- niewydolność nadnerczy: U niektórych osób, które przyjmowały DIFLUCAN, rozwinęła się niewydolność nadnerczy, która była odwracalna. Poinformuj natychmiast swojego lekarza, jeśli masz objawy niewydolności nadnerczy, w tym:
- długotrwałe zmęczenie
- słabe mięśnie
- utrata apetytu
- utrata wagi
- ból brzucha
- zawroty głowy
- mdłości
- wymioty
- zawroty głowy lub drgawki.
To nie wszystkie możliwe skutki uboczne stosowania leku DIFLUCAN.
Zadzwoń do swojego lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Jak przechowywać DIFLUCAN?
Przechowywać tabletki DIFLUCAN w temperaturze poniżej 86°F (30°C).
Lek DIFLUCAN 50 mg i wszystkie leki należy przechowywać w miejscu niedostępnym dla dzieci.
Ogólne informacje o bezpiecznym i skutecznym stosowaniu DIFLUCAN.
Czasami leki są przepisywane do celów innych niż wymienione w ulotce informacyjnej dla pacjenta. Nie należy stosować leku DIFLUCAN 50 mg w stanach, na które nie został przepisany. Nie należy podawać leku DIFLUCAN innym osobom, nawet jeśli mają takie same objawy jak ty. Może im to zaszkodzić. Możesz poprosić swojego lekarza o informacje o DIFLUCAN 200mg, które są przeznaczone dla pracowników służby zdrowia.
Jakie są składniki DIFLUCAN 150mg?
Składnik czynny: flukonazol
Nieaktywne składniki: Celuloza mikrokrystaliczna, bezwodny dwuzasadowy fosforan wapnia, powidon, kroskarmeloza sodowa, barwnik lak glinowy FD&C Red No. 40 i stearynian magnezu.
Niniejsza informacja dla pacjenta została zatwierdzona przez amerykańską Agencję ds. Żywności i Leków
