Celebrex 100mg, 200mg Celecoxib Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Celebrex 100mg i jak się go stosuje?
Celebrex 200mg to lek na receptę stosowany w leczeniu objawów ostrego bólu lub stanu zapalnego. Celebrex może być stosowany samodzielnie lub z innymi lekami.
Celebrex 100mg należy do klasy leków zwanych niesteroidowymi lekami przeciwzapalnymi (NLPZ).
Nie wiadomo, czy Celebrex jest bezpieczny i skuteczny u dzieci w wieku poniżej 2 lat.
Jakie są możliwe skutki uboczne Celebrex 100mg?
Celebrex 200mg może powodować poważne skutki uboczne, w tym:
- obrzęk,
- szybki przyrost masy ciała,
- duszność,
- krwawe lub smoliste stolce,
- odkrztuszanie krwi lub wymiocin wyglądających jak fusy z kawy,
- mdłości,
- ból brzucha w prawym górnym rogu,
- swędzący,
- zmęczenie,
- ciemny mocz,
- zażółcenie skóry lub oczu (żółtaczka),
- małe lub brak oddawania moczu,
- obrzęk stóp lub kostek,
- czuć się zmęczonym,
- blada skóra,
- zawroty głowy i
- zimne dłonie i stopy
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Celebrex to:
- ból brzucha,
- zgaga,
- gaz,
- biegunka,
- zaparcie,
- mdłości,
- wymioty,
- obrzęk dłoni lub stóp,
- zawroty głowy
- d
- objawy przeziębienia (zatkany nos, kichanie, ból gardła)
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie są wszystkie możliwe skutki uboczne Celebrexu. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OSTRZEŻENIE
RYZYKO POWAŻNYCH ZDARZEŃ SERCOWO-NACZYNIOWYCH I PRZEWODOWYCH
Zdarzenia zakrzepowo-sercowe
- Niesteroidowe leki przeciwzapalne (NLPZ) zwiększają ryzyko poważnych incydentów zakrzepowych układu krążenia, w tym zawału mięśnia sercowego i udaru mózgu, które mogą być śmiertelne. Ryzyko to może wystąpić na początku leczenia i może wzrastać wraz z czasem stosowania. [patrz OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI]
- CELEBREX jest przeciwwskazany w przypadku operacji pomostowania aortalno-wieńcowego (CABG). [patrz PRZECIWWSKAZANIA oraz OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI]
Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja
- NLPZ powodują zwiększone ryzyko poważnych zdarzeń niepożądanych ze strony przewodu pokarmowego (GI), w tym krwawienia, owrzodzenia i perforacji żołądka lub jelit, które mogą być śmiertelne. Zdarzenia te mogą wystąpić w dowolnym momencie podczas użytkowania i bez objawów ostrzegawczych. Pacjenci w podeszłym wieku oraz pacjenci z chorobą wrzodową i/lub krwawieniem z przewodu pokarmowego w wywiadzie są bardziej narażeni na wystąpienie poważnych zdarzeń (GI). [patrz OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI]
OPIS
Kapsułka CELEBREX (celekoksyb) jest niesteroidowym lekiem przeciwzapalnym, dostępnym w postaci kapsułek zawierających 50 mg, 100 mg, 200 mg i 400 mg celekoksybu do podawania doustnego. Nazwa chemiczna to 4-[5-(4-metylofenylo)-3-(trifluorometylo)-1H-pirazol-1-ilo]benzenosulfonamid i jest to pirazol podstawiony diarylem. Masa cząsteczkowa wynosi 381,38. Jego wzór cząsteczkowy to C17H14F3N3O2S i ma następującą strukturę chemiczną:
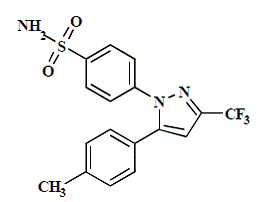
Celekoksyb jest białym lub prawie białym proszkiem o pKa 11,1 (ugrupowanie sulfonamidowe). Celekoksyb jest hydrofobowy (log P wynosi 3,5) i jest praktycznie nierozpuszczalny w środowisku wodnym w fizjologicznym zakresie pH.
Do składników nieaktywnych w CELEBREX 200mg należą: kroskarmeloza sodowa, tusze jadalne, żelatyna, monohydrat laktozy, stearynian magnezu, powidon i laurylosiarczan sodu.
WSKAZANIA
CELEBREX jest wskazany
Choroba zwyrodnieniowa stawów (OA)
Postępowanie w przypadku objawów przedmiotowych i podmiotowych choroby zwyrodnieniowej stawów [patrz Studia kliniczne ].
Reumatoidalne zapalenie stawów (RZS)
Postępowanie w przypadku objawów przedmiotowych i podmiotowych RZS [patrz Studia kliniczne ].
Młodzieńcze reumatoidalne zapalenie stawów (JRA)
Leczenie objawów przedmiotowych i podmiotowych JRA u pacjentów w wieku 2 lat i starszych [patrz Studia kliniczne ].
Zesztywniające zapalenie stawów kręgosłupa (AS)
Do postępowania w przypadku oznak i objawów AS [patrz Studia kliniczne ].
Ostry ból
Do leczenia ostrego bólu u dorosłych [patrz Studia kliniczne ].
Pierwotne bolesne miesiączkowanie
Do leczenia pierwotnego bolesnego miesiączkowania [patrz Studia kliniczne ].
DAWKOWANIE I SPOSÓB PODAWANIA
Ogólne instrukcje dozowania
Uważnie rozważ potencjalne korzyści i ryzyko związane z CELEBREX i innymi opcjami leczenia przed podjęciem decyzji o zastosowaniu CELEBREX. Stosuj najniższą skuteczną dawkę przez najkrótszy czas, zgodnie z indywidualnymi celami leczenia pacjenta [patrz OSTRZEŻENIA I ŚRODKI ].
Dawki te można podawać niezależnie od pory posiłków.
Zapalenie kości i stawów
W przypadku choroby zwyrodnieniowej stawów dawka wynosi 200 mg na dzień podawana jako pojedyncza dawka lub jako 100 mg dwa razy na dobę.
Reumatyzm
W przypadku RZS dawka wynosi od 100 mg do 200 mg dwa razy dziennie.
Młodzieńcze reumatoidalne zapalenie stawów
W przypadku JRA dawkowanie dla pacjentów pediatrycznych (w wieku 2 lat i starszych) opiera się na wadze. U pacjentów o masie ciała ≥10 kg do ≤25 kg zalecana dawka wynosi 50 mg dwa razy na dobę. Dla pacjentów >25 kg zalecana dawka wynosi 100 mg dwa razy na dobę.
W przypadku pacjentów, którzy mają trudności z połykaniem kapsułek, zawartość kapsułki CELEBREX można dodać do musu jabłkowego. Całą zawartość kapsułki należy ostrożnie przelać na płaską łyżeczkę chłodnego lub o temperaturze pokojowej musu jabłkowego i natychmiast wypić z wodą. Posypana zawartość kapsułki na mus jabłkowy jest stabilna do 6 godzin w warunkach chłodniczych (2°C do 8°C/35°F do 45°F).
Zesztywniające zapalenie stawów kręgosłupa
przypadku AS dawka preparatu CELEBREX wynosi 200 mg na dobę w dawkach pojedynczych (raz na dobę) lub podzielonych (dwa razy na dobę). Jeśli po 6 tygodniach nie zaobserwuje się żadnego efektu, warto spróbować 400 mg dziennie. Jeśli po 6 tygodniach nie zostanie zaobserwowany efekt w dawce 400 mg na dobę, odpowiedź jest mało prawdopodobna i należy rozważyć alternatywne opcje leczenia.
Leczenie ostrego bólu i leczenie pierwotnego bolesnego miesiączkowania
W leczeniu ostrego bólu i leczeniu pierwotnego bolesnego miesiączkowania dawka początkowo wynosi 400 mg, a następnie w razie potrzeby w pierwszym dniu można podać dodatkową dawkę 200 mg. W kolejnych dniach zalecana dawka wynosi 200 mg dwa razy na dobę w razie potrzeby.
Specjalne populacje
Niewydolność wątroby
U pacjentów z umiarkowanymi zaburzeniami czynności wątroby (klasa B w skali Child-Pugh) należy zmniejszyć dawkę o 50%. Nie zaleca się stosowania preparatu CELEBREX 100 mg u pacjentów z ciężkimi zaburzeniami czynności wątroby [patrz OSTRZEŻENIA I ŚRODKI , Używaj w określonych populacjach , oraz FARMAKOLOGIA KLINICZNA ].
Słabe metabolizatory substratów CYP2C9
dorosłych pacjentów, o których wiadomo lub podejrzewa się, że słabo metabolizują oni przez CYP2C9 na podstawie genotypu lub wcześniejszej historii/doświadczenia z innymi substratami CYP2C9 (takimi jak warfaryna, fenytoina), należy rozpocząć leczenie od połowy najmniejszej zalecanej dawki.
U pacjentów z JRA, o których wiadomo lub podejrzewa się, że słabo metabolizują CYP2C9, należy rozważyć zastosowanie alternatywnych metod leczenia [patrz Zastosowanie w określonych populacjach oraz FARMAKOLOGIA KLINICZNA ].
JAK DOSTARCZONE
Formy dawkowania i mocne strony
Kapsułki CELEBREX (celekoksyb):
50 mg biały, z białym odwrotnym nadrukiem na czerwonym pasku korpusu i wieczku z oznaczeniami 7767 na wieczku i 50 na korpusie.
100 mg biały, z białym odwrotnym nadrukiem na niebieskim pasku korpusu i wieczku z oznaczeniami 7767 na wieczku i 100 na korpusie.
200 mg biały, z białym odwrotnym nadrukiem na złotym pasku z oznaczeniami 7767 na wieczku i 200 na korpusie.
400 mg biały, z białym odwrotnym nadrukiem na zielonym pasku z oznaczeniami 7767 na wieczku i 400 na korpusie.
Składowania i stosowania
CELEBREX (celekoksyb) 50 mg kapsułki są białe, z białym odwrotnym nadrukiem na czerwonym pasku korpusu i wieczku z oznaczeniami 7767 na wieczku i 50 na korpusie, dostarczane jako:
CELEBREX (celekoksyb) 100 mg kapsułki są białe, z białym odwrotnym nadrukiem na niebieskim pasku korpusu i wieczku z oznaczeniami 7767 na wieczku i 100 na korpusie, dostarczane jako:
CELEBREX (celekoksyb) 200 mg kapsułki są białe, z białym odwrotnym nadrukiem na złotym pasku z oznaczeniami 7767 na wieczku i 200 na korpusie, dostarczane jako:
CELEBREX (celekoksyb) 400 mg kapsułki są białe, z białym odwrotnym nadrukiem na zielonym pasku z oznaczeniami 7767 na osłonce i 400 na korpusie, dostarczane jako:
Magazynowanie
Przechowywać w temperaturze pokojowej 20°C do 25°C (68°F do 77°F); dopuszczalne odchylenia od 15°C do 30°C (59°F do 86°F) [patrz Temperatura pokojowa kontrolowana przez USP ].
Dystrybutor: GD Searle LLC, Oddział Pfizer Inc, NY, NY 10017. Aktualizacja: kwiecień 2021
SKUTKI UBOCZNE
Następujące działania niepożądane omówiono bardziej szczegółowo w innych punktach oznakowania:
- Sercowo-naczyniowe zdarzenia zakrzepowe [patrz OSTRZEŻENIA I ŚRODKI ]
- Krwawienie, owrzodzenie i perforacja przewodu pokarmowego [patrz OSTRZEŻENIA I ŚRODKI ]
- Hepatotoksyczność [patrz OSTRZEŻENIA I ŚRODKI ]
- Nadciśnienie [patrz OSTRZEŻENIA I ŚRODKI ]
- Niewydolność serca i obrzęk [patrz OSTRZEŻENIA I ŚRODKI ]
- Toksyczność nerek i hiperkaliemia [patrz OSTRZEŻENIA I ŚRODKI ]
- Reakcje anafilaktyczne [patrz OSTRZEŻENIA I ŚRODKI ]
- Poważne reakcje skórne [patrz OSTRZEŻENIA I ŚRODKI ]
- Toksyczność hematologiczna [patrz OSTRZEŻENIA I ŚRODKI ]
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce. Informacje o działaniach niepożądanych z badań klinicznych stanowią jednak podstawę do identyfikacji zdarzeń niepożądanych, które wydają się być związane z zażywaniem narkotyków, oraz do przybliżania wskaźników.
Spośród pacjentów leczonych preparatem CELEBREX w kontrolowanych badaniach klinicznych przed wprowadzeniem do obrotu, około 4250 było pacjentami z chorobą zwyrodnieniową stawów, około 2100 było pacjentami z RZS, a około 1050 było pacjentami z bólem pooperacyjnym. Ponad 8500 pacjentów otrzymywało całkowitą dawkę dobową preparatu CELEBREX 200 mg wynoszącą 200 mg (100 mg dwa razy na dobę lub 200 mg raz na dobę) lub więcej, w tym ponad 400 leczonych po 800 mg (400 mg dwa razy na dobę). Około 3900 pacjentów otrzymywało CELEBREX w tych dawkach przez 6 miesięcy lub dłużej; około 2300 z nich otrzymało go przez 1 rok lub dłużej, a 124 z nich otrzymało go przez 2 lata lub dłużej.
Próby kontrolowanego zapalenia stawów przed wprowadzeniem do obrotu
tabeli 1 wymieniono wszystkie zdarzenia niepożądane, niezależnie od przyczynowości, występujące u ≥2% pacjentów otrzymujących CELEBREX 100 mg z 12 kontrolowanych badań przeprowadzonych u pacjentów z chorobą zwyrodnieniową stawów lub RZS, które obejmowały placebo i/lub dodatnią grupę kontrolną. Ponieważ te 12 badań trwało różne czasy, a pacjenci biorący udział w badaniach mogli nie być narażeni na taki sam czas, te wartości procentowe nie obejmują skumulowanych częstości występowania.
W badaniach klinicznych kontrolowanych placebo lub substancją czynną wskaźnik przerwania leczenia z powodu zdarzeń niepożądanych wyniósł 7,1% u pacjentów otrzymujących CELEBREX i 6,1% u pacjentów otrzymujących placebo. Wśród najczęstszych przyczyn przerwania leczenia z powodu działań niepożądanych w grupach leczonych CELEBREX były niestrawność i ból brzucha (podawane jako przyczyny przerwania odpowiednio u 0,8% i 0,7% pacjentów CELEBREX). Wśród pacjentów otrzymujących placebo 0,6% przerwało leczenie z powodu niestrawności, a 0,6% z powodu bólu brzucha.
Następujące działania niepożądane wystąpiły u 0,1% do 1,9% pacjentów leczonych preparatem CELEBREX (100 mg do 200 mg dwa razy na dobę lub 200 mg raz na dobę):
Przewód pokarmowy: Zaparcia, zapalenie uchyłków, utrudnione połykanie, odbijanie się, zapalenie przełyku, zapalenie żołądka, zapalenie żołądka i jelit, refluks żołądkowo-przełykowy, hemoroidy, przepuklina rozworu przełykowego, smoliste stolce, suchość w ustach, zapalenie jamy ustnej, parcie, wymioty
Układ sercowo-naczyniowy: Zaostrzone nadciśnienie, dławica piersiowa, choroba wieńcowa, zawał mięśnia sercowego
Ogólny: Nadwrażliwość, reakcja alergiczna, ból w klatce piersiowej, torbiel NOS, obrzęk uogólniony, obrzęk twarzy, zmęczenie, gorączka, uderzenia gorąca, objawy grypopodobne, ból, ból obwodowy
Centralny, obwodowy układ nerwowy: Skurcze nóg, hipertonia, niedoczulica, migrena, parestezje, zawroty głowy
Słuch i przedsionek: Głuchota, szum w uszach
Tętno i rytm: Kołatanie serca, tachykardia
Wątroba i drogi żółciowe: Wzrost enzymów wątrobowych (w tym wzrost SGOT, wzrost SGPT)
Metaboliczne i odżywcze: zwiększenie stężenia azotu mocznikowego we krwi (BUN), zwiększenie aktywności fosfokinazy kreatynowej (CPK), hipercholesterolemia, hiperglikemia, hipokaliemia, zwiększenie NPN, zwiększenie stężenia kreatyniny, zwiększenie aktywności fosfatazy alkalicznej, zwiększenie masy ciała
Układ mięśniowo-szkieletowy: Bóle stawów, artroza, bóle mięśni, zapalenie błony maziowej, zapalenie ścięgien
Płytki krwi (krwawienie lub krzepnięcie): wybroczyny, krwawienie z nosa, nadpłytkowość,
Psychiatryczny: Anoreksja, lęk, zwiększony apetyt, depresja, nerwowość, senność
Hemiczny: Niedokrwistość
Oddechowy: Zapalenie oskrzeli, skurcz oskrzeli, nasilenie skurczu oskrzeli, kaszel, duszność, zapalenie krtani, zapalenie płuc
Skóra i przydatki: Łysienie, zapalenie skóry, nadwrażliwość na światło, świąd, wysypka rumieniowa, wysypka plamisto-grudkowa, zaburzenia skórne, suchość skóry, nasilone pocenie się, pokrzywka
Zaburzenia w miejscu aplikacji: Cellulitis, kontaktowe zapalenie skóry
Moczowy: Albuminuria, zapalenie pęcherza moczowego, bolesne oddawanie moczu, krwiomocz, częstość oddawania moczu, kamień nerkowy
Następujące ciężkie zdarzenia niepożądane (nie oceniano przyczynowości) wystąpiły u
Układ sercowo-naczyniowy: Omdlenie, zastoinowa niewydolność serca, migotanie komór, zatorowość płucna, udar naczyniowy mózgu, zgorzel obwodowa, zakrzepowe zapalenie żył
Przewód pokarmowy: Niedrożność jelit, perforacja jelit, krwawienie z przewodu pokarmowego, zapalenie okrężnicy z krwawieniem, perforacja przełyku, zapalenie trzustki, niedrożność jelit
Ogólny: Sepsa, nagła śmierć
Wątroba i drogi żółciowe: Kamica żółciowa
Hemiczny i limfatyczny: Małopłytkowość
Nerwowy: Ataksja, samobójstwo [patrz INTERAKCJE Z LEKAMI ]
Nerkowy: Ostra niewydolność nerek
Badanie dotyczące długoterminowego bezpieczeństwa zapalenia stawów Celekoksybu
[Widzieć Studia kliniczne ]
Zdarzenia hematologiczne: Częstość występowania klinicznie istotnych spadków stężenia hemoglobiny (>2 g/dl) była mniejsza u pacjentów otrzymujących CELEBREX 400 mg dwa razy na dobę (0,5%) w porównaniu z pacjentami otrzymującymi diklofenak 75 mg dwa razy na dobę (1,3%) lub ibuprofen 800 mg trzy razy na dobę 1,9 %. Mniejsza częstość występowania zdarzeń związanych ze stosowaniem preparatu CELEBREX utrzymywała się przy stosowaniu aspiryny lub bez niej [patrz FARMAKOLOGIA KLINICZNA ].
Wypłaty/poważne zdarzenia niepożądane: Skumulowane wskaźniki Kaplana-Meiera po 9 miesiącach dla wycofań z powodu działań niepożądanych dla CELEBREX 100 mg, diklofenaku i ibuprofenu wynosiły odpowiednio 24%, 29% i 26%. Wskaźniki poważnych zdarzeń niepożądanych (tj. powodujących hospitalizację lub poczucie zagrożenia życia lub w inny sposób istotne z medycznego punktu widzenia), niezależnie od przyczynowości, nie różniły się między grupami leczenia (odpowiednio 8%, 7% i 8%).
Badanie młodzieńczego reumatoidalnego zapalenia stawów
12-tygodniowym, podwójnie zaślepionym, aktywnie kontrolowanym badaniu, 242 pacjentów z JRA w wieku od 2 do 17 lat leczono celekoksybem lub naproksenem; 77 pacjentów z JRA leczono celekoksybem 3 mg/kg dwa razy dziennie, 82 pacjentów leczono celekoksybem 6 mg/kg dwa razy dziennie, a 83 pacjentów leczono naproksenem 7,5 mg/kg dwa razy dziennie. Najczęściej występującymi (≥5%) zdarzeniami niepożądanymi u pacjentów leczonych celekoksybem były ból głowy, gorączka (gorączka), ból w nadbrzuszu, kaszel, zapalenie nosogardzieli, ból brzucha, nudności, ból stawów, biegunka i wymioty. Najczęściej występującymi (≥5%) zdarzeniami niepożądanymi u pacjentów leczonych naproksenem były ból głowy, nudności, wymioty, gorączka, ból w górnej części brzucha, biegunka, kaszel, ból brzucha i zawroty głowy (Tabela 2). W porównaniu z naproksenem, celekoksyb w dawkach 3 i 6 mg/kg dwa razy dziennie nie miał zauważalnego szkodliwego wpływu na wzrost i rozwój podczas 12-tygodniowego badania z podwójnie ślepą próbą. Nie było istotnej różnicy w liczbie zaostrzeń klinicznych zapalenia błony naczyniowej oka lub cech ogólnoustrojowych JRA między grupami leczenia.
12-tygodniowym, otwartym rozszerzeniu badania z podwójnie ślepą próbą, opisanego powyżej, 202 pacjentów z JRA leczono celekoksybem w dawce 6 mg/kg dwa razy na dobę. Częstość występowania zdarzeń niepożądanych była podobna do obserwowanej podczas badania z podwójnie ślepą próbą; nie wystąpiły nieoczekiwane zdarzenia niepożądane o znaczeniu klinicznym.
Inne badania przed zatwierdzeniem
Zdarzenia niepożądane z badań nad zesztywniającym zapaleniem stawów kręgosłupa
Łącznie 378 pacjentów leczono preparatem CELEBREX 200 mg w badaniach kontrolowanych placebo i aktywnym AS. Badano dawki do 400 mg raz na dobę. Rodzaje zdarzeń niepożądanych zgłaszanych w badaniach AS były podobne do zgłaszanych w badaniach OA/RA.
Zdarzenia niepożądane z badań przeciwbólowych i bolesnego miesiączkowania
Około 1700 pacjentów było leczonych preparatem CELEBREX 200 mg w badaniach przeciwbólowych i bolesnych miesiączek. Wszyscy pacjenci w badaniach nad bólem pooperacyjnym w jamie ustnej otrzymali pojedynczą dawkę badanego leku. Dawki do 600 mg/dobę CELEBREX 200 mg badano w badaniach nad pierwotnym bolesnym miesiączkowaniem i bólem po zabiegach ortopedycznych. Rodzaje działań niepożądanych w badaniach dotyczących analgezji i bolesnego miesiączkowania były podobne do tych zgłaszanych w badaniach zapalenia stawów. Jedynym dodatkowym zgłoszonym zdarzeniem niepożądanym było zapalenie kości wyrostka zębodołowego po ekstrakcji zębów (suchy zębodół) w badaniach nad bólem po zabiegu chirurgicznym jamy ustnej.
Wersje próbne APC i PreSAP
Działania niepożądane z długoterminowych, kontrolowanych placebo badań profilaktyki polipów
Ekspozycja na CELEBREX w badaniach APC i PreSAP wynosiła od 400 mg do 800 mg na dobę przez okres do 3 lat [patrz Studia kliniczne ].
Niektóre działania niepożądane wystąpiły u większego odsetka pacjentów niż w badaniach przed wprowadzeniem do obrotu zapalenia stawów (czas trwania leczenia do 12 tygodni; patrz powyżej Zdarzenia niepożądane w kontrolowanych badaniach zapalenia stawów CELEBREX 200 mg przed wprowadzeniem do obrotu). Działania niepożądane, w przypadku których te różnice u pacjentów leczonych preparatem CELEBREX były większe w porównaniu z badaniami przed wprowadzeniem do obrotu zapalenia stawów, były następujące:
Następujące dodatkowe działania niepożądane wystąpiły u ≥0,1% i
Zaburzenia układu nerwowego: Zawał mózgu
Zaburzenia oka: Męty ciała szklistego, krwotok spojówkowy
Ucho i labirynt: Zapalenie błędnika
Zaburzenia serca: Niestabilna dusznica bolesna, niedomykalność zastawki aortalnej, miażdżyca tętnic wieńcowych, bradykardia zatokowa, przerost komór
Zaburzenia naczyniowe: Zakrzepica żył głębokich
Zaburzenia układu rozrodczego i piersi: Torbiel jajnika
Dochodzenia: Zwiększenie stężenia potasu we krwi, zwiększenie stężenia sodu we krwi, zmniejszenie testosteronu we krwi
Urazy, zatrucia i powikłania po zabiegach: Zapalenie nadkłykcia, zerwanie ścięgna
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane podczas stosowania produktu CELEBREX po zatwierdzeniu. Ponieważ reakcje te są zgłaszane dobrowolnie z populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek
Układ sercowo-naczyniowy: Zapalenie naczyń, zakrzepica żył głębokich
Ogólny: reakcja rzekomoanafilaktyczna, obrzęk naczynioruchowy
Wątroba i drogi żółciowe: Martwica wątroby, zapalenie wątroby, żółtaczka, niewydolność wątroby
Hemiczny i limfatyczny: Agranulocytoza, niedokrwistość aplastyczna, pancytopenia, leukopenia
Metaboliczny: Hipoglikemia, hiponatremia
Nerwowy: Aseptyczne zapalenie opon mózgowych, brak smaku, anosmia, śmiertelny krwotok śródczaszkowy
Nerkowy: Śródmiąższowe zapalenie nerek
INTERAKCJE Z LEKAMI
Patrz Tabela 3 dla klinicznie istotnych interakcji leków z celekoksybem.
OSTRZEŻENIA
Zawarte jako część ŚRODKI OSTROŻNOŚCI Sekcja.
ŚRODKI OSTROŻNOŚCI
Zdarzenia zakrzepowo-sercowe
Badania kliniczne kilku selektywnych i nieselektywnych NLPZ cyklooksygenazy-2 (COX-2) trwające do trzech lat wykazały zwiększone ryzyko poważnych incydentów zakrzepowych układu sercowo-naczyniowego (CV), w tym zawału mięśnia sercowego (MI) i udaru mózgu, które mogą być śmiertelne. Na podstawie dostępnych danych nie jest jasne, czy ryzyko wystąpienia incydentów zakrzepowych w układzie sercowo-naczyniowym jest podobne w przypadku wszystkich NLPZ. Względny wzrost częstości występowania poważnych incydentów zakrzepowych w układzie sercowo-naczyniowym w porównaniu z wartościami wyjściowymi spowodowany stosowaniem NLPZ wydaje się być podobny u osób z rozpoznaną chorobą sercowo-naczyniową lub czynnikami ryzyka choroby sercowo-naczyniowej lub bez nich. Jednak pacjenci z rozpoznaną chorobą sercowo-naczyniową lub czynnikami ryzyka mieli większą bezwzględną częstość występowania poważnych incydentów zakrzepowych sercowo-naczyniowych ze względu na ich zwiększoną wyjściową częstość występowania. Niektóre badania obserwacyjne wykazały, że to zwiększone ryzyko poważnych incydentów zakrzepowych układu sercowo-naczyniowego rozpoczęło się już w pierwszych tygodniach leczenia. Wzrost ryzyka zakrzepicy sercowo-naczyniowej był najbardziej konsekwentnie obserwowany przy wyższych dawkach.
badaniu APC (Adenoma Prevention with Celecoxib) wystąpiło około trzykrotne zwiększenie ryzyka złożonego punktu końcowego obejmującego zgon z przyczyn sercowo-naczyniowych, zawał mięśnia sercowego lub udar mózgu w grupach leczenia CELEBREX 400 mg dwa razy na dobę i CELEBREX 200 mg dwa razy na dobę w porównaniu z placebo. Wzrost w obu grupach dawek celekoksybu w porównaniu z pacjentami otrzymującymi placebo wynikał głównie ze zwiększonej częstości występowania zawału mięśnia sercowego [patrz Studia kliniczne ].
Przeprowadzono randomizowane, kontrolowane badanie zatytułowane Prospective Randomized Evaluation of Celecoxib Integrated Safety vs. Ibuprofen Or Naproxen (PRECISION) w celu oceny względnego ryzyka zakrzepicy sercowo-naczyniowej inhibitora COX-2, celekoksybu, w porównaniu z nieselektywnymi NLPZ naproksenem i ibuprofenem. Celekoksyb 100 mg dwa razy na dobę nie był gorszy niż naproksen375 do 500 mg dwa razy na dobę i ibuprofen 600 do 800 mg trzy razy na dobę dla złożonego punktu końcowego badania Antiplatelet Trialists. Współpraca (APTC), na którą składa się zgon z przyczyn sercowo-naczyniowych (w tym zgon krwotoczny), zawał mięśnia sercowego niezakończony zgonem i udar mózgu niezakończony zgonem [patrz Studia kliniczne ].
Aby zminimalizować potencjalne ryzyko wystąpienia niepożądanego zdarzenia sercowo-naczyniowego u pacjentów leczonych NLPZ, należy stosować najniższą skuteczną dawkę przez możliwie najkrótszy czas. Lekarze i pacjenci powinni zachować czujność na rozwój takich zdarzeń przez cały cykl leczenia, nawet przy braku wcześniejszych objawów sercowo-naczyniowych. Pacjentów należy poinformować o objawach poważnych zdarzeń sercowo-naczyniowych oraz o krokach, jakie należy podjąć w przypadku ich wystąpienia.
Nie ma spójnych dowodów na to, że jednoczesne stosowanie aspiryny łagodzi zwiększone ryzyko poważnych incydentów zakrzepicy sercowo-naczyniowej związane ze stosowaniem NLPZ. Jednoczesne stosowanie aspiryny i NLPZ, takich jak celekoksyb, zwiększa ryzyko poważnych zdarzeń żołądkowo-jelitowych (GI) [patrz OSTRZEŻENIA I ŚRODKI ].
Stan po zabiegu pomostowania tętnic wieńcowych (CABG)
Dwa duże, kontrolowane badania kliniczne NLPZ selektywnego wobec COX-2 w leczeniu bólu w ciągu pierwszych 10 do 14 dni po operacji CABG wykazały zwiększoną częstość występowania zawału mięśnia sercowego i udaru mózgu. NLPZ są przeciwwskazane w CABG [patrz PRZECIWWSKAZANIA ].
Pacjenci po MI
Badania obserwacyjne przeprowadzone w Duńskim Krajowym Rejestrze wykazały, że pacjenci leczeni NLPZ w okresie po MI byli narażeni na zwiększone ryzyko ponownego zawału, zgonów z przyczyn sercowo-naczyniowych i śmiertelności z jakiejkolwiek przyczyny, począwszy od pierwszego tygodnia leczenia. W tej samej kohorcie częstość zgonów w pierwszym roku po MI wynosiła 20 na 100 osobolat u pacjentów leczonych NLPZ w porównaniu z 12 na 100 osobolat u pacjentów nie narażonych na NLPZ. Chociaż bezwzględny wskaźnik zgonów zmniejszył się nieco po pierwszym roku po MI, zwiększone względne ryzyko zgonu u osób stosujących NLPZ utrzymywało się przez co najmniej kolejne cztery lata obserwacji.
Należy unikać stosowania leku CELEBREX 100 mg u pacjentów po niedawno przebytym zawale serca, chyba że oczekuje się, że korzyści przewyższą ryzyko nawrotów zakrzepicy sercowo-naczyniowej. Jeśli CELEBREX jest stosowany u pacjentów po niedawno przebytym MI, należy monitorować pacjentów pod kątem objawów niedokrwienia serca.
Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja
NLPZ, w tym celekoksyb, powodują poważne zdarzenia niepożądane ze strony przewodu pokarmowego (GI), w tym zapalenie, krwawienie, owrzodzenie i perforację przełyku, żołądka, jelita cienkiego lub grubego, które mogą być śmiertelne. Te poważne zdarzenia niepożądane mogą wystąpić w dowolnym momencie, z objawami ostrzegawczymi lub bez, u pacjentów leczonych preparatem CELEBREX. Tylko jeden na pięciu pacjentów, u których wystąpiło poważne zdarzenie niepożądane w górnym odcinku przewodu pokarmowego podczas leczenia NLPZ, ma charakter objawowy. Owrzodzenia górnego odcinka przewodu pokarmowego, duże krwawienia lub perforacje spowodowane przez NLPZ wystąpiły u około 1% pacjentów leczonych przez 3 do 6 miesięcy i u około 2% do 4% pacjentów leczonych przez jeden rok. Jednak nawet krótkotrwała terapia NLPZ nie jest pozbawiona ryzyka.
Czynniki ryzyka krwawienia z przewodu pokarmowego, owrzodzeń i perforacji
Pacjenci z chorobą wrzodową w wywiadzie i/lub krwawieniem z przewodu pokarmowego, którzy stosowali NLPZ, mieli ponad 10-krotnie większe ryzyko wystąpienia krwawienia z przewodu pokarmowego w porównaniu z pacjentami bez tych czynników ryzyka. Inne czynniki zwiększające ryzyko krwawienia z przewodu pokarmowego u pacjentów leczonych NLPZ obejmują dłuższy czas leczenia NLPZ; jednoczesne stosowanie doustnych kortykosteroidów, leków przeciwpłytkowych (takich jak aspiryna), antykoagulantów; lub selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI); palenie; używanie alkoholu; starszy wiek; i zły ogólny stan zdrowia. Większość zgłoszeń po wprowadzeniu do obrotu śmiertelnych zdarzeń ze strony przewodu pokarmowego dotyczyła pacjentów w podeszłym wieku lub osłabionych. Ponadto pacjenci z zaawansowaną chorobą wątroby i/lub koagulopatią są narażeni na zwiększone ryzyko krwawienia z przewodu pokarmowego.
Częstość występowania owrzodzeń powikłanych i objawowych wynosiła 0,78% po dziewięciu miesiącach u wszystkich pacjentów w badaniu CLASS i 2,19% w podgrupie otrzymującej ASA w małych dawkach. U pacjentów w wieku 65 lat i starszych częstość występowania wynosiła 1,40% po dziewięciu miesiącach, 3,06%, gdy również przyjmowali ASA [patrz Studia kliniczne ].
Strategie minimalizacji ryzyka przewodu pokarmowego u pacjentów leczonych NLPZ
- Użyj najniższej skutecznej dawki przez możliwie najkrótszy czas.
- Unikaj jednoczesnego podawania więcej niż jednego NLPZ.
- Należy unikać stosowania u pacjentów z grupy podwyższonego ryzyka, chyba że spodziewane korzyści przewyższają zwiększone ryzyko krwawienia. W przypadku takich pacjentów, a także tych z aktywnym krwawieniem z przewodu pokarmowego, należy rozważyć alternatywne terapie inne niż NLPZ.
- Zachowaj czujność na oznaki i objawy owrzodzenia przewodu pokarmowego i krwawienia podczas leczenia NLPZ.
- W przypadku podejrzenia poważnego zdarzenia niepożądanego ze strony przewodu pokarmowego należy niezwłocznie rozpocząć ocenę i leczenie, a następnie odstawić CELEBREX 200 mg do momentu wykluczenia poważnego zdarzenia niepożądanego ze strony przewodu pokarmowego.
- przypadku jednoczesnego stosowania małej dawki aspiryny w profilaktyce kardiologicznej należy uważniej monitorować pacjentów pod kątem krwawienia z przewodu pokarmowego [patrz INTERAKCJE Z LEKAMI ].
Hepatotoksyczność
W badaniach klinicznych u około 1% pacjentów leczonych NLPZ zgłaszano zwiększenie aktywności AlAT lub AspAT (trzy lub więcej razy powyżej górnej granicy normy [GGN]). Ponadto zgłaszano rzadkie, czasami śmiertelne przypadki ciężkiego uszkodzenia wątroby, w tym piorunującego zapalenia wątroby, martwicy wątroby i niewydolności wątroby.
Podwyższenie aktywności AlAT lub AspAT (mniej niż trzykrotność GGN) może wystąpić nawet u 15% pacjentów leczonych NLPZ, w tym celekoksybem.
W kontrolowanych badaniach klinicznych produktu CELEBREX 200 mg częstość występowania granicznych podwyższeń (większych lub równych 1,2 razy i mniej niż 3 razy górnej granicy normy) enzymów związanych z wątrobą wynosiła 6% dla CELEBREX i 5% dla placebo oraz około 0,2 % pacjentów przyjmujących CELEBREX i 0,3% pacjentów przyjmujących placebo miało znaczne podwyższenie aktywności AlAT i AspAT.
Należy poinformować pacjentów o oznakach i objawach ostrzegawczych hepatotoksyczności (np. nudności, zmęczenie, letarg, biegunka, świąd, żółtaczka, tkliwość w prawym górnym kwadrancie i objawy grypopodobne). Jeśli pojawią się objawy kliniczne wskazujące na chorobę wątroby lub jeśli wystąpią objawy ogólnoustrojowe (np. eozynofilia, wysypka), należy natychmiast przerwać stosowanie preparatu CELEBREX i przeprowadzić ocenę kliniczną pacjenta.
Nadciśnienie
NLPZ, w tym CELEBREX 200 mg, mogą prowadzić do nowego początku nadciśnienia lub pogorszenia już istniejącego nadciśnienia, co może przyczynić się do zwiększonej częstości występowania incydentów sercowo-naczyniowych. Pacjenci przyjmujący inhibitory konwertazy angiotensyny (ACE), diuretyki tiazydowe lub diuretyki pętlowe mogą mieć osłabioną odpowiedź na te terapie podczas przyjmowania NLPZ [patrz INTERAKCJE Z LEKAMI ].
Widzieć Studia kliniczne dodatkowe dane dotyczące ciśnienia krwi dla CELEBREX.
Monitorować ciśnienie krwi (BP) podczas rozpoczynania leczenia NLPZ oraz w trakcie leczenia.
Niewydolność serca i obrzęk
Coxib i tradycyjni Trialiści NLPZ' Metaanaliza współpracy randomizowanych badań kontrolowanych wykazała około dwukrotny wzrost liczby hospitalizacji z powodu niewydolności serca u pacjentów leczonych selektywnie COX-2 i nieselektywnie leczonych NLPZ w porównaniu z pacjentami otrzymującymi placebo. W badaniu duńskiego krajowego rejestru pacjentów z niewydolnością serca stosowanie NLPZ zwiększało ryzyko zawału serca, hospitalizacji z powodu niewydolności serca i zgonu.
Ponadto u niektórych pacjentów leczonych NLPZ obserwowano zatrzymanie płynów i obrzęki. Stosowanie celekoksybu może osłabić wpływ na CV kilku środków terapeutycznych stosowanych w leczeniu tych schorzeń (np. diuretyków, inhibitorów ACE lub blokerów receptora angiotensyny [ARB]) [patrz INTERAKCJE Z LEKAMI ].
W badaniu CLASS [patrz Studia kliniczne ], skumulowane wskaźniki Kaplana-Meiera po 9 miesiącach pacjentów z obrzękiem obwodowym leczonych CELEBREX 400 mg dwa razy na dobę (odpowiednio 4-krotność i 2-krotność zalecanych dawek OA i RA), ibuprofen 800 mg trzy razy na dobę i diklofenak 75 mg dwa razy na dobę wyniosły odpowiednio 4,5%, 6,9% i 4,7%.
Należy unikać stosowania leku CELEBREX 200 mg u pacjentów z ciężką niewydolnością serca, chyba że spodziewane korzyści przewyższają ryzyko pogorszenia niewydolności serca. Jeśli CELEBREX 100 mg jest stosowany u pacjentów z ciężką niewydolnością serca, należy monitorować pacjentów pod kątem oznak nasilenia niewydolności serca.
Toksyczność nerek i hiperkaliemia
Toksyczność nerek
Długotrwałe podawanie NLPZ spowodowało martwicę brodawek nerkowych i inne uszkodzenie nerek.
Toksyczny wpływ na nerki obserwowano również u pacjentów, u których prostaglandyny nerkowe pełnią funkcję kompensacyjną w utrzymaniu perfuzji nerek. U tych pacjentów podawanie NLPZ może powodować zależne od dawki zmniejszenie informacji o prostaglandach i, w drugiej kolejności, przepływu krwi przez nerki, co może przyspieszyć jawną dekompensację nerek. Największe ryzyko wystąpienia tej reakcji to pacjenci z zaburzeniami czynności nerek, odwodnieniem, hipowolemią, niewydolnością serca, zaburzeniami czynności wątroby, przyjmujący leki moczopędne, inhibitory ACE lub ARB oraz osoby starsze. Po przerwaniu leczenia NLPZ następuje zazwyczaj powrót do stanu sprzed leczenia.
Brak dostępnych informacji z kontrolowanych badań klinicznych dotyczących stosowania preparatu CELEBREX 100 mg u pacjentów z zaawansowaną chorobą nerek. Działanie preparatu CELEBREX na nerki może przyspieszyć postęp zaburzeń czynności nerek u pacjentów z istniejącą wcześniej chorobą nerek.
Prawidłowy stan objętości u pacjentów odwodnionych lub z hipowolemią przed rozpoczęciem leczenia CELEBREX. Monitorować czynność nerek u pacjentów z zaburzeniami czynności nerek lub wątroby, niewydolnością serca, odwodnieniem lub hipowolemią podczas stosowania leku CELEBREX [patrz INTERAKCJE Z LEKAMI ]. Należy unikać stosowania leku CELEBREX 200 mg u pacjentów z zaawansowaną chorobą nerek, chyba że spodziewane korzyści przewyższają ryzyko pogorszenia czynności nerek. Jeśli CELEBREX 200 mg jest stosowany u pacjentów z zaawansowaną chorobą nerek, należy monitorować pacjentów pod kątem objawów pogorszenia czynności nerek.
Hiperkaliemia
Podczas stosowania NLPZ zgłaszano zwiększenie stężenia potasu w surowicy, w tym hiperkaliemię, nawet u niektórych pacjentów bez zaburzeń czynności nerek. U pacjentów z prawidłową czynnością nerek działania te przypisywano stanowi ahiporeninemii i hipoaldosteronizmu.
Reakcje anafilaktyczne
Celekoksyb był związany z reakcjami anafilaktycznymi u pacjentów z nadwrażliwością na celekoksyb i bez znanej nadwrażliwości na celekoksyb oraz u pacjentów z astmą wrażliwą na aspirynę. Celebrex 200 mg jest sulfonamidem i zarówno NLPZ, jak i sulfonamidy mogą powodować reakcje typu alergicznego, w tym objawy anafilaktyczne i zagrażające życiu lub mniej ciężkie epizody astmy u niektórych podatnych osób [patrz PRZECIWWSKAZANIA oraz OSTRZEŻENIA I ŚRODKI ].
Poszukaj pomocy w nagłych wypadkach, jeśli wystąpi jakakolwiek reakcja anafilaktyczna.
Zaostrzenie astmy związane z wrażliwością na aspirynę
Subpopulacja pacjentów z astmą może mieć astmę wrażliwą na aspirynę, która może obejmować przewlekłe zapalenie zatok przynosowych powikłane polipami nosa; ciężki, potencjalnie śmiertelny skurcz oskrzeli; i/lub nietolerancja aspiryny i innych NLPZ. Ponieważ u takich pacjentów wrażliwych na aspirynę odnotowano reakcje krzyżowe między aspiryną i innymi NLPZ, CELEBREX jest przeciwwskazany u pacjentów z tą postacią wrażliwości na aspirynę [patrz PRZECIWWSKAZANIA ]. Gdy CELEBREX jest stosowany u pacjentów z istniejącą wcześniej astmą (bez znanej wrażliwości na aspirynę), należy monitorować pacjentów pod kątem zmian w objawach przedmiotowych i podmiotowych astmy.
Poważne reakcje skórne
Po leczeniu produktem Celebrex 200 mg wystąpiły poważne reakcje skórne, w tym rumień wielopostaciowy, złuszczające zapalenie skóry, zespół Stevensa-Johnsona (SJS), toksyczne martwicze oddzielanie się naskórka (TEN), reakcje polekowe z eozynofilią i objawami ogólnoustrojowymi (DRESS) oraz ostra uogólniona osutka krostkowa ( AGEP). Te poważne zdarzenia mogą wystąpić bez ostrzeżenia i mogą być śmiertelne.
Należy poinformować pacjentów o oznakach i objawach poważnych reakcji skórnych oraz o zaprzestaniu stosowania leku CELEBREX 100 mg przy pierwszym pojawieniu się wysypki skórnej lub jakichkolwiek innych objawów nadwrażliwości. CELEBREX 200 mg jest przeciwwskazany u pacjentów z wcześniejszymi poważnymi reakcjami skórnymi na NLPZ [patrz PRZECIWWSKAZANIA ].
Reakcja lekowa z eozynofilią i objawami ogólnoustrojowymi (DRESS)
pacjentów przyjmujących NLPZ, takie jak CELEBREX, zgłaszano reakcje polekowe z eozynofilią i objawami ogólnoustrojowymi (DRESS). Niektóre z tych zdarzeń były śmiertelne lub zagrażały życiu. SUKIENKA zazwyczaj, choć nie wyłącznie, objawia się gorączką, wysypką, powiększeniem węzłów chłonnych i/lub obrzękiem twarzy. Inne objawy kliniczne mogą obejmować zapalenie wątroby, zapalenie nerek, nieprawidłowości hematologiczne, zapalenie mięśnia sercowego lub zapalenie mięśni. Czasami objawy DRESS mogą przypominać ostrą infekcję wirusową. Często występuje eozynofilia. Ponieważ zaburzenie to ma zmienną prezentację, mogą być zaangażowane inne układy narządów nie wymienione tutaj. Należy zauważyć, że wczesne objawy nadwrażliwości, takie jak gorączka lub powiększenie węzłów chłonnych, mogą być obecne, nawet jeśli wysypka nie jest widoczna. Jeśli takie oznaki lub objawy występują, należy odstawić CELEBREX 200 mg i natychmiast ocenić pacjenta.
Toksyczność płodu
Przedwczesne zamknięcie przewodu tętniczego płodu
Unikaj stosowania NLPZ, w tym CELEBREX 100mg, u kobiet w ciąży około 30 tygodnia ciąży i później. NLPZ, w tym CELEBREX, zwiększają ryzyko przedwczesnego zamknięcia przewodu tętniczego płodu mniej więcej w tym wieku ciążowym.
Małowodzie/niewydolność nerek noworodka
Stosowanie NLPZ, w tym CELEBREX, w około 20. tygodniu ciąży lub później w ciąży może powodować zaburzenia czynności nerek płodu prowadzące do małowodzia, a w niektórych przypadkach zaburzenia czynności nerek u noworodków. Te działania niepożądane obserwuje się średnio po dniach lub tygodniach leczenia, chociaż małowodzie zgłaszano rzadko już po 48 godzinach od rozpoczęcia leczenia NLPZ. Małowodzie jest często, ale nie zawsze, odwracalne po przerwaniu leczenia. Powikłania przedłużonego małowodzia mogą na przykład obejmować przykurcze kończyn i opóźnione dojrzewanie płuc. W niektórych przypadkach zaburzeń czynności nerek noworodków po wprowadzeniu do obrotu konieczne były procedury inwazyjne, takie jak transfuzja wymienna lub dializa.
Jeśli leczenie NLPZ jest konieczne między około 20 tygodniem a 30 tygodniem ciąży, należy ograniczyć stosowanie CELEBREX do najniższej skutecznej dawki i możliwie najkrótszego czasu trwania. Rozważ monitorowanie ultrasonograficzne płynu owodniowego, jeśli leczenie CELEBREX trwa dłużej niż 48 godzin. W przypadku wystąpienia małowodzia należy przerwać stosowanie produktu CELEBREX i postępować zgodnie z praktyką kliniczną[patrz Używaj w określonych populacjach ].
Toksyczność hematologiczna
U pacjentów leczonych NLPZ wystąpiła niedokrwistość. Może to być spowodowane utajoną lub znaczną utratą krwi, zatrzymaniem płynów lub niekompletnie opisanym wpływem na erytropoezę. Jeśli pacjent leczony preparatem CELEBREX ma jakiekolwiek oznaki lub objawy niedokrwistości, należy monitorować stężenie hemoglobiny lub hematokryt.
W kontrolowanych badaniach klinicznych częstość występowania niedokrwistości wynosiła 0,6% po CELEBREX i 0,4% po placebo. Pacjenci długotrwale leczeni preparatem CELEBREX 200mg powinni mieć zbadaną hemoglobinę lub hematokryt, jeśli wykazują jakiekolwiek oznaki lub objawy niedokrwistości lub utraty krwi.
NLPZ, w tym CELEBREX 100 mg, mogą zwiększać ryzyko krwawienia. Choroby współistniejące, takie jak zaburzenia krzepnięcia lub jednoczesne stosowanie warfaryny, innych leków przeciwzakrzepowych, leków przeciwpłytkowych (np. aspiryna), SSRI i inhibitorów wychwytu zwrotnego serotoniny i noradrenaliny (SNRI) mogą zwiększać to ryzyko. Monitoruj tych pacjentów pod kątem oznak krwawienia [patrz INTERAKCJE Z LEKAMI ].
Maskowanie stanu zapalnego i gorączki
Aktywność farmakologiczna CELEBREX 100mg w zmniejszaniu stanu zapalnego i ewentualnie gorączki może zmniejszyć użyteczność objawów diagnostycznych w wykrywaniu infekcji.

Monitoring laboratoryjny
Ponieważ poważne krwawienie z przewodu pokarmowego, hepatotoksyczność i uszkodzenie nerek mogą wystąpić bez objawów lub oznak ostrzegawczych, należy rozważyć okresowe monitorowanie pacjentów długotrwale leczonych NLPZ za pomocą CBC i profilu chemicznego [patrz OSTRZEŻENIA I ŚRODKI ].
kontrolowanych badaniach klinicznych podwyższone stężenie BUN występowało częściej u pacjentów otrzymujących CELEBREX w porównaniu do pacjentów otrzymujących placebo. Ta nieprawidłowość laboratoryjna była również obserwowana u pacjentów, którzy otrzymywali porównawcze NLPZ w tych badaniach. Kliniczne znaczenie tej nieprawidłowości nie zostało ustalone.
Rozsiane wykrzepianie wewnątrznaczyniowe (DIC)
Ze względu na ryzyko rozsianego wykrzepiania śródnaczyniowego przy stosowaniu preparatu CELEBREX 200 mg u dzieci i młodzieży z ogólnoustrojowym JRA, należy monitorować pacjentów pod kątem oznak i objawów nieprawidłowego krzepnięcia lub krwawienia oraz informować pacjentów i ich opiekunów o zgłaszaniu objawów tak szybko, jak to możliwe.
Informacje dotyczące poradnictwa dla pacjentów
Poinformuj pacjenta, aby przeczytał zatwierdzone przez FDA oznakowanie pacjenta ( Przewodnik po lekach ), która towarzyszy każdej zrealizowanej recepcie. Poinformuj pacjentów, rodziny lub ich opiekunów o następujących informacjach przed rozpoczęciem terapii preparatem CELEBREX oraz okresowo w trakcie trwającej terapii.
Zdarzenia zakrzepowo-sercowe
Należy doradzić pacjentom, aby zwracali uwagę na objawy zakrzepicy sercowo-naczyniowej, w tym ból w klatce piersiowej, duszność, osłabienie lub niewyraźną mowę, i natychmiast zgłaszali każdy z tych objawów swojemu lekarzowi [patrz OSTRZEŻENIA I ŚRODKI ].
Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja
Poradź pacjentom, aby zgłaszali swojemu lekarzowi objawy owrzodzeń i krwawień, w tym ból w nadbrzuszu, niestrawność, smoliste stolce i krwawe wymioty. W przypadku jednoczesnego stosowania aspiryny w małych dawkach w profilaktyce kardiologicznej należy poinformować pacjentów o zwiększonym ryzyku wystąpienia krwawienia z przewodu pokarmowego [patrz OSTRZEŻENIA I ŚRODKI ].
Hepatotoksyczność
Należy poinformować pacjentów o oznakach i objawach ostrzegawczych hepatotoksyczności (np. nudności, zmęczenie, letarg, świąd, biegunka, żółtaczka, tkliwość w prawym górnym kwadrancie i objawy grypopodobne). W takim przypadku należy poinstruować pacjentów, aby zaprzestali stosowania leku CELEBREX 200 mg i natychmiast zgłosili się do leczenia [patrz OSTRZEŻENIA I ŚRODKI , Używaj w określonych populacjach ].
Niewydolność serca i obrzęk
Należy doradzić pacjentom, aby zwracali uwagę na objawy zastoinowej niewydolności serca, w tym duszność, niewyjaśniony przyrost masy ciała lub obrzęki, i skontaktowali się z lekarzem, jeśli takie objawy wystąpią [patrz OSTRZEŻENIA I ŚRODKI ].
Reakcje anafilaktyczne
Poinformuj pacjentów o objawach reakcji anafilaktycznej (np. trudności w oddychaniu, obrzęk twarzy lub gardła). Należy poinstruować pacjentów, aby w razie ich wystąpienia szukali natychmiastowej pomocy w nagłych wypadkach [patrz PRZECIWWSKAZANIA oraz OSTRZEŻENIA I ŚRODKI ].
Poważne reakcje skórne, w tym SUKIENKA
Należy doradzić pacjentom natychmiastowe zaprzestanie przyjmowania leku CELEBREX 100 mg, jeśli wystąpi u nich jakikolwiek rodzaj wysypki lub gorączki oraz jak najszybciej skontaktować się z lekarzem [patrz OSTRZEŻENIA I ŚRODKI ].
Płodność kobiet
Doradzić kobietom o potencjale rozrodczym, które pragną zajść w ciążę, z którymi NLPZ, w tym CELEBREX 200 mg, mogą być związane z odwracalnym opóźnieniem owulacji [patrz Używaj w określonych populacjach ].
Toksyczność płodu
Poinformuj kobiety w ciąży, aby unikały stosowania CELEBREX i innych NLPZ począwszy od 30 tygodnia ciąży ze względu na ryzyko przedwczesnego zamknięcia przewodu tętniczego płodu. Jeśli leczenie preparatem CELEBREX 200 mg jest konieczne dla kobiety w ciąży między około 20. a 30. tygodniem ciąży, należy poinformować ją, że może być konieczne monitorowanie jej pod kątem małowodzia, jeśli leczenie trwa dłużej niż 48 godzin [patrz OSTRZEŻENIA I ŚRODKI oraz Używaj w określonych populacjach ].
Unikaj jednoczesnego stosowania NLPZ
Należy poinformować pacjentów, że jednoczesne stosowanie preparatu CELEBREX z innymi NLPZ lub salicylanami (np. diflunisalem, salsalatem) nie jest zalecane ze względu na zwiększone ryzyko toksyczności żołądkowo-jelitowej oraz niewielki lub żaden wzrost skuteczności [patrz OSTRZEŻENIA I ŚRODKI oraz INTERAKCJE Z LEKAMI ]. Ostrzegaj pacjentów, że NLPZ mogą być obecne w lekach „bez recepty” stosowanych w leczeniu przeziębienia, gorączki lub bezsenności.
Stosowanie NLPZ i aspiryny w niskich dawkach
Poinformuj pacjentów, aby nie stosowali małych dawek aspiryny jednocześnie z CELEBREX 200 mg, dopóki nie porozmawiają ze swoim lekarzem [patrz INTERAKCJE Z LEKAMI ].
Etykieta tego produktu mogła zostać zaktualizowana. Najnowsze informacje na temat przepisywania leków można znaleźć na stronie www.pfizer.com.
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Karcynogeneza
Celekoksyb nie wykazywał działania rakotwórczego u szczurów Sprague-Dawley, którym podano doustnie dawki do 200 mg/kg dla samców i 10 mg/kg dla samic (około 2 do 4 razy większe niż narażenie człowieka, mierzone jako AUC0-24 przy 200 mg dwa razy na dobę ) lub u myszy, którym podawano doustne dawki do 25 mg/kg dla samców i 50 mg/kg dla samic (w przybliżeniu równe ekspozycji u ludzi mierzonej jako AUC0-24 przy 200 mg dwa razy na dobę) przez dwa lata.
Mutageneza
Celekoksyb nie wykazywał działania mutagennego w teście Amesa i teście mutacji w komórkach jajnika chomika chińskiego (CHO) ani klastogenny w teście aberracji chromosomowych w komórkach CHO i teście mikrojądrowym in vivo w szpiku kostnym szczura.
Upośledzenie płodności
Celekoksyb nie miał wpływu na płodność samców ani samic ani na funkcje rozrodcze samców szczurów w dawkach doustnych do 600 mg/kg/dobę (około 11-krotność narażenia człowieka na dawkę 200 mg dwa razy na dobę w oparciu o AUC0-24). Przy dawce ≥50 mg/kg/dobę (około 6-krotna ekspozycja człowieka na podstawie AUC0-24 przy dawce 200 mg dwa razy na dobę) nastąpiła zwiększona utrata przed implantacją.
Używaj w określonych populacjach
Ciąża
Podsumowanie ryzyka
Stosowanie NLPZ, w tym CELEBREX 200 mg, może spowodować przedwczesne zamknięcie przewodu tętniczego płodu i dysfunkcję nerek płodu prowadzącą do małowodzia, a w niektórych przypadkach do niewydolności nerek u noworodka. Ze względu na te zagrożenia należy ograniczyć dawkę i czas stosowania CELEBREX 200 mg pomiędzy około 20 a 30 tygodniem ciąży oraz unikać stosowania CELEBREX w około 30 tygodniu ciąży i później (patrz Rozważania kliniczne, dane ).
Przedwczesne zamknięcie przewodu tętniczego płodu
Stosowanie NLPZ, w tym CELEBREX, w około 30. tygodniu ciąży lub później zwiększa ryzyko przedwczesnego zamknięcia przewodu tętniczego płodu.
Małowodzie/niewydolność nerek noworodka
Stosowanie NLPZ w około 20. tygodniu ciąży lub później w ciąży wiązało się z przypadkami dysfunkcji nerek płodu prowadzącej do małowodzia, a w niektórych przypadkach do niewydolności nerek u noworodków.
Dane z badań obserwacyjnych dotyczące innych potencjalnych zagrożeń dla zarodka i płodu związanych ze stosowaniem NLPZ u kobiet w pierwszym lub drugim trymestrze ciąży są niejednoznaczne. W badaniach na zwierzętach dotyczących reprodukcji u szczurów, którym podawano celekoksyb codziennie w okresie organogenezy w dawkach doustnych około 6-krotności maksymalnej zalecanej dawki u ludzi (MRHD) wynoszącej 200 mg dwa razy na dobę, obserwowano zgony zarodków i płodów oraz zwiększenie liczby przepuklin przeponowych. Ponadto u królików, którym podawano doustnie dawki celekoksybu w okresie organogenezy około 2 razy większe niż MRHD, zaobserwowano nieprawidłowości strukturalne (np. ubytki przegrody, zrośnięte żebra, zrośnięte mostki i zniekształcone mostki mostkowe) (patrz Dane ). Na podstawie danych na zwierzętach wykazano, że prostaglandyny odgrywają ważną rolę w przepuszczalności naczyń endometrium, implantacji blastocysty i decydualizacji. W badaniach na zwierzętach podawanie inhibitorów syntezy prostaglandyn, takich jak celekoksyb, powodowało zwiększoną utratę przed i po implantacji. Wykazano również, że prostaglandyny odgrywają ważną rolę w rozwoju nerek płodu. W opublikowanych badaniach na zwierzętach donoszono, że inhibitory syntezy prostaglandyn, podawane w klinicznie istotnych dawkach, zaburzają rozwój nerek.
Szacowane ryzyko tła poważnych wad wrodzonych i poronienia dla wskazanej populacji jest nieznane. Wszystkie ciąże wiążą się z ryzykiem wady wrodzonej, utraty lub innych niekorzystnych skutków. W ogólnej populacji Stanów Zjednoczonych szacowane podstawowe ryzyko poważnych wad wrodzonych i poronienia w klinicznie rozpoznanych ciążach wynosi odpowiednio 2% do 4% i 15% do 20%.
Rozważania kliniczne
Działania niepożądane u płodu/noworodka
Przedwczesne zamknięcie przewodu tętniczego płodu
Unikaj stosowania NLPZ u kobiet w około 30. tygodniu ciąży i później w ciąży, ponieważ NLPZ, w tym CELEBREX 200 mg, mogą spowodować przedwczesne zamknięcie przewodu tętniczego płodu (patrz Dane ).
Małowodzie/niewydolność nerek noworodka:
Jeśli NLPZ jest konieczne w około 20. tygodniu ciąży lub później, ogranicz stosowanie do najniższej skutecznej dawki i możliwie najkrótszego czasu trwania. Jeśli leczenie CELEBREXem trwa dłużej niż 48 godzin, rozważ monitorowanie ultrasonograficzne pod kątem małowodzia. Jeśli wystąpi małowodzie, należy odstawić CELEBREX i postępować zgodnie z praktyką kliniczną (patrz Dane ).
Praca lub dostawa
Nie ma badań dotyczących wpływu CELEBREX podczas porodu lub porodu. W badaniach na zwierzętach NLPZ, w tym celekoksyb, hamują syntezę prostaglandyn, powodują opóźniony poród i zwiększają częstość martwych urodzeń.
Dane
Dane ludzkie
Dostępne dane nie wskazują na obecność lub brak toksyczności rozwojowej związanej ze stosowaniem preparatu CELEBREX.
Przedwczesne zamknięcie przewodu tętniczego płodu
Z opublikowanego piśmiennictwa wynika, że stosowanie NLPZ w około 30. tygodniu ciąży i później w ciąży może spowodować przedwczesne zamknięcie przewodu tętniczego płodu.
Małowodzie/niewydolność nerek noworodka
Opublikowane badania i raporty po wprowadzeniu do obrotu opisują stosowanie NLPZ przez matkę w około 20. tygodniu ciąży lub później w związku z zaburzeniami czynności nerek płodu prowadzącymi do małowodzia, a w niektórych przypadkach z zaburzeniami czynności nerek u noworodków. Te działania niepożądane obserwuje się średnio po dniach lub tygodniach leczenia, chociaż małowodzie zgłaszano rzadko już po 48 godzinach od rozpoczęcia leczenia NLPZ. W wielu przypadkach, ale nie we wszystkich, spadek płynu owodniowego był przemijający i odwracalny wraz z odstawieniem leku. Istnieje ograniczona liczba opisów przypadków stosowania NLPZ u matek i zaburzeń czynności nerek u noworodków bez małowodzia, z których niektóre były nieodwracalne. Niektóre przypadki dysfunkcji nerek noworodków wymagały leczenia za pomocą procedur inwazyjnych, takich jak transfuzja wymienna lub dializa.
Ograniczenia metodologiczne tych badań i raportów po wprowadzeniu do obrotu obejmują brak grupy kontrolnej; ograniczone informacje dotyczące dawki, czasu trwania i czasu ekspozycji na lek; i jednoczesne stosowanie innych leków. Ograniczenia te uniemożliwiają ustalenie wiarygodnego oszacowania ryzyka niekorzystnych wyników dla płodu i noworodka przy stosowaniu NLPZ u matki. Ponieważ opublikowane dane dotyczące bezpieczeństwa u noworodków dotyczyły głównie wcześniaków, możliwość uogólnienia niektórych zgłoszonych zagrożeń dla urodzonego w terminie niemowlęcia narażonego na NLPZ poprzez stosowanie przez matkę jest niepewna.
Dane zwierząt
Celekoksyb w dawkach doustnych ≥150 mg/kg/dobę (w przybliżeniu dwukrotna ekspozycja u ludzi w dawce 200 mg dwa razy na dobę mierzona jako AUC0–24), powodował zwiększoną częstość występowania ubytków przegrody międzykomorowej, rzadkiego zdarzenia i zmian u płodu, takich jak zrośnięte żebra, zrośnięte mostki i zniekształcone mostki mostkowe, gdy króliki były leczone w trakcie organogenezy. Zależne od dawki nasilenie przepukliny przeponowej obserwowano, gdy szczurom podawano celekoksyb w dawkach doustnych ≥30 mg/kg/dobę (około 6-krotność ekspozycji u ludzi w oparciu o AUC 0–24 przy 200 mg dwa razy na dobę dla RZS) przez cały czas organogenezy. U szczurów ekspozycja na celekoksyb podczas wczesnego rozwoju embrionalnego skutkowała utratą przed implantacją i po implantacji w dawkach doustnych ≥50 mg/kg/dobę (około 6-krotność ekspozycji u ludzi na podstawie AUC 0–24 przy dawce 200 mg dwa razy na dobę przez RZS).
Celekoksyb nie powodował opóźnień porodu lub porodu w dawkach doustnych do 100 mg/kg u szczurów (około 7-krotna ekspozycja u ludzi mierzona jako AUC 0–24 przy 200 mg dwa razy na dobę). Wpływ CELEBREX na poród i poród u kobiet w ciąży nie jest znany.
Laktacja
Podsumowanie ryzyka
Ograniczone dane z 3 opublikowanych raportów, które obejmowały łącznie 12 kobiet karmiących piersią, wykazały niski poziom CELEBREX w mleku matki. Obliczona średnia dzienna dawka dla niemowląt wynosiła od 10 do 40 mcg/kg/dobę, mniej niż 1% dawki terapeutycznej opartej na masie ciała dla dwuletniego dziecka. Raport dotyczący dwóch karmionych piersią niemowląt w wieku 17 i 22 miesięcy nie wykazał żadnych działań niepożądanych. Należy zachować ostrożność przy podawaniu CELEBREX 100 mg kobiecie karmiącej. Korzyści rozwojowe i zdrowotne wynikające z karmienia piersią powinny być brane pod uwagę wraz z kliniczną potrzebą matki na CELEBREX i wszelkimi potencjalnymi niekorzystnymi skutkami dla karmionego piersią dziecka z CELEBREX 200 mg lub z podstawowym stanem matki.
Kobiety i mężczyźni o potencjale rozrodczym
Bezpłodność
Kobiety
oparciu o mechanizm działania, stosowanie NLPZ, w których pośredniczą prostaglandyny, w tym CELEBREX, może opóźniać lub zapobiegać pękaniu pęcherzyków jajnikowych, które u niektórych kobiet jest związane z odwracalną niepłodnością. Opublikowane badania na zwierzętach wykazały, że podawanie inhibitorów syntezy prostaglandyn może zaburzać pośredniczone przez prostaglandyny pęknięcie pęcherzyka wymagane do owulacji. Niewielkie badania u kobiet leczonych NLPZ wykazały również odwracalne opóźnienie owulacji. Rozważ odstawienie NLPZ, w tym CELEBREX 200 mg, u kobiet, które mają trudności z zajściem w ciążę lub są w trakcie badania niepłodności.
Zastosowanie pediatryczne
CELEBREX 200 mg jest zatwierdzony do łagodzenia oznak i objawów młodzieńczego reumatoidalnego zapalenia stawów u pacjentów w wieku 2 lat i starszych. Bezpieczeństwo i skuteczność u dzieci nie były badane dłużej niż sześć miesięcy. Długotrwała toksyczność sercowo-naczyniowa u dzieci narażonych na CELEBREX 100 mg nie została oceniona i nie wiadomo, czy długoterminowe ryzyko może być podobne do obserwowanego u dorosłych narażonych na CELEBREX lub inne selektywne i nieselektywne NLPZ COX-2 [patrz OSTRZEŻENIE W PUDEŁKU , OSTRZEŻENIA I ŚRODKI , oraz Studia kliniczne ].
Stosowanie celekoksybu u pacjentów w wieku od 2 do 17 lat z małostawową, wielostawową postacią JRA lub u pacjentów z JRA o początku układowym było badane w 12-tygodniowym, podwójnie zaślepionym, kontrolowanym aktywnym badaniu farmakokinetycznym, obejmującym 12-tygodniowe przedłużenie otwartej etykiety. Celekoksybu nie badano u pacjentów w wieku poniżej 2 lat, u pacjentów o masie ciała poniżej 10 kg (22 funty) oraz u pacjentów z aktywnymi cechami ogólnoustrojowymi. Wydaje się, że pacjenci z JRA o początku układowym (bez aktywnych cech układowych) są narażeni na wystąpienie nieprawidłowych wyników laboratoryjnych testów krzepnięcia. U niektórych pacjentów z ogólnoustrojowym JRA zarówno celekoksyb, jak i naproksen wiązały się z łagodnym wydłużeniem czasu częściowej tromboplastyny po aktywacji (APTT), ale nie z czasem protrombinowym (PT). Gdy NLPZ, w tym celekoksyb, są stosowane u pacjentów z JRA o początku układowym, należy monitorować pacjentów pod kątem oznak i objawów nieprawidłowego krzepnięcia lub krwawienia, ze względu na ryzyko rozsianego wykrzepiania wewnątrznaczyniowego. Pacjenci z JRA o początku układowym powinni być monitorowani pod kątem rozwoju nieprawidłowych wyników testów krzepnięcia [patrz DAWKOWANIE I SPOSÓB PODAWANIA , OSTRZEŻENIA I ŚRODKI , DZIAŁANIA NIEPOŻĄDANE , Toksykologia zwierząt , Studia kliniczne ].
Należy rozważyć alternatywne terapie leczenia JRA u pacjentów pediatrycznych zidentyfikowanych jako słabo metabolizujący CYP2C9 [patrz Słabe metabolizatory substratów CYP2C9 ].
Zastosowanie geriatryczne
Pacjenci w podeszłym wieku, w porównaniu z młodszymi pacjentami, są narażeni na większe ryzyko poważnych działań niepożądanych ze strony układu krążenia, przewodu pokarmowego i (lub) nerek związanych z NLPZ. Jeśli przewidywane korzyści dla pacjenta w podeszłym wieku przewyższają potencjalne ryzyko, należy rozpocząć dawkowanie od dolnej granicy zakresu dawkowania i monitorować pacjentów pod kątem działań niepożądanych [patrz OSTRZEŻENIA I ŚRODKI ].
całkowitej liczby pacjentów, którzy otrzymywali CELEBREX 100 mg w badaniach klinicznych przed zatwierdzeniem, ponad 3300 było w wieku 65-74 lata, podczas gdy około 1300 dodatkowych pacjentów miało 75 lat i więcej. Nie zaobserwowano istotnych różnic w skuteczności między tymi osobami a młodszymi osobami. W badaniach klinicznych porównujących czynność nerek mierzoną za pomocą GFR, BUN i kreatyniny oraz czynność płytek mierzoną za pomocą czasu krwawienia i agregacji płytek, wyniki nie różniły się między ochotnikami w podeszłym wieku i młodymi. Jednakże, podobnie jak w przypadku innych NLPZ, w tym tych, które selektywnie hamują COX-2, po wprowadzeniu produktu do obrotu odnotowano więcej spontanicznych doniesień o śmiertelnych zdarzeniach żołądkowo-jelitowych i ostrej niewydolności nerek u osób starszych niż u młodszych pacjentów [patrz OSTRZEŻENIA I ŚRODKI ].
Niewydolność wątroby
Zalecaną dobową dawkę kapsułek CELEBREX u pacjentów z umiarkowanymi zaburzeniami czynności wątroby (klasa B w skali Child-Pugh) należy zmniejszyć o 50%. Nie zaleca się stosowania preparatu CELEBREX u pacjentów z ciężkimi zaburzeniami czynności wątroby [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ].
Zaburzenia czynności nerek
CELEBREX nie jest zalecany u pacjentów z ciężką niewydolnością nerek [patrz OSTRZEŻENIA I ŚRODKI oraz FARMAKOLOGIA KLINICZNA ].
Słabe metabolizatory substratów CYP2C9
U pacjentów, o których wiadomo lub podejrzewa się, że słabo metabolizujący CYP2C9 (tj. CYP2C9*3/*3), na podstawie genotypu lub wcześniejszej historii/doświadczenia z innymi substratami CYP2C9 (takimi jak warfaryna, fenytoina) podawać CELEBREX 200 mg zaczynając od połowy najniższej zalecana dawka. Należy rozważyć alternatywne postępowanie u pacjentów z JRA zidentyfikowanych jako słabo metabolizujący CYP2C9 [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ].
PRZEDAWKOWAĆ
Objawy po ostrym przedawkowaniu NLPZ ograniczały się zazwyczaj do letargu, senności, nudności, wymiotów i bólu w nadbrzuszu, które na ogół ustępowały po zastosowaniu leczenia wspomagającego. Wystąpiło krwawienie z przewodu pokarmowego. Wystąpiło nadciśnienie, ostra niewydolność nerek, depresja oddechowa i śpiączka, ale występowały one rzadko [patrz OSTRZEŻENIA I ŚRODKI ].
Podczas badań klinicznych nie zgłoszono przedawkowania preparatu CELEBREX 200 mg. Dawki do 2400 mg/dobę przez okres do 10 dni u 12 pacjentów nie powodowały poważnej toksyczności. Brak dostępnych informacji dotyczących usuwania celekoksybu przez hemodializę, ale biorąc pod uwagę wysoki stopień wiązania z białkami osocza (>97%) dializa prawdopodobnie nie będzie użyteczna w przypadku przedawkowania.
Prowadź pacjentów z opieką objawową i podtrzymującą po przedawkowaniu NLPZ. Nie ma swoistych odtrutek. Rozważyć wymioty i/lub węgiel aktywowany (60 do 100 gramów u dorosłych, 1 do 2 gramów na kg masy ciała u dzieci) i/lub przeczyszczenie osmotyczne u pacjentów z objawami obserwowanymi w ciągu czterech godzin od spożycia lub u pacjentów z dużym przedawkowaniem ( 5 do 10 razy więcej niż zalecana dawka). Wymuszona diureza, alkalizacja moczu, hemodializa lub hemoperfuzja mogą nie być przydatne z powodu silnego wiązania z białkami.
Aby uzyskać dodatkowe informacje na temat leczenia przedawkowania, skontaktuj się z centrum kontroli zatruć (1-800-222-1222).
PRZECIWWSKAZANIA
CELEBREX jest przeciwwskazany u następujących pacjentów:
- Znana nadwrażliwość (np. reakcje anafilaktyczne i poważne reakcje skórne) na celekoksyb, którykolwiek ze składników produktu leczniczego [patrz OSTRZEŻENIA I ŚRODKI ].
- Historia astmy, pokrzywki lub innych reakcji alergicznych po przyjęciu aspiryny lub innych NLPZ. U takich pacjentów zgłaszano ciężkie, czasami prowadzące do zgonu reakcje anafilaktyczne na NLPZ [patrz OSTRZEŻENIA I ŚRODKI ].
- W warunkach chirurgii CABG [patrz OSTRZEŻENIA I ŚRODKI ].
- U pacjentów, u których wystąpiły reakcje typu alergicznego na sulfonamidy [patrz OSTRZEŻENIA I ŚRODKI ].
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Celekoksyb ma właściwości przeciwbólowe, przeciwzapalne i przeciwgorączkowe.
Uważa się, że mechanizm działania CELEBREX 100 mg wynika z hamowania syntezy prostaglandyn, głównie poprzez hamowanie COX-2.
Celekoksyb jest silnym inhibitorem syntezy prostaglandyn in vitro. Stężenia celekoksybu osiągane podczas terapii wywoływały efekty in vivo. Prostaglandyny uwrażliwiają nerwy doprowadzające i nasilają działanie bradykininy w wywoływaniu bólu w modelach zwierzęcych. Prostaglandyny są mediatorami stanu zapalnego. Ponieważ celekoksyb jest inhibitorem syntezy prostaglandyn, jego mechanizm działania może wynikać ze zmniejszenia stężenia prostaglandyn w tkankach obwodowych.
Farmakodynamika
Płytki krwi
badaniach klinicznych z udziałem zdrowych ochotników, CELEBREX w pojedynczych dawkach do 800 mg i wielokrotnych dawkach 600 mg dwa razy na dobę przez okres do 7 dni (większe niż zalecane dawki terapeutyczne) nie miał wpływu na zmniejszenie agregacji płytek krwi lub wydłużenie czasu krwawienia. Ze względu na brak działania płytkowego CELEBREX 100mg nie zastępuje aspiryny w profilaktyce sercowo-naczyniowej. Nie wiadomo, czy istnieje jakikolwiek wpływ CELEBREX na płytki krwi, który może przyczyniać się do zwiększonego ryzyka poważnych zakrzepowych zdarzeń sercowo-naczyniowych związanych ze stosowaniem CELEBREX.
Zatrzymanie płynów
Hamowanie syntezy PGE2 może prowadzić do retencji sodu i wody poprzez zwiększoną reabsorpcję w grubej pętli wstępującej w rdzeniu nerki Henlego i być może w innych odcinkach dystalnego nefronu. W przewodach zbiorczych PGE2 wydaje się hamować reabsorpcję wody, przeciwdziałając działaniu hormonu antydiuretycznego.
Farmakokinetyka
Celekoksyb wykazuje proporcjonalny do dawki wzrost ekspozycji po podaniu doustnym do 200 mg dwa razy na dobę i mniej niż proporcjonalny wzrost przy wyższych dawkach. Posiada rozległą dystrybucję i wysokie wiązanie białek. Jest metabolizowany głównie przez CYP2C9 z okresem półtrwania wynoszącym około 11 godzin.
Wchłanianie
Maksymalne stężenie celekoksybu w osoczu występuje po około 3 godzinach po podaniu doustnym. W warunkach na czczo zarówno maksymalne stężenia w osoczu (Cmax), jak i pole pod krzywą (AUC) są w przybliżeniu proporcjonalne do dawki do 200 mg dwa razy na dobę; przy większych dawkach wzrost Cmax i AUC jest mniejszy niż proporcjonalny (patrz Efekty żywności ). Nie przeprowadzono badań bezwzględnej biodostępności. Przy wielokrotnym dawkowaniu stan stacjonarny osiągany jest w dniu 5. lub wcześniej. Parametry farmakokinetyczne celekoksybu w grupie zdrowych osób przedstawiono w Tabeli 4.
Efekty żywności
Gdy kapsułki CELEBREX 200 mg przyjmowano z posiłkiem wysokotłuszczowym, maksymalne stężenie w osoczu było opóźnione o około 1 do 2 godzin ze wzrostem całkowitego wchłaniania (AUC) o 10% do 20%. W warunkach na czczo przy dawkach powyżej 200 mg występuje mniej niż proporcjonalny wzrost Cmax i AUC, co uważa się za spowodowane niską rozpuszczalnością leku w środowisku wodnym.
Jednoczesne podawanie produktu CELEBREX z lekami zobojętniającymi kwas żołądkowy zawierającymi glin i magnez powodowało zmniejszenie stężenia celekoksybu w osoczu, ze zmniejszeniem Cmax o 37% i AUC o 10%. CELEBREX w dawkach do 200 mg dwa razy na dobę można podawać niezależnie od pory posiłków. Większe dawki (400 mg dwa razy na dobę) należy podawać z pokarmem w celu poprawy wchłaniania.
zdrowych dorosłych ochotników całkowita ogólnoustrojowa ekspozycja (AUC) na celekoksyb była równoważna, gdy celekoksyb był podawany w postaci nienaruszonej kapsułki lub kapsułki posypanej musem jabłkowym. Nie było znaczących zmian w Cmax, Tmax lub t½ po podaniu zawartości kapsułki z musem jabłkowym [ patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Dystrybucja
U zdrowych osób celekoksyb silnie wiąże się z białkami (~97%) w zakresie dawek klinicznych. Badania in vitro wskazują, że celekoksyb wiąże się głównie z albuminą iw mniejszym stopniu z kwaśną glikoproteiną α. Pozorna objętość dystrybucji w stanie stacjonarnym (V/F) wynosi około 400 l, co sugeruje rozległą dystrybucję do tkanek. Celekoksyb nie wiąże się preferencyjnie z krwinkami czerwonymi.
Eliminacja
Metabolizm
Metabolizm celekoksybu odbywa się głównie za pośrednictwem CYP2C9. W ludzkim osoczu zidentyfikowano trzy metabolity, alkohol pierwszorzędowy, odpowiadający mu kwas karboksylowy i jego koniugat glukuronidowy. Te metabolity są nieaktywne jako inhibitory COX-1 lub COX-2.
Wydalanie
Celekoksyb jest eliminowany głównie w wyniku metabolizmu wątrobowego, przy czym niewielka ilość (
Określone populacje
Geriatryczny
stanie stacjonarnym osoby w podeszłym wieku (powyżej 65 lat) miały o 40% wyższe Cmax i 50% wyższe AUC w porównaniu z osobami młodymi. U starszych kobiet wartości Cmax i AUC celekoksybu są wyższe niż u starszych mężczyzn, ale wzrost ten wynika głównie z mniejszej masy ciała u starszych kobiet. Dostosowanie dawki u osób w podeszłym wieku na ogół nie jest konieczne. Jednak w przypadku pacjentów o masie ciała poniżej 50 kg należy rozpocząć leczenie od najmniejszej zalecanej dawki [ patrz Używaj w określonych populacjach ].
Pediatryczny
Farmakokinetykę celekoksybu w stanie stacjonarnym, podawanego w postaci badanej zawiesiny doustnej, oceniano u 152 pacjentów z JRA w wieku od 2 do 17 lat o masie ciała ≥10 kg z małostawowym lub wielostawowym przebiegiem JRA oraz u pacjentów z JRA o początku układowym. Analiza farmakokinetyki populacyjnej wykazała, że klirens po podaniu doustnym (nieskorygowany względem masy ciała) celekoksybu wzrasta mniej niż proporcjonalnie do wzrostu masy ciała, przy czym przewiduje się, że pacjenci o masie 10 kg i 25 kg mają odpowiednio 40% i 24% niższy klirens w porównaniu z dorosłym RZS o masie 70 kg. pacjent.
Podawanie kapsułek 50 mg dwa razy na dobę pacjentom z JRA o masie ciała ≥12 do ≤25 kg i kapsułek 100 mg pacjentom z JRA o masie ciała >25 kg powinno osiągnąć stężenia w osoczu podobne do obserwowanych w badaniu klinicznym, które wykazało równoważność celekoksybu z naproksen 7,5 mg/kg dwa razy na dobę [ patrz DAWKOWANIE I SPOSÓB PODAWANIA ]. Celekoksybu nie badano u pacjentów z JRA w wieku poniżej 2 lat, u pacjentów o masie ciała poniżej 10 kg (22 funty) lub powyżej 24 tygodni.
Wyścig
Metaanaliza badań farmakokinetycznych sugeruje, że AUC celekoksybu u osób rasy czarnej jest o około 40% wyższe niż u osób rasy kaukaskiej. Przyczyna i znaczenie kliniczne tego odkrycia nie są znane.
Niewydolność wątroby
Badanie farmakokinetyczne u pacjentów z łagodnymi (klasa A w skali Childa-Pugha) i umiarkowanymi (klasa B w skali Childa-Pugha) zaburzeniami czynności wątroby wykazało, że AUC celekoksybu w stanie stacjonarnym jest zwiększone odpowiednio o około 40% i 180% w porównaniu z wartością obserwowaną u zdrowej grupy kontrolnej. tematy. Dlatego zalecaną dobową dawkę kapsułek CELEBREX należy zmniejszyć o około 50% u pacjentów z umiarkowanymi zaburzeniami czynności wątroby (klasa B w skali Child-Pugh). Nie badano pacjentów z ciężkimi zaburzeniami czynności wątroby (klasa C wg Childa-Pugha). Nie zaleca się stosowania preparatu CELEBREX u pacjentów z ciężkimi zaburzeniami czynności wątroby [ patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz Używaj w określonych populacjach ].
Zaburzenia czynności nerek
porównaniu krzyżowym AUC celekoksybu było o około 40% mniejsze u pacjentów z przewlekłą niewydolnością nerek (GFR35–60 ml/min) niż u pacjentów z prawidłową czynnością nerek. Nie stwierdzono istotnego związku między GFR a klirensem celekoksybu. Nie badano pacjentów z ciężką niewydolnością nerek. Podobnie jak w przypadku innych NLPZ, CELEBREX 200 mg nie jest zalecany u pacjentów z ciężką niewydolnością nerek [ patrz OSTRZEŻENIA I ŚRODKI ].
Badania interakcji leków
Badania in vitro wskazują, że celekoksyb nie jest inhibitorem cytochromu P450 2C9, 2C19 lub 3A4.
Badania in vivo wykazały, co następuje:
Aspiryna
Gdy NLPZ podawano z aspiryną, wiązanie NLPZ z białkami było zmniejszone, chociaż klirens wolnego NLPZ nie uległ zmianie. Kliniczne znaczenie tej interakcji nie jest znane. Tabela 3 zawiera klinicznie istotne interakcje leków NLPZ z aspiryną [patrz INTERAKCJE Z LEKAMI ].
Lit
badaniu przeprowadzonym u zdrowych osób średnie stężenie litu w osoczu w stanie stacjonarnym zwiększyło się o około 17% u osób otrzymujących lit 450 mg dwa razy na dobę i CELEBREX 200 mg dwa razy na dobę w porównaniu z osobami otrzymującymi sam lit [ patrz INTERAKCJE Z LEKAMI ].
Flukonazol
Jednoczesne podawanie flukonazolu w dawce 200 mg raz na dobę powodowało dwukrotne zwiększenie stężenia celekoksybu w osoczu. Wzrost ten jest spowodowany hamowaniem metabolizmu celekoksybu przez P450 2C9 przez flukonazol [ patrz INTERAKCJE Z LEKAMI ].
Inne leki
Wpływ celekoksybu na farmakokinetykę i/lub farmakodynamikę gliburydu, ketokonazolu [patrz INTERAKCJE Z LEKAMI ], fenytoina i tolbutamid badano in vivo i nie znaleziono klinicznie istotnych interakcji.
Farmakogenomika
Aktywność CYP2C9 jest zmniejszona u osób z polimorfizmami genetycznymi, które prowadzą do zmniejszonej aktywności enzymów, takich jak osoby homozygotyczne dla polimorfizmów CYP2C9*2 i CYP2C9*3. Ograniczone dane z 4 opublikowanych raportów, które obejmowały łącznie 8 pacjentów z homozygotycznym genotypem CYP2C9*3/*3 wykazały, że ogólnoustrojowe stężenia celekoksybu były od 3 do 7 razy wyższe u tych osób w porównaniu z osobami z CYP2C9*1/*1 lub * Genotypy I/*3. Farmakokinetyka celekoksybu nie była oceniana u pacjentów z innymi polimorfizmami CYP2C9, takimi jak *2, *5, *6, *9 i *11. Szacuje się, że częstość homozygotycznego genotypu *3/*3 wynosi od 0,3% do 1,0% w różnych grupach etnicznych [ patrz DAWKOWANIE I SPOSÓB PODAWANIA , Używaj w określonych populacjach ].
Toksykologia zwierząt
młodych szczurów zaobserwowano zwiększenie częstości występowania podstawowych zmian w plemnikach z lub bez wtórnych zmian, takich jak pospermia najądrza, jak również minimalne lub niewielkie rozszerzenie kanalików nasiennych. Te objawy dotyczące reprodukcji, choć pozornie związane z leczeniem, nie zwiększały częstości występowania ani nasilenia wraz z dawką i mogą wskazywać na zaostrzenie stanu spontanicznego. Podobnych wyników dotyczących reprodukcji nie obserwowano w badaniach młodych lub dorosłych psów lub dorosłych szczurów leczonych celekoksybem. Kliniczne znaczenie tej obserwacji nie jest znane.
Studia kliniczne
Zapalenie kości i stawów
CELEBREX 200mg wykazał znaczne zmniejszenie bólu stawów w porównaniu z placebo. CELEBREX był oceniany pod kątem leczenia objawów przedmiotowych i podmiotowych choroby zwyrodnieniowej stawu kolanowego i biodrowego w badaniach klinicznych kontrolowanych placebo i substancją czynną trwających do 12 tygodni. U pacjentów z chorobą zwyrodnieniową stawów leczenie preparatem CELEBREX w dawce 100 mg dwa razy na dobę lub 200 mg raz na dobę powodowało poprawę wskaźnika choroby zwyrodnieniowej stawów WOMAC (Western Ontario and McMaster Universities), złożonego z bólu, sztywności i wskaźników czynnościowych w chorobie zwyrodnieniowej stawów. W trzech 12-tygodniowych badaniach bólu towarzyszącego zaostrzeniu choroby zwyrodnieniowej stawów, CELEBREX 100 mg dawki 100 mg dwa razy na dobę i 200 mg dwa razy na dobę zapewniły znaczne zmniejszenie bólu w ciągu 24 do 48 godzin od rozpoczęcia dawkowania. Wykazano, że przy dawkach 100 mg dwa razy dziennie lub 200 mg dwa razy dziennie skuteczność CELEBREX 200 mg była podobna do skuteczności naproksenu 500 mg dwa razy dziennie. Dawki 200 mg dwa razy na dobę nie przyniosły żadnych dodatkowych korzyści w porównaniu z dawką 100 mg dwa razy na dobę. Wykazano, że całkowita dzienna dawka 200 mg jest równie skuteczna, niezależnie od tego, czy jest podawana jako 100 mg dwa razy dziennie, czy 200 mg raz dziennie.
Reumatyzm
CELEBREX wykazał znaczne zmniejszenie tkliwości/bólu i obrzęku stawów w porównaniu z placebo. CELEBREX 100 mg był oceniany pod kątem leczenia objawów przedmiotowych i podmiotowych RZS w badaniach klinicznych kontrolowanych placebo i substancjami czynnymi trwających do 24 tygodni. W badaniach tych wykazano, że CELEBREX jest lepszy od placebo, stosując wskaźnik odpowiedzi ACR20, złożony z pomiarów klinicznych, laboratoryjnych i czynnościowych w RZS. Dawki CELEBREX 100 mg dwa razy dziennie i 200 mg dwa razy dziennie były podobne pod względem skuteczności i obie były porównywalne z naproksenem 500 mg dwa razy dziennie.
Chociaż CELEBREX 100 mg dwa razy na dobę i 200 mg dwa razy na dobę zapewniał podobną ogólną skuteczność, niektórzy pacjenci odnieśli dodatkowe korzyści z dawki 200 mg dwa razy na dobę. Dawki 400 mg dwa razy na dobę nie przyniosły żadnych dodatkowych korzyści w porównaniu z dawkami 100 mg do 200 mg dwa razy na dobę.
Młodzieńcze reumatoidalne zapalenie stawów (NCT00652925)
12-tygodniowym, randomizowanym, podwójnie zaślepionym, aktywnym, kontrolowanym, wieloośrodkowym badaniu typu non-inferiority, prowadzonym w grupach równoległych, pacjenci w wieku od 2 do 17 lat z małostawowym, wielostawowym przebiegiem JRA lub JRA o początku układowym (z obecnie nieaktywnymi cechami ogólnoustrojowymi ), otrzymywał jedną z następujących terapii: celekoksyb 3 mg/kg (do maksymalnie 150 mg) dwa razy dziennie; celekoksyb 6 mg/kg (maksymalnie 300 mg) dwa razy dziennie; lub naproksen 7,5 mg/kg (maksymalnie 500 mg) dwa razy na dobę. Wskaźniki odpowiedzi oparto na kryterium definicji poprawy JRA większej lub równej 30% (JRA DOI 30), które jest połączeniem klinicznych, laboratoryjnych i funkcjonalnych miar JRA. Wskaźniki odpowiedzi JRA DOI 30 w 12 tygodniu wynosiły 69%, 80% i 67% odpowiednio w grupach leczonych celekoksybem 3 mg/kg dwa razy dziennie, celekoksybem 6 mg/kg dwa razy dziennie i naproksenem 7,5 mg/kg dwa razy dziennie.
Skuteczność i bezpieczeństwo CELEBREX 100 mg w JRA nie były badane dłużej niż sześć miesięcy. Długotrwała toksyczność sercowo-naczyniowa u dzieci narażonych na CELEBREX 200 mg nie została oceniona i nie wiadomo, czy długoterminowe ryzyko może być podobne do obserwowanego u dorosłych narażonych na CELEBREX 100 mg lub inne selektywne i nieselektywne NLPZ COX-2 [ Widzieć OSTRZEŻENIE W PUDEŁKU , OSTRZEŻENIA I ŚRODKI ].
Zesztywniające zapalenie stawów kręgosłupa
CELEBREX oceniano u pacjentów z AS w dwóch badaniach klinicznych z grupą kontrolną otrzymującą placebo i substancję czynną, trwających 6 i 12 tygodni. W badaniach tych wykazano, że CELEBREX w dawkach 100 mg dwa razy na dobę, 200 mg raz na dobę i 400 mg raz na dobę jest statystycznie lepszy od placebo we wszystkich trzech równorzędnych pierwszorzędowych miarach skuteczności oceniających ogólną intensywność bólu (wizualna skala analogowa), globalna aktywność choroby (wizualna skala analogowa) i zaburzenia czynnościowe (wskaźnik czynnościowy zesztywniającego zapalenia stawów kręgosłupa w kąpieli). W 12-tygodniowym badaniu nie było różnicy w zakresie poprawy pomiędzy dawkami 200 mg i 400 mg CELEBREX 200 mg w porównaniu średniej zmiany w stosunku do wartości wyjściowej, ale był większy odsetek pacjentów, którzy zareagowali na CELEBREX 400 mg, 53 %, niż dla CELEBREX 200 mg, 44%, stosując kryteria oceny odpowiedzi w zesztywniającym zapaleniu stawów kręgosłupa (ASAS20). ASAS 20 definiuje odpowiedź na Indeks funkcjonalny i stan zapalny. Analiza odpowiedzi również wykazała brak zmian we wskaźnikach odpowiedzi po 6 tygodniach.
Znieczulenie, w tym pierwotne bolesne miesiączkowanie
W ostrych modelach przeciwbólowych bólu po operacji jamy ustnej, bólu po zabiegach ortopedycznych i pierwotnego bolesnego miesiączkowania, CELEBREX 100 mg łagodził ból, który był oceniany przez pacjentów jako umiarkowany do ciężkiego. Pojedyncze dawki [patrz DAWKOWANIE I SPOSÓB PODAWANIA ] CELEBREX 200mg zapewnił ulgę w bólu w ciągu 60 minut.
Badanie wyników dotyczących układu sercowo-naczyniowego: prospektywna randomizowana ocena zintegrowanego bezpieczeństwa celekoksybu w porównaniu z ibuprofenem lub naproksenem (PRECYZJA; NCT00346216)
Projekt
Badanie PRECISION było podwójnie ślepą, randomizowaną, kontrolowaną próbą bezpieczeństwa sercowo-naczyniowego u pacjentów z ChZS i RZS z lub z wysokim ryzykiem choroby sercowo-naczyniowej, porównującą celekoksyb z naproksenem i ibuprofenem. Pacjenci zostali losowo przydzieleni do dawki początkowej 100 mg celekoksybu dwa razy dziennie, 600 mg trzy razy dziennie ibuprofenu lub 375 mg dwa razy dziennie naproksenu, z opcją zwiększania dawki w razie potrzeby w celu opanowania bólu. W oparciu o wyznaczone dawki, pacjenci z OA przydzieleni losowo do celekoksybu nie mogli zwiększać dawki.
Pierwszorzędowy punkt końcowy, badanie przeciwpłytkowe Analiza Collaboration (APTC) była niezależnie orzeczoną kompozycją obejmującą zgon z przyczyn sercowo-naczyniowych (w tym zgon krwotoczny), zawał mięśnia sercowego niezakończony zgonem i udar mózgu niezakończony zgonem, z mocą 80% do oceny równoważności. Wszystkim pacjentom przepisano w otwartej próbie esomeprazol (20-40 mg) w celu ochrony żołądka. Randomizację leczenia stratyfikowano według początkowego stosowania małej dawki aspiryny.
Dodatkowo przeprowadzono 4-miesięczne podbadanie oceniające wpływ trzech leków na ciśnienie krwi mierzone za pomocą monitorowania ambulatoryjnego.
Wyniki
Wśród pacjentów z chorobą zwyrodnieniową stawów tylko 0,2% (17/7259) zwiększyło celekoksyb do dawki 200 mg dwa razy dziennie, podczas gdy 54,7% (3946/7208) zwiększyło ibuprofen do 800 mg trzy razy dziennie, a 54,8% (3937/7178) zwiększyło naproksen do dawki 500 mg dwa razy na dobę. Wśród pacjentów z RZS, 55,7% (453/813) zwiększyło celekoksyb do dawki 200 mg dwa razy na dobę, 56,5% (470/832) zwiększyło ibuprofen do 800 mg trzy razy na dobę, a 54,6% (432/791) zwiększyło naproksen do dawka 500 mg dwa razy na dobę; jednak populacja RZS stanowiła tylko 10% populacji próbnej.
Ponieważ stosunkowo niewielu pacjentów z celekoksybem (5,8% [470/8072]) zwiększono dawkę do 200 mg dwa razy na dobę, wyniki badania PRECISION nie są odpowiednie do określenia względnego bezpieczeństwa sercowo-naczyniowego celekoksybu w dawce 200 mg dwa razy na dobę w porównaniu z ibuprofenem i naproksen w przyjmowanych dawkach.
Główny punkt końcowy
Badanie obejmowało dwie wstępnie określone populacje analityczne:
- Populacja ITT (ang. Intent-to-treat populacja): obejmowała wszystkich zrandomizowanych pacjentów obserwowanych przez maksymalnie 30 miesięcy
- Zmodyfikowana populacja ITT (ang. Modified Intent-to-treat populacja): Obejmuje wszystkich zrandomizowanych pacjentów, którzy otrzymali co najmniej jedną dawkę badanego leku i mieli co najmniej jedną wizytę po rozpoczęciu leczenia do wcześniejszego zakończenia leczenia plus 30 dni lub 43 miesiące
Celekoksyb, w dawce 100 mg dwa razy na dobę, w porównaniu z naproksenem lub ibuprofenem w przyjmowanych dawkach, spełnił wszystkie cztery wcześniej określone kryteria równoważności (p
Wyniki pierwotnej analizy dla ITT i mITT są opisane w Tabeli 5.
analizowanej populacji ITT przez 30 miesięcy śmiertelność z jakiejkolwiek przyczyny wyniosła 1,6% w grupie celekoksybu, 1,8% w grupie ibuprofenu i 2,0% w grupie naproksenu.
Ambulatoryjne monitorowanie ciśnienia krwi (ABPM) Badanie cząstkowe
W podbadaniu PRECISION-ABPM, wśród wszystkich 444 pacjentów nadających się do analizy w miesiącu 4, celekoksyb w dawce 100 mg dwa razy na dobę obniżył średnie dobowe ciśnienie skurczowe krwi (SBP) o 0,3 mmHg, podczas gdy ibuprofen i naproksen w przyjmowanych dawkach średnie dobowe SBP o odpowiednio 3,7 i 1,6 mmHg. Zmiany te spowodowały statystycznie istotną i klinicznie istotną różnicę 3,9 mmHg (p=0,009) między celekoksybem i ibuprofenem oraz nieistotną statystycznie różnicę 1,8 (p=0,119) mmHg między celekoksybem i naproksenem.
Studia specjalne
Badania profilaktyki polipów gruczolakowatych (NCT00005094 i NCT00141193)
Bezpieczeństwo sercowo-naczyniowe oceniano w dwóch randomizowanych, podwójnie zaślepionych, kontrolowanych placebo, trzyletnich badaniach z udziałem pacjentów ze sporadycznymi polipami gruczolakowatymi leczonych preparatem CELEBREX: badanie APC (Zapobieganie gruczolakowi za pomocą celekoksybu) i badanie PreSAP (Zapobieganie samoistnym polipom gruczolakowatym) . W badaniu APC zaobserwowano zależny od dawki wzrost złożonego punktu końcowego (ustalonego) zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego lub udaru po zastosowaniu celekoksybu w porównaniu z placebo w ciągu 3 lat leczenia. Badanie PreSAP nie wykazało statystycznie istotnego wzrostu ryzyka dla tego samego złożonego punktu końcowego (uznanego):
- badaniu APC współczynniki ryzyka w porównaniu z placebo dla złożonego punktu końcowego (ustalonego) zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego lub udaru mózgu wynosiły 3,4 (95% CI 1,4–8,5) dla celekoksybu w dawce 400 mg dwa razy na dobę i 2,8 (95% CI 1,1 – 7,2) z celekoksybem 200 mg dwa razy dziennie. Skumulowane wskaźniki dla tego złożonego punktu końcowego w ciągu 3 lat wynosiły odpowiednio 3,0% (20/671 pacjentów) i 2,5% (17/685 pacjentów) w porównaniu z 0,9% (6/679 pacjentów) w grupie otrzymującej placebo. Wzrosty w obu grupach dawek celekoksybu w porównaniu z pacjentami otrzymującymi placebo były głównie spowodowane zwiększoną częstością występowania zawału mięśnia sercowego.
- W badaniu PreSAP współczynnik ryzyka dla tego samego złożonego punktu końcowego (uznany) wyniósł 1,2 (95% CI 0,6 – 2,4) dla celekoksybu 400 mg raz na dobę w porównaniu z placebo. Skumulowane wskaźniki dla tego złożonego punktu końcowego w ciągu 3 lat wyniosły odpowiednio 2,3% (21/933 pacjentów) i 1,9% (12/628 pacjentów).
Badania kliniczne innych NLPZ selektywnych i nieselektywnych wobec COX-2 trwające do trzech lat wykazały zwiększone ryzyko poważnych zakrzepicy sercowo-naczyniowej, zawału mięśnia sercowego i udaru mózgu, które mogą być śmiertelne. W rezultacie wszystkie NLPZ są uważane za potencjalnie związane z tym ryzykiem.
Celekoksyb Długoterminowe Badanie Bezpieczeństwa Stawów (KLASA)
Było to prospektywne, długoterminowe badanie dotyczące bezpieczeństwa, przeprowadzone po wprowadzeniu do obrotu z udziałem około 5800 pacjentów z chorobą zwyrodnieniową stawów i 2200 pacjentów z RZS. Pacjenci otrzymywali CELEBREX 400 mg dwa razy na dobę (odpowiednio 4-krotność i 2-krotność zalecanych dawek OA i RZS), ibuprofen 800 mg trzy razy na dobę lub diklofenak 75 mg dwa razy na dobę (powszechne dawki terapeutyczne). Mediana ekspozycji dla CELEBREX (n = 3987) i diklofenaku (n = 1996) wyniosła 9 miesięcy, a dla ibuprofenu (n = 1985) 6 miesięcy. Pierwszorzędowym punktem końcowym tego badania końcowego była częstość występowania powikłanych owrzodzeń (krwawienia z przewodu pokarmowego, perforacji lub niedrożności). Pacjenci mogli jednocześnie przyjmować aspirynę (≤325 mg/dobę) w małej dawce (≤325 mg/dobę) w profilaktyce sercowo-naczyniowej (podgrupy ASA: CELEBREX, n = 882; diklofenak, n = 445; ibuprofen, n = 412). Różnice w częstości występowania powikłanych owrzodzeń między preparatem CELEBREX 200 mg a skojarzoną grupą ibuprofenu i diklofenaku nie były istotne statystycznie.
pacjentów przyjmujących CELEBREX i jednocześnie otrzymujących małą dawkę ASA (N=882) częstość występowania powikłanych owrzodzeń była 4-krotnie wyższa niż u pacjentów, którzy nie przyjmowali ASA (N=3105). Wskaźnik Kaplana-Meiera dla powikłanych owrzodzeń po 9 miesiącach wyniósł 1,12% w porównaniu z 0,32% odpowiednio dla osób przyjmujących ASA w małych dawkach i osób nieprzyjmujących ASA [patrz OSTRZEŻENIA I ŚRODKI ].
Szacunkowe skumulowane częstości występowania powikłanych i objawowych owrzodzeń po 9 miesiącach u pacjentów leczonych preparatem CELEBREX 400 mg dwa razy na dobę przedstawiono w Tabeli 7. Tabela 7 przedstawia również wyniki dla pacjentów w wieku poniżej lub powyżej 65 lat. Różnica w częstościach pomiędzy samym CELEBREX 200mg a CELEBREX 100mg z grupami ASA może być spowodowana wyższym ryzykiem wystąpienia zdarzeń żołądkowo-jelitowych u użytkowników ASA.
niewielkiej liczby pacjentów z chorobą wrzodową w wywiadzie częstość występowania powikłanych i objawowych owrzodzeń u pacjentów przyjmujących CELEBREX 100 mg w monoterapii lub CELEBREX 100 mg z ASA wynosiła odpowiednio 2,56% (n=243) i 6,85% (n=91) w 48 tygodni. Tych wyników należy się spodziewać u pacjentów z chorobą wrzodową w wywiadzie [patrz OSTRZEŻENIA I ŚRODKI oraz DZIAŁANIA NIEPOŻĄDANE ].
Wyniki dotyczące bezpieczeństwa sercowo-naczyniowego zostały również ocenione w badaniu CLASS. Skumulowane wskaźniki Kaplana-Meiera dotyczące zgłaszanych przez badaczy poważnych sercowo-naczyniowych zdarzeń zakrzepowo-zatorowych (w tym MI, zatorowości płucnej, zakrzepicy żył głębokich, niestabilnej dławicy piersiowej, przemijających ataków niedokrwiennych i udarów niedokrwiennych mózgu) nie wykazały różnic między leczeniem CELEBREX 200 mg, diklofenakiem lub ibuprofenem grupy. Skumulowane wskaźniki u wszystkich pacjentów po dziewięciu miesiącach dla CELEBREX, diklofenaku i ibuprofenu wynosiły odpowiednio 1,2%, 1,4% i 1,1%. Skumulowane wskaźniki u osób nie stosujących ASA po dziewięciu miesiącach w każdej z trzech grup leczenia wynosiły mniej niż 1%. Skumulowane wskaźniki zawału mięśnia sercowego u osób nie stosujących ASA po dziewięciu miesiącach w każdej z trzech grup leczenia wynosiły mniej niż 0,2%. W badaniu CLASS nie było grupy placebo, co ogranicza możliwość ustalenia, czy trzy badane leki nie miały zwiększonego ryzyka incydentów sercowo-naczyniowych, czy też wszystkie zwiększały ryzyko w podobnym stopniu. W badaniu CLASS skumulowane wskaźniki Kaplana-Meiera po 9 miesiącach obrzęku obwodowego u pacjentów otrzymujących CELEBREX 400 mg dwa razy na dobę (odpowiednio 4-krotność i 2-krotność zalecanych dawek OA i RA), ibuprofen 800 mg trzy razy na dobę i diklofenak 75 mg dwa razy na dobę wynosiły odpowiednio 4,5%, 6,9% i 4,7%. Wskaźniki nadciśnienia tętniczego w badaniu CLASS w grupie pacjentów leczonych CELEBREX, ibuprofenem i diklofenakiem wynosiły odpowiednio 2,4%, 4,2% i 2,5%.
Badania endoskopowe
Nie ustalono korelacji między wynikami krótkoterminowych badań endoskopowych z preparatem CELEBREX a względną częstością występowania klinicznie istotnych poważnych zdarzeń w górnym odcinku przewodu pokarmowego przy długotrwałym stosowaniu. W kontrolowanych i otwartych badaniach klinicznych u pacjentów otrzymujących CELEBREX 100 mg obserwowano poważne klinicznie istotne krwawienie z górnego odcinka przewodu pokarmowego [patrz OSTRZEŻENIA I ŚRODKI oraz Studia kliniczne ].
Przeprowadzono randomizowane, podwójnie zaślepione badanie z udziałem 430 pacjentów z RZS, w którym badanie endoskopowe wykonano po 6 miesiącach. Częstość występowania owrzodzeń endoskopowych u pacjentów przyjmujących CELEBREX 200 mg dwa razy na dobę wynosiła 4% w porównaniu do 15% u pacjentów przyjmujących diklofenak SR 75 mg dwa razy na dobę. Jednak CELEBREX nie różnił się statystycznie od diklofenaku pod względem klinicznie istotnych wyników ze strony przewodu pokarmowego w badaniu CLASS [patrz Studia kliniczne ].
Częstość występowania owrzodzeń endoskopowych była badana w dwóch 12-tygodniowych badaniach kontrolowanych placebo z udziałem 2157 pacjentów z ChZS i RZS, u których wyjściowa endoskopia nie wykazała owrzodzeń. Nie stwierdzono zależności między dawką a występowaniem choroby wrzodowej żołądka i dwunastnicy a dawką preparatu CELEBREX (50 mg do 400 mg dwa razy na dobę). Częstość występowania naproksenu w dawce 500 mg dwa razy na dobę wynosiła 16,2% i 17,6% w obu badaniach, placebo 2,0% i 2,3%, a dla wszystkich dawek preparatu CELEBREX częstość występowania wahała się od 2,7% do 5,9%. Nie przeprowadzono dużych badań klinicznych oceniających wyniki kliniczne w celu porównania istotnych klinicznie wyników ze strony przewodu pokarmowego z preparatem CELEBREX i naproksenem.
W badaniach endoskopowych około 11% pacjentów przyjmowało aspirynę (≤325 mg/dobę). W grupach CELEBREX częstość występowania owrzodzeń endoskopowych okazała się wyższa u osób stosujących aspirynę niż u osób niestosujących. Jednak zwiększona częstość owrzodzeń u tych użytkowników aspiryny była mniejsza niż częstość owrzodzeń endoskopowych obserwowana w aktywnych grupach porównawczych, z aspiryną lub bez.
INFORMACJA O PACJENCIE
Przewodnik po lekach dla niesteroidowych leków przeciwzapalnych (NLPZ)
Jakie są najważniejsze informacje, które powinienem wiedzieć o lekach zwanych niesteroidowymi lekami przeciwzapalnymi (NLPZ)?
NLPZ mogą powodować poważne skutki uboczne, w tym:
- Zwiększone ryzyko zawału serca lub udaru mózgu, które mogą prowadzić do śmierci. Ryzyko to może wystąpić na początku leczenia i może wzrosnąć:
- ze wzrastającymi dawkami NLPZ
- przy dłuższym stosowaniu NLPZ
Nie należy przyjmować NLPZ bezpośrednio przed lub po operacji serca zwanej „pomostowaniem aortalno-wieńcowym (CABG).” Unikaj przyjmowania NLPZ po niedawnym zawale serca, chyba że zaleci Ci to Twój lekarz. Możesz mieć zwiększone ryzyko kolejnego zawału serca, jeśli przyjmujesz NLPZ po niedawnym zawale serca.
- Zwiększone ryzyko krwawienia, owrzodzeń i pęknięć (perforacji) przełyku (przewodu prowadzącego z jamy ustnej do żołądka), żołądka i jelit:
- w dowolnym momencie podczas użytkowania
- bez objawów ostrzegawczych
- które mogą spowodować śmierć
- Ryzyko owrzodzenia lub krwawienia wzrasta wraz z:
- wrzody żołądka w przeszłości lub krwawienie z żołądka lub jelit po zastosowaniu NLPZ
- przyjmowanie leków zwanych „kortykosteroidami”, „lekami przeciwpłytkowymi”, „antykoagulantami”, „SSRI” lub „SNRI”
- rosnące dawki NLPZ
- dłuższe stosowanie NLPZ
- palenie
- picie alkoholu
- starszy wiek
- słabe zdrowie
- zaawansowana choroba wątroby
- problemy z krwawieniem
- NLPZ powinny być stosowane wyłącznie:
- dokładnie zgodnie z zaleceniami
- w najniższej możliwej dawce dla twojego leczenia
- na najkrótszy potrzebny czas
Co to są NLPZ?
NLPZ są stosowane w leczeniu bólu i zaczerwienienia, obrzęku i gorąca (zapalenia) z powodu schorzeń, takich jak różne rodzaje zapalenia stawów, skurcze menstruacyjne i inne rodzaje krótkotrwałego bólu.
Kto nie powinien brać NLPZ?
Nie przyjmuj NLPZ:
- jeśli u pacjenta wystąpił atak astmy, pokrzywka lub inna reakcja alergiczna na aspirynę lub inne NLPZ.
- tuż przed lub po operacji pomostowania aortalno-wieńcowego.
Przed zażyciem NLPZ poinformuj swojego lekarza o wszystkich swoich schorzeniach, w tym jeśli:
- masz problemy z wątrobą lub nerkami
- mieć wysokie ciśnienie krwi
- mieć astmę
- są w ciąży lub planują zajść w ciążę. Przyjmowanie NLPZ w około 20. tygodniu ciąży lub później może zaszkodzić nienarodzonemu dziecku. Jeśli musisz zażywać NLPZ przez ponad 2 dni między 20. a 30. tygodniem ciąży, Twój lekarz może być zmuszony do monitorowania ilości płynu w macicy wokół Twojego dziecka. Nie należy przyjmować NLPZ po około 30. tygodniu ciąży
- karmisz piersią lub planujesz karmić piersią.
Poinformuj swojego lekarza o wszystkich przyjmowanych lekach, w tym o lekach na receptę lub dostępnych bez recepty, witaminach lub suplementach ziołowych. NLPZ i niektóre inne leki mogą wchodzić ze sobą w interakcje i powodować poważne skutki uboczne. Nie rozpoczynaj przyjmowania nowych leków bez uprzedniej konsultacji z lekarzem.
Jakie są możliwe skutki uboczne NLPZ?
NLPZ mogą powodować poważne skutki uboczne, w tym:
Patrz „ Jakie są najważniejsze informacje, które powinienem wiedzieć o lekach zwanych niesteroidowymi lekami przeciwzapalnymi (NLPZ)?
- nowe lub gorsze wysokie ciśnienie krwi
- niewydolność serca
- problemy z wątrobą, w tym niewydolność wątroby
- problemy z nerkami, w tym niewydolność nerek
- niski poziom czerwonych krwinek (niedokrwistość)
- zagrażające życiu reakcje skórne
- zagrażające życiu reakcje alergiczne
Inne skutki uboczne NLPZ obejmują: ból brzucha, zaparcia, biegunka, gazy, zgaga, nudności, wymioty i zawroty głowy.
Natychmiast uzyskaj pomoc w nagłych wypadkach, jeśli wystąpi którykolwiek z następujących objawów:
- duszność lub trudności w oddychaniu
- ból w klatce piersiowej
- osłabienie w jednej części lub boku ciała
- bełkotliwa wymowa
- obrzęk twarzy lub gardła
Przestań brać NLPZ i natychmiast skontaktuj się z lekarzem, jeśli wystąpi którykolwiek z następujących objawów:
- mdłości
- bardziej zmęczony lub słabszy niż zwykle
- biegunka
- swędzący
- Twoja skóra lub oczy wyglądają na żółte
- niestrawność lub ból brzucha
- objawy grypopodobne
- krew wymiotów
- w wypróżnieniach pojawia się krew lub jest czarna i lepka jak smoła
- nietypowy przyrost masy ciała
- wysypka skórna lub pęcherze z gorączką
- obrzęk ramion, nóg, dłoni i stóp
Jeśli zażyjesz zbyt dużo NLPZ, skontaktuj się z lekarzem lub natychmiast uzyskaj pomoc medyczną.
To nie wszystkie możliwe skutki uboczne NLPZ. Aby uzyskać więcej informacji, zapytaj swojego lekarza lub farmaceutę o NLPZ.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Inne informacje o NLPZ
- Aspiryna jest NLPZ, ale nie zwiększa ryzyka zawału serca. Aspiryna może powodować krwawienie w mózgu, żołądku i jelitach. Aspiryna może również powodować wrzody żołądka i jelit.
- Niektóre NLPZ są sprzedawane w mniejszych dawkach bez recepty (bez recepty). Porozmawiaj ze swoim lekarzem przed użyciem NLPZ dostępnych bez recepty przez ponad 10 dni.
Ogólne informacje o bezpiecznym i skutecznym stosowaniu NLPZ
Leki są czasami przepisywane do celów innych niż wymienione w Przewodniku po lekach. Nie należy stosować NLPZ w stanie, na który nie został przepisany. Nie podawaj NLPZ innym osobom, nawet jeśli mają takie same objawy jak ty. Może im to zaszkodzić.
Jeśli chcesz uzyskać więcej informacji na temat NLPZ, porozmawiaj ze swoim lekarzem. Możesz poprosić farmaceutę lub pracownika służby zdrowia o informacje na temat NLPZ, które są przeznaczone dla pracowników służby zdrowia.
Ten przewodnik po lekach został zatwierdzony przez amerykańską Agencję ds. Żywności i Leków.
