Seroquel 25mg, 50mg, 100mg, 200mg, 300mg Quetiapine Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Seroquel 100mg i jak się go stosuje?
Seroquel 50mg to lek na receptę stosowany w leczeniu objawów schizofrenii, choroby afektywnej dwubiegunowej typu I, manii; zaburzenie afektywne dwubiegunowe, epizody depresyjne; zaburzenie dwubiegunowe typu I, podtrzymanie; i ciężkie zaburzenie depresyjne. Seroquel 50mg może być stosowany samodzielnie lub z innymi lekami.
Seroquel należy do klasy leków przeciwpsychotycznych drugiej generacji; Środki antymaniakalne.
Nie wiadomo, czy Seroquel 200 mg jest bezpieczny i skuteczny u dzieci w wieku poniżej 12 lat.
Jakie są możliwe skutki uboczne Seroquel 50mg?
Seroquel może powodować poważne skutki uboczne, w tym:
- niekontrolowane ruchy mięśni twarzy (żucie, mlaskanie, marszczenie brwi, ruchy języka, mruganie lub ruch gałek ocznych),
- maskowaty wygląd twarzy,
- kłopoty z połykaniem,
- problemy z mową,
- zawroty,
- ciężkie zaparcia,
- bolesne lub utrudnione oddawanie moczu,
- rozmazany obraz,
- widzenie tunelowe,
- ból oka,
- widząc aureole wokół świateł,
- bardzo sztywne (sztywne) mięśnie,
- wysoka gorączka,
- wyzysk,
- dezorientacja,
- szybkie lub nierówne bicie serca,
- drżenia,
- półomdlały,
- zwiększone pragnienie,
- zwiększone oddawanie moczu,
- suchość w ustach,
- owocowy zapach oddechu,
- gorączka,
- dreszcze,
- owrzodzenia jamy ustnej,
- owrzodzenia skóry,
- ból gardła,
- kaszel i
- problemy z oddychaniem
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Seroquel to:
- problemy z mową,
- zawroty głowy,
- senność,
- zmęczenie,
- brak energii,
- szybkie bicie serca,
- zatkany nos,
- zwiększony apetyt,
- przybranie na wadze,
- rozstrój żołądka,
- wymioty,
- zaparcie,
- suchość w ustach i
- nieprawidłowy test czynności wątroby
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Seroquel. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OSTRZEŻENIE
ZWIĘKSZONA ŚMIERTELNOŚĆ U PACJENTÓW W STARSZYM WIEKU Z PSYCHOZĄ ZWIĄZANĄ Z ODMĘDZENIEM; MYŚLI I ZACHOWANIA SAMOBÓJCZE
Zwiększona śmiertelność u starszych pacjentów z psychozą związaną z demencją
Pacjenci w podeszłym wieku z psychozą otępienną leczeni lekami przeciwpsychotycznymi są narażeni na zwiększone ryzyko zgonu [patrz OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI]. SEROQUEL nie jest zatwierdzony do leczenia pacjentów z psychozą związaną z otępieniem [patrz OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI].
Myśli i zachowania samobójcze
W badaniach krótkoterminowych leki przeciwdepresyjne zwiększały ryzyko myśli i zachowań samobójczych u dzieci, młodzieży i młodych dorosłych. Badania te nie wykazały wzrostu ryzyka myśli i zachowań samobójczych podczas stosowania leków przeciwdepresyjnych u pacjentów w wieku powyżej 24 lat; wystąpiło zmniejszenie ryzyka przy stosowaniu leków przeciwdepresyjnych u pacjentów w wieku 65 lat i starszych [patrz OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI].
pacjentów w każdym wieku, którzy rozpoczęli terapię przeciwdepresyjną, należy uważnie monitorować pogorszenie i pojawienie się myśli i zachowań samobójczych. Poinformuj rodziny i opiekunów o potrzebie ścisłej obserwacji i komunikacji z lekarzem [patrz OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI].
SEROQUEL 50 mg nie jest zatwierdzony do stosowania u dzieci w wieku poniżej 10 lat [patrz Stosowanie w określonych populacjach].
OPIS
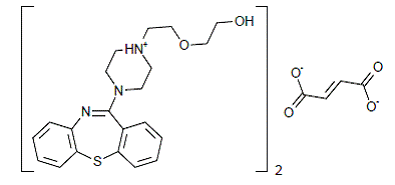
SEROQUEL® (fumaran kwetiapiny) jest środkiem psychotropowym należącym do klasy chemicznej, pochodnych dibenzotiazepiny. Oznaczenie chemiczne to fumaran 2-[2-(4-dibenzo[b,f][1,4]tiazepin-11-ylo-1-piperazynylo)etoksy]etanolu (2:1) (sól). Występuje w tabletkach jako sól fumaranowa. Wszystkie dawki i moce tabletek są wyrażone w miligramach zasady, a nie w postaci soli fumaranowej. Jego wzór cząsteczkowy to C42H50N6O4S2•C4H4O4 i ma masę cząsteczkową 883,11 (sól fumaranowa). Wzór strukturalny to:
Fumaran kwetiapiny jest krystalicznym proszkiem o barwie od białej do białawej, umiarkowanie rozpuszczalnym w wodzie.
SEROQUEL jest dostarczany do podawania doustnego w postaci 25 mg (okrągły, brzoskwiniowy), 50 mg (okrągły, biały), 100 mg (okrągły, żółty), 200 mg (okrągły, biały), 300 mg (w kształcie kapsułki, biały) oraz 400 mg (w kształcie kapsułki, żółte) tabletki.
Składniki nieaktywne to powidon, dwuwodny dwuzasadowy fosforan dwuwapniowy, celuloza mikrokrystaliczna, glikolan sodowy skrobi, monohydrat laktozy, stearynian magnezu, hypromeloza, glikol polietylenowy i dwutlenek tytanu.
Tabletki 25 mg zawierają czerwony tlenek żelaza i żółty tlenek żelaza, a tabletki 100 mg i 400 mg zawierają tylko żółty tlenek żelaza.
WSKAZANIA
Schizofrenia
SEROQUEL XR jest wskazany w leczeniu schizofrenii. Skuteczność preparatu SEROQUEL XR w schizofrenii ustalono w jednym 6-tygodniowym i jednym badaniu podtrzymującym u dorosłych ze schizofrenią. Skuteczność potwierdziły trzy 6-tygodniowe badania z udziałem osób dorosłych ze schizofrenią i jedno 6-tygodniowe badanie u młodzieży ze schizofrenią (13-17 lat) leczonych preparatem SEROQUEL [patrz Studia kliniczne ].
Zaburzenie afektywne dwubiegunowe
SEROQUEL 25mg XR jest wskazany do doraźnego leczenia epizodów maniakalnych lub mieszanych związanych z chorobą afektywną dwubiegunową typu I, zarówno w monoterapii, jak i jako uzupełnienie litu lub diwalproexu. Skuteczność produktu SEROQUEL XR w epizodach maniakalnych lub mieszanych w przebiegu choroby afektywnej dwubiegunowej typu I została ustalona w jednym 3-tygodniowym badaniu u dorosłych z epizodami maniakalnymi lub mieszanymi związanymi z chorobą afektywną dwubiegunową typu I. Skuteczność potwierdziły dwa 12-tygodniowe badania monoterapii i jedno 3-tygodniowe badanie uzupełniające u dorosłych z epizodami maniakalnymi związanymi z zaburzeniem afektywnym dwubiegunowym typu I oraz jedno 3-tygodniowe badanie monoterapii u dzieci i młodzieży (10-17 lat) z epizodami maniakalnymi związanymi z chorobą afektywną dwubiegunową typu I leczonych produktem SEROQUEL [patrz Studia kliniczne ].
SEROQUEL 100mg XR jest wskazany do doraźnego leczenia epizodów depresyjnych związanych z chorobą afektywną dwubiegunową. Skuteczność preparatu SEROQUEL XR ustalono w jednym 8-tygodniowym badaniu u dorosłych z chorobą afektywną dwubiegunową I lub II i poparto dwoma 8-tygodniowymi badaniami u dorosłych z chorobą afektywną dwubiegunową I lub II leczonych preparatem SEROQUEL [patrz Studia kliniczne ].
SEROQUEL 100mg XR jest wskazany w leczeniu podtrzymującym choroby afektywnej dwubiegunowej typu I, jako uzupełnienie litu lub diwalproexu. Skuteczność ekstrapolowano na podstawie dwóch badań podtrzymujących u dorosłych z chorobą afektywną dwubiegunową typu I leczonych produktem SEROQUEL. Skuteczność monoterapii w leczeniu podtrzymującym choroby afektywnej dwubiegunowej typu I nie była systematycznie oceniana w kontrolowanych badaniach klinicznych [patrz Studia kliniczne ].
Leczenie wspomagające ciężkiego zaburzenia depresyjnego (MDD)
SEROQUEL 100mg XR jest wskazany do stosowania jako terapia wspomagająca leki przeciwdepresyjne w leczeniu MDD. Skuteczność preparatu SEROQUEL XR jako terapii wspomagającej do leków przeciwdepresyjnych w MDD ustalono w dwóch 6-tygodniowych badaniach z udziałem dorosłych z MDD, którzy mieli niewystarczającą odpowiedź na leczenie przeciwdepresyjne [patrz Studia kliniczne ].
Szczególne względy w leczeniu schizofrenii dziecięcej i zaburzenia afektywnego dwubiegunowego typu I
Schizofrenia dziecięca i choroba afektywna dwubiegunowa typu I są poważnymi zaburzeniami psychicznymi, jednak diagnoza może być trudna. W przypadku schizofrenii dziecięcej profile objawów mogą być zmienne, a w przypadku zaburzenia afektywnego dwubiegunowego typu I pacjenci mogą mieć różne wzorce okresowości objawów maniakalnych lub mieszanych. Zaleca się, aby leczenie farmakologiczne schizofrenii dziecięcej i choroby afektywnej dwubiegunowej typu I rozpocząć dopiero po przeprowadzeniu dokładnej oceny diagnostycznej i starannym rozważeniu zagrożeń związanych z leczeniem farmakologicznym. Leczenie farmakologiczne zarówno schizofrenii dziecięcej, jak i choroby afektywnej dwubiegunowej typu I jest wskazane jako część całościowego programu leczenia, który często obejmuje interwencje psychologiczne, edukacyjne i społeczne.
DAWKOWANIE I SPOSÓB PODAWANIA
Ważne instrukcje administracyjne
Tabletki SEROQUEL XR należy połykać w całości, a nie dzielić, żuć ani kruszyć.
Zaleca się przyjmowanie SEROQUEL 50mg XR na czczo lub z lekkim posiłkiem (około 300 kcal) [patrz FARMAKOLOGIA KLINICZNA ].
SEROQUEL 25mg XR należy podawać raz dziennie, najlepiej wieczorem.
Zalecane dawkowanie
Zalecana dawka początkowa, dostosowanie, zakres dawek i maksymalna dawka produktu SEROQUEL 50 mg XR dla każdego zatwierdzonego wskazania przedstawiono w Tabeli 1 poniżej. Po początkowym dawkowaniu, w razie potrzeby można dokonać korekty w górę lub w dół, w zależności od odpowiedzi klinicznej i tolerancji pacjenta [patrz Studia kliniczne ].
Leczenie podtrzymujące schizofrenii i zaburzenia afektywnego dwubiegunowego typu I
Leczenie podtrzymujące
Pacjenci powinni być okresowo poddawani ponownej ocenie w celu ustalenia potrzeby leczenia podtrzymującego i odpowiedniej dawki do takiego leczenia [patrz Studia kliniczne ].
Modyfikacje dawki u pacjentów w podeszłym wieku
Należy rozważyć wolniejsze tempo dostosowywania dawki i mniejszą dawkę docelową u osób w podeszłym wieku oraz u pacjentów osłabionych lub mających skłonność do reakcji hipotensyjnych [patrz Używaj w określonych populacjach , oraz FARMAKOLOGIA KLINICZNA ]. Jeśli jest to wskazane, u tych pacjentów należy ostrożnie zwiększać dawkę.
pacjentów w podeszłym wieku należy rozpocząć leczenie produktem SEROQUEL XR 50 mg/dobę, a dawkę można zwiększać o 50 mg/dobę w zależności od odpowiedzi klinicznej i tolerancji danego pacjenta.
Modyfikacje dawki u pacjentów z zaburzeniami czynności wątroby
U pacjentów z zaburzeniami czynności wątroby należy rozpocząć leczenie produktem SEROQUEL XR 50 mg/dobę. Dawkę można zwiększać codziennie o 50 mg/dobę do dawki skutecznej, w zależności od odpowiedzi klinicznej i tolerancji pacjenta.
Modyfikacje dawki w przypadku stosowania z inhibitorami CYP3A4
Dawkę produktu SEROQUEL XR należy zmniejszyć do jednej szóstej dawki pierwotnej w przypadku jednoczesnego stosowania silnego inhibitora CYP3A4 (np. ketokonazol, itrakonazol, indynawir, rytonawir, nefazodon itp.). Po odstawieniu inhibitora CYP3A4 dawkę produktu SEROQUEL XR należy zwiększyć 6-krotnie [patrz FARMAKOLOGIA KLINICZNA oraz INTERAKCJE Z LEKAMI ].
Modyfikacje dawki w przypadku stosowania z induktorami CYP3A4
Dawkę produktu SEROQUEL XR należy zwiększyć maksymalnie 5-krotnie w stosunku do dawki początkowej, gdy jest stosowany w skojarzeniu z przewlekłym leczeniem (np. trwającym dłużej niż 7-14 dni) silnym induktorem CYP3A4 (np. fenytoina, karbamazepina, ryfampicyna, awasimib, St ziele zwyczajne itp.). Dawkę należy dostosowywać w oparciu o odpowiedź kliniczną i tolerancję danego pacjenta. Po odstawieniu induktora CYP3A4 dawkę SEROQUEL 100 mg XR należy zmniejszyć do pierwotnego poziomu w ciągu 7-14 dni [patrz FARMAKOLOGIA KLINICZNA oraz INTERAKCJE Z LEKAMI ].
Ponowne rozpoczęcie leczenia u pacjentów wcześniej przerwanych
Chociaż nie ma danych dotyczących konkretnie wznowienia leczenia, zaleca się, aby w przypadku wznowienia leczenia pacjentów, którzy odstawili SEROQUEL 50 mg XR dłużej niż tydzień, postępować zgodnie z pierwotnym schematem dawkowania. W przypadku ponownego rozpoczynania leczenia pacjentów, którzy odstawili SEROQUEL 300 mg XR krócej niż tydzień, stopniowe zwiększanie dawki może nie być konieczne i można ponownie rozpocząć podawanie dawki podtrzymującej.
Zmiana pacjentów z tabletek SEROQUEL 50 mg na tabletki SEROQUEL 100 mg XR
Pacjenci, którzy są obecnie leczeni produktem SEROQUEL (postać o natychmiastowym uwalnianiu) mogą przejść na SEROQUEL XR w równoważnej całkowitej dawce dobowej przyjmowanej raz na dobę. Może być konieczne indywidualne dostosowanie dawki.
Przejście z leków przeciwpsychotycznych
Nie ma systematycznie gromadzonych danych dotyczących konkretnie zmiany pacjentów z innych leków przeciwpsychotycznych na SEROQUEL 200 mg XR lub dotyczących jednoczesnego podawania z innymi lekami przeciwpsychotycznymi. O ile natychmiastowe przerwanie wcześniejszego leczenia przeciwpsychotycznego może być akceptowalne dla niektórych pacjentów, o tyle bardziej stopniowe odstawienie może być najbardziej odpowiednie dla innych. We wszystkich przypadkach należy zminimalizować okres nakładania się leków przeciwpsychotycznych. W przypadku zmiany leczenia z leków przeciwpsychotycznych w postaci depot, jeśli jest to uzasadnione z medycznego punktu widzenia, należy rozpocząć terapię SEROQUEL XR zamiast następnego zaplanowanego wstrzyknięcia. Potrzeba kontynuacji istniejących leków na zespół pozapiramidowy powinna być okresowo oceniana.
JAK DOSTARCZONE
Formy dawkowania i mocne strony
- Tabletki o przedłużonym uwalnianiu 50 mg są brzoskwiniowe, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe, z napisem „XR 50” po jednej stronie i gładkie po drugiej stronie
- Tabletki o przedłużonym uwalnianiu 150 mg są białe, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe, z napisem „XR 150” po jednej stronie i gładkie po drugiej stronie
- Tabletki o przedłużonym uwalnianiu 200 mg są żółte, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe, z napisem „XR 200” po jednej stronie i gładkie po drugiej stronie
- Tabletki o przedłużonym uwalnianiu 300 mg są jasnożółte, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe, z napisem „XR 300” po jednej stronie i gładkie po drugiej stronie
- Tabletki o przedłużonym uwalnianiu 400 mg to białe, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe tabletki z napisem „XR 400” po jednej stronie i gładkie po drugiej stronie
Składowania i stosowania
Tabletki 50 mg ( NDC 0310-0280-60) brzoskwiniowe, powlekane, w kształcie kapsułki, dwuwypukłe, wypukłe tabletki z napisem „XR 50” po jednej stronie i gładkie po drugiej, są dostarczane w butelkach po 60 tabletek.
Tabletki 150 mg ( NDC 0310-0281-60) białe, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe tabletki z napisem „XR 150” po jednej stronie i gładkie po drugiej, dostarczane w butelkach po 60 tabletek.
Tabletki 200 mg ( NDC 0310-0282-60) żółte, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe tabletki z napisem „XR 200” po jednej stronie i gładkie po drugiej, dostarczane w butelkach po 60 tabletek.
Tabletki 300 mg ( NDC 0310-0283-60) jasnożółte, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe tabletki z napisem „XR 300” po jednej stronie i gładkie po drugiej, dostarczane są w butelkach po 60 tabletek.
Tabletki 400 mg ( NDC 0310-0284-60) białe, powlekane, w kształcie kapsułki, obustronnie wypukłe, wypukłe tabletki z napisem „XR 400” po jednej stronie i gładkie po drugiej, dostarczane w butelkach po 60 tabletek.
Przechowywać SEROQUEL XR w temperaturze 25°C (77°F); wycieczki dozwolone do 15-30°C (59-86°F) [Patrz USP ].
Dystrybutor: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Aktualizacja: marzec 2020
SKUTKI UBOCZNE
Następujące działania niepożądane omówiono bardziej szczegółowo w innych punktach oznakowania:
- Zwiększona śmiertelność u starszych pacjentów z psychozą związaną z otępieniem [patrz OSTRZEŻENIA I ŚRODKI ]
- Myśli i zachowania samobójcze u nastolatków i młodych dorosłych [patrz OSTRZEŻENIA I ŚRODKI ]
- Działania niepożądane dotyczące naczyń mózgowych, w tym udar mózgu u pacjentów w podeszłym wieku z psychozą związaną z otępieniem [patrz OSTRZEŻENIA I ŚRODKI ]
- Złośliwy Zespół Neuroleptyczny (NMS) [patrz OSTRZEŻENIA I ŚRODKI ]
- Zmiany metaboliczne (hiperglikemia, dyslipidemia, przyrost masy ciała) [patrz OSTRZEŻENIA I ŚRODKI ]
- Późna dyskineza [patrz OSTRZEŻENIA I ŚRODKI ]
- Niedociśnienie [patrz OSTRZEŻENIA I ŚRODKI ]
- Upadki [patrz OSTRZEŻENIA I ŚRODKI ]
- Wzrost ciśnienia krwi (dzieci i młodzież) [patrz OSTRZEŻENIA I ŚRODKI ]
- Leukopenia, neutropenia i agranulocytoza [patrz OSTRZEŻENIA I ŚRODKI ]
- Zaćma [patrz OSTRZEŻENIA I ŚRODKI ]
- Wydłużenie QT [patrz OSTRZEŻENIA I ŚRODKI ]
- Napady [patrz OSTRZEŻENIA I ŚRODKI ]
- Niedoczynność tarczycy [patrz OSTRZEŻENIA I ŚRODKI ]
- Hiperprolaktynemia [patrz OSTRZEŻENIA I ŚRODKI ]
- Potencjał dla upośledzenia funkcji poznawczych i motorycznych [patrz OSTRZEŻENIA I ŚRODKI ]
- Regulacja temperatury ciała [patrz OSTRZEŻENIA I ŚRODKI ]
- Dysfagia [patrz OSTRZEŻENIA I ŚRODKI ]
- Syndrom odstawienia [patrz OSTRZEŻENIA I ŚRODKI ]
- Działanie antycholinergiczne (przeciwmuskarynowe) [patrz OSTRZEŻENIA I ŚRODKI ]
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
Dorośli ludzie
Poniższe informacje pochodzą z bazy danych badań klinicznych produktu SEROQUEL 200 mg obejmującej ponad 4300 pacjentów. Ta baza danych obejmuje 698 pacjentów narażonych na SEROQUEL w leczeniu depresji w chorobie afektywnej dwubiegunowej, 405 pacjentów narażonych na SEROQUEL 200 mg w leczeniu ostrej manii w chorobie afektywnej dwubiegunowej (monoterapia i terapia wspomagająca), 646 pacjentów narażonych na SEROQUEL w leczeniu podtrzymującym zaburzenia afektywnego dwubiegunowego typu I jako leczenie wspomagające terapii i około 2600 pacjentów i/lub normalnych osobników narażonych na 1 lub więcej dawek SEROQUEL 200 mg w leczeniu schizofrenii.
Spośród tych około 4300 pacjentów około 4000 (2300 w schizofrenii, 405 w ostrej manii w chorobie afektywnej dwubiegunowej, 698 w depresji w chorobie afektywnej dwubiegunowej i 646 w leczeniu podtrzymującym w chorobie afektywnej dwubiegunowej typu I) było pacjentami, którzy uczestniczyli w badaniach skuteczności dawek wielokrotnych, a ich doświadczenie odpowiadało około 2400 pacjentolat. Warunki i czas trwania leczenia produktem SEROQUEL 200 mg były bardzo zróżnicowane i obejmowały (w nakładających się kategoriach) fazy badań otwartej i podwójnie ślepej próby, pacjentów hospitalizowanych i ambulatoryjnych, badania ustalonej dawki i miareczkowania dawki oraz badania krótkoterminowe lub długoterminowe. narażenie. Działania niepożądane oceniano poprzez zbieranie działań niepożądanych, wyników badań fizykalnych, parametrów życiowych, masy ciała, analiz laboratoryjnych, EKG i wyników badań okulistycznych.
Podane częstości działań niepożądanych reprezentują odsetek osób, u których przynajmniej raz wystąpiło działanie niepożądane wymienionego typu.
Działania niepożądane związane z przerwaniem leczenia w krótkoterminowych badaniach kontrolowanych placebo
Schizofrenia
Ogólnie rzecz biorąc, w puli kontrolowanych badań wystąpiła niewielka różnica w częstości przerwania leczenia z powodu działań niepożądanych (4% dla produktu SEROQUEL vs. 3% dla placebo). Jednak przerwanie leczenia z powodu senności (0,8% SEROQUEL 100 mg vs 0% placebo) i niedociśnienia (0,4% SEROQUEL 200 mg vs 0% placebo) uznano za związane z przyjmowaniem leku [patrz OSTRZEŻENIA I ŚRODKI ].
Zaburzenie afektywne dwubiegunowe
Mania
Ogólnie rzecz biorąc, przerwanie leczenia z powodu działań niepożądanych wyniosło 5,7% w przypadku produktu SEROQUEL 25 mg w porównaniu z 5,1% w przypadku placebo w monoterapii i 3,6% w przypadku produktu SEROQUEL w porównaniu z 5,9% w przypadku placebo w terapii skojarzonej.
Depresja
Ogółem przerwanie leczenia z powodu działań niepożądanych wyniosło 12,3% dla produktu SEROQUEL 300 mg w porównaniu z 19,0% dla produktu SEROQUEL 600 mg i 5,2% dla placebo.
Często obserwowane działania niepożądane w krótkoterminowych badaniach kontrolowanych placebo
badaniach ostrej terapii schizofrenii (do 6 tygodni) i manii afektywnej dwubiegunowej (do 12 tygodni) najczęściej obserwowane działania niepożądane związane ze stosowaniem SEROQUEL w monoterapii (częstość występowania 5% lub więcej) i obserwowane z częstością SEROQUEL co najmniej dwa razy wyższy od placebo wykazywał senność (18%), zawroty głowy (11%), suchość w ustach (9%), zaparcia (8%), podwyższony poziom ALT (5%), przyrost masy ciała (5%) i niestrawność ( 5%).
Działania niepożądane występujące z częstością 2% lub więcej wśród pacjentów leczonych produktem SEROQUEL w krótkoterminowych badaniach kontrolowanych placebo
Lekarz przepisujący lek powinien mieć świadomość, że dane zawarte w tabelach i tabelach nie mogą być wykorzystywane do przewidywania częstości występowania działań niepożądanych w trakcie zwykłej praktyki medycznej, gdy charakterystyka pacjenta i inne czynniki różnią się od tych, które przeważały w badaniach klinicznych. Podobnie, cytowane częstotliwości nie mogą być porównywane z danymi uzyskanymi z innych badań klinicznych obejmujących różne terapie, zastosowania i badaczy. Cytowane dane dostarczają jednak lekarzowi przepisującemu pewną podstawę do oszacowania względnego udziału czynników lekowych i nielekowych w częstości występowania działań niepożądanych w badanej populacji.
Tabeli 9 wymieniono częstość występowania, zaokrągloną do najbliższego procentu, działań niepożądanych, które wystąpiły podczas ostrej terapii schizofrenii (do 6 tygodni) i manii afektywnej dwubiegunowej (do 12 tygodni) u 2% lub więcej pacjentów leczonych produktem SEROQUEL (dawki w zakresie od 75 do 800 mg/dobę), przy czym częstość występowania u pacjentów leczonych preparatem SEROQUEL była większa niż częstość występowania u pacjentów otrzymujących placebo.
W badaniach ostrej terapii skojarzonej manii w chorobie afektywnej dwubiegunowej (do 3 tygodni) najczęściej obserwowanymi działaniami niepożądanymi związanymi ze stosowaniem produktu SEROQUEL (częstość występowania 5% lub więcej) i obserwowanymi z częstością co najmniej dwukrotnie większą niż placebo były senność (34%), suchość w ustach (19%), osłabienie (10%), zaparcia (10%), ból brzucha (7%), niedociśnienie ortostatyczne (7%), zapalenie gardła (6%) i przyrost masy ciała (6 %).
tabeli 10 wymieniono częstość występowania, zaokrągloną do najbliższego procentu, działań niepożądanych, które wystąpiły podczas leczenia (do 3 tygodni) ostrej manii u 2% lub więcej pacjentów leczonych produktem SEROQUEL (dawki w zakresie od 100 do 800 mg/dobę) w leczeniu uzupełniającym litu i diwalproeksu, gdzie częstość występowania u pacjentów leczonych produktem SEROQUEL była większa niż częstość występowania u pacjentów otrzymujących placebo.
W badaniach nad depresją w przebiegu choroby afektywnej dwubiegunowej (do 8 tygodni) najczęściej obserwowanymi działaniami niepożądanymi związanymi ze stosowaniem produktu SEROQUEL (częstość występowania 5% lub więcej) i obserwowanymi z częstością co najmniej dwukrotnie większą przy stosowaniu produktu SEROQUEL 200 mg niż placebo była senność (57%). ), suchość w ustach (44%), zawroty głowy (18%), zaparcia (10%) i letarg (5%).
tabeli 11 wymieniono częstość występowania, zaokrągloną do najbliższego procentu, działań niepożądanych, które wystąpiły podczas leczenia (do 8 tygodni) depresji w przebiegu choroby afektywnej dwubiegunowej u 2% lub więcej pacjentów leczonych preparatem SEROQUEL (dawki 300 i 600 mg/dobę), gdzie częstość występowania u pacjentów leczonych produktem SEROQUEL była większa niż częstość występowania u pacjentów otrzymujących placebo.
Badania interakcji na podstawie płci, wieku i rasy nie wykazały żadnych klinicznie istotnych różnic w występowaniu działań niepożądanych na podstawie tych czynników demograficznych.
Zależność działań niepożądanych od dawki w krótkoterminowych badaniach kontrolowanych placebo
Działania niepożądane związane z dawką
Dane dotyczące spontanicznie wywołanych działań niepożądanych z badania schizofrenii porównującego pięć stałych dawek produktu SEROQUEL (75 mg, 150 mg, 300 mg, 600 mg i 750 mg/dobę) z placebo zostały zbadane pod kątem zależności działań niepożądanych od dawki. Analizy regresji logistycznej wykazały dodatnią odpowiedź na dawkę (p
Działania niepożądane w badaniach klinicznych z kwetiapiną i niewymienione w innym miejscu na etykiecie:
Podczas stosowania kwetiapiny zgłaszano również następujące działania niepożądane: koszmary senne, nadwrażliwość i zwiększenie aktywności fosfokinazy kreatynowej w surowicy (niezwiązane z NMS), mlekotok, bradykardia (które mogą wystąpić na początku leczenia lub w jego pobliżu i mogą być związane z niedociśnieniem i (lub) omdleniami). ) zmniejszenie liczby płytek krwi, somnambulizm (i inne powiązane zdarzenia), zwiększenie stężenia gamma-GT, hipotermia, duszność, eozynofilia, zatrzymanie moczu, niedrożność jelit i priapizm.
Objawy pozapiramidowe (EPS)
Dystonia
Efekt klasowy
Objawy dystonii, przedłużające się nieprawidłowe skurcze grup mięśni, mogą wystąpić u osób podatnych w ciągu pierwszych kilku dni leczenia. Objawy dystoniczne obejmują: skurcz mięśni szyi, czasami przechodzący w ucisk w gardle, trudności w połykaniu, trudności w oddychaniu i (lub) wysunięcie języka. Chociaż objawy te mogą wystąpić przy niskich dawkach, występują częściej i z większym nasileniem przy dużej sile działania i przy wyższych dawkach leków przeciwpsychotycznych pierwszej generacji. Podwyższone ryzyko ostrej dystonii obserwuje się u mężczyzn i młodszych grup wiekowych.
Do pomiaru EPS zastosowano cztery metody: (1) całkowity wynik Simpsona-Angusa (średnia zmiana od wartości wyjściowej), który ocenia parkinsonizm i akatyzję, (2) Skala oceny akatyzji Barnesa (BARS) Global Assessment Score, (3) częstość występowania spontanicznych dolegliwości EPS (akatyzja, akinezja, sztywność koła zębatego, zespół pozapiramidowy, hipertonia, hipokinezja, sztywność szyi i drżenie) oraz (4) stosowanie leków antycholinergicznych w leczeniu EPS.
Dorośli ludzie
Dane z jednego 6-tygodniowego badania klinicznego schizofrenii porównującego pięć stałych dawek SEROQUEL (75, 150, 300, 600, 750 mg/dobę) dostarczyły dowodów na brak objawów pozapiramidowych (EPS) i zależności od dawki dla EPS związanego z SEROQUEL-em Leczenie 100mg. Do pomiaru EPS zastosowano trzy metody: (1) całkowity wynik Simpsona-Angusa (średnia zmiana od wartości wyjściowej), który ocenia parkinsonizm i akatyzję, (2) częstość występowania spontanicznych skarg na EPS (akatyzja, akinezja, sztywność koła zębatego, zespół pozapiramidowy, hipertonia, hipokineza, sztywność karku i drżenie) oraz (3) stosowanie leków antycholinergicznych na EPS.
Tabeli 12 zdarzenie dystoniczne obejmowało sztywność karku, hipertonię, dystonię, sztywność mięśni, zmętnienie; parkinsonizm obejmował sztywność koła zębatego, drżenie, ślinotok, hipokinezę; akatyzja obejmowała akatyzję, pobudzenie psychoruchowe; zdarzenie dyskinetyczne obejmowało dyskinezę późną, dyskinezę, choreoatetozę; i inne zdarzenia pozapiramidowe obejmowały niepokój, zaburzenia pozapiramidowe, zaburzenia ruchu.
Częstości występowania parkinsonizmu mierzone za pomocą całkowitego wyniku Simpsona-Angusa dla placebo i pięciu stałych dawek (75, 150, 300, 600, 750 mg/dobę) wynosiły: -0,6; -1,0, -1,2; -1,6; -1,8 i -1,8. Wskaźnik stosowania leków antycholinergicznych w leczeniu EPS w przypadku placebo i pięciu stałych dawek wynosił: 14%; 11%; 10%; 8%; 12% i 11%.
sześciu dodatkowych badaniach klinicznych kontrolowanych placebo (3 w ostrej manii i 3 w schizofrenii) z zastosowaniem zmiennych dawek preparatu SEROQUEL, nie było różnic między grupami otrzymującymi preparat SEROQUEL i placebo w częstości występowania EPS, ocenianych na podstawie łącznej punktacji Simpsona-Angusa, spontaniczne skargi na EPS i jednoczesne stosowanie leków antycholinergicznych w leczeniu EPS.
W dwóch kontrolowanych placebo badaniach klinicznych dotyczących leczenia depresji afektywnej dwubiegunowej z zastosowaniem 300 mg i 600 mg SEROQUEL 100 mg, częstość występowania działań niepożądanych potencjalnie związanych z EPS wynosiła 12% w obu grupach dawkowania i 6% w grupie placebo. W badaniach tych częstość występowania poszczególnych działań niepożądanych (akatyzja, zaburzenia pozapiramidowe, drżenie, dyskineza, dystonia, niepokój, mimowolne skurcze mięśni, nadpobudliwość psychoruchowa i sztywność mięśni) była na ogół niska i nie przekraczała 4% w żadnej z leczonych grup.
Trzy grupy leczenia były podobne pod względem średniej zmiany całkowitego wyniku SAS i wyniku BARS Global Assessment pod koniec leczenia. Stosowanie jednocześnie leków antycholinergicznych było rzadkie i podobne we wszystkich trzech grupach leczenia.
Dzieci i młodzież
Poniższe informacje pochodzą z bazy danych badań klinicznych produktu SEROQUEL 200 mg obejmującej ponad 1000 pacjentów pediatrycznych. Ta baza danych obejmuje 677 pacjentów narażonych na SEROQUEL 200 mg w leczeniu schizofrenii oraz 393 dzieci i młodzież (10-17 lat) narażonych na SEROQUEL w leczeniu ostrej choroby afektywnej dwubiegunowej.
Działania niepożądane związane z przerwaniem leczenia w krótkoterminowych badaniach kontrolowanych placebo
Schizofrenia
Częstość przerwania leczenia z powodu działań niepożądanych u pacjentów leczonych kwetiapiną i placebo wynosiła odpowiednio 8,2% i 2,7%. Zdarzeniem niepożądanym prowadzącym do przerwania leczenia u 1% lub więcej pacjentów stosujących SEROQUEL i występującym częściej niż placebo była senność (2,7% i 0% w przypadku placebo).
Dwubiegunowy I Mania
Częstość przerwania leczenia z powodu działań niepożądanych u pacjentów leczonych kwetiapiną i placebo wynosiła odpowiednio 11,4% i 4,4%. Działania niepożądane prowadzące do przerwania leczenia u 2% lub więcej pacjentów stosujących SEROQUEL i występujące częściej niż w przypadku placebo to senność (4,1% w porównaniu z 1,1%) i zmęczenie (2,1% w porównaniu z 0).
Często obserwowane działania niepożądane w krótkoterminowych badaniach kontrolowanych placebo
W leczeniu schizofrenii (do 6 tygodni) najczęściej obserwowanymi działaniami niepożądanymi związanymi ze stosowaniem kwetiapiny u młodzieży (częstość występowania 5% lub większa i częstość występowania kwetiapiny co najmniej dwukrotnie większa niż w przypadku placebo) to senność (34%), zawroty głowy (12%), suchość w ustach (7%), tachykardia (7%).
terapii mania w przebiegu choroby afektywnej dwubiegunowej (do 3 tygodni) najczęściej obserwowanymi działaniami niepożądanymi związanymi ze stosowaniem kwetiapiny u dzieci i młodzieży (częstość występowania 5% lub większa i częstość występowania kwetiapiny co najmniej dwukrotnie większa niż w przypadku placebo) była senność (53%), zawroty głowy (18%), zmęczenie (11%), zwiększony apetyt (9%), nudności (8%), wymioty (8%), tachykardia (7%), suchość w ustach (7%) i zwiększenie masy ciała (6%). ).
W ostrym (8-tygodniowym) badaniu SEROQUEL 100 mg XR u dzieci i młodzieży (10-17 lat) z depresją w przebiegu choroby afektywnej dwubiegunowej, w którym nie ustalono skuteczności, najczęściej obserwowane działania niepożądane związane ze stosowaniem SEROQUEL XR (częstość występowania 5% lub więcej i co najmniej dwa razy więcej niż w przypadku placebo) to zawroty głowy 7%, biegunka 5%, zmęczenie 5% i nudności 5%.
Działania niepożądane występujące przy częstości występowania ≥ 2% wśród pacjentów leczonych produktem SEROQUEL 300 mg w krótkoterminowych badaniach kontrolowanych placebo
Schizofrenia (młodzież w wieku 13-17 lat)
Poniższe wyniki oparto na 6-tygodniowym badaniu kontrolowanym placebo, w którym kwetiapinę podawano w dawkach 400 lub 800 mg/dobę.
W tabeli 13 wymieniono częstość występowania, zaokrągloną do najbliższego procenta, działań niepożądanych, które wystąpiły podczas leczenia (do 6 tygodni) schizofrenii u 2% lub więcej pacjentów leczonych preparatem SEROQUEL (dawki 400 lub 800 mg/dobę), gdzie częstość występowania u pacjentów leczonych produktem SEROQUEL była co najmniej dwukrotnie większa niż u pacjentów otrzymujących placebo.
Działania niepożądane, które były potencjalnie związane z dawką i występowały częściej w grupie 800 mg w porównaniu z grupą 400 mg obejmowały zawroty głowy (8% wobec 15%), suchość w ustach (4% wobec 10%) i tachykardię (6% wobec 15%). 11%).
Bipolar I Mania (dzieci i młodzież w wieku 10-17 lat)
Poniższe wyniki oparto na 3-tygodniowym badaniu kontrolowanym placebo, w którym kwetiapinę podawano w dawkach 400 lub 600 mg/dobę.
Powszechnie obserwowane działania niepożądane
terapii mania w przebiegu choroby afektywnej dwubiegunowej (do 3 tygodni) najczęściej obserwowanymi działaniami niepożądanymi związanymi ze stosowaniem kwetiapiny u dzieci i młodzieży (częstość występowania 5% lub większa i częstość występowania kwetiapiny co najmniej dwukrotnie większa niż w przypadku placebo) była senność (53%), zawroty głowy (18%), zmęczenie (11%), zwiększony apetyt (9%), nudności (8%), wymioty (8%), tachykardia (7%), suchość w ustach (7%) i zwiększenie masy ciała (6%). ).
tabeli 14 wymieniono częstość występowania, zaokrągloną do najbliższego procentu, działań niepożądanych, które wystąpiły podczas leczenia (do 3 tygodni) manii afektywnej dwubiegunowej u 2% lub więcej pacjentów leczonych preparatem SEROQUEL (dawki 400 lub 600 mg/dobę), gdzie częstość występowania u pacjentów leczonych produktem SEROQUEL była większa niż częstość występowania u pacjentów otrzymujących placebo.
Działania niepożądane, które były potencjalnie związane z dawką i występowały częściej w grupie 600 mg w porównaniu z grupą 400 mg obejmowały senność (50% vs 57%), nudności (6% vs 10%) i tachykardię (6% vs. 9%).
Objawy pozapiramidowe
krótkoterminowym, kontrolowanym placebo badaniu monoterapii z udziałem nastoletnich pacjentów ze schizofrenią (6 tygodni) łączna częstość występowania objawów pozapiramidowych wyniosła 12,9% (19/147) dla produktu SEROQUEL 100 mg i 5,3% (4/75) dla placebo. chociaż częstość występowania poszczególnych działań niepożądanych (akatyzja, drżenie, zaburzenia pozapiramidowe, hipokineza, niepokój ruchowy, nadpobudliwość psychoruchowa, sztywność mięśni, dyskineza) nie przekraczała 4,1% w żadnej leczonej grupie. W krótkoterminowym kontrolowanym placebo badaniu monoterapii u dzieci i młodzieży z manią afektywną dwubiegunową (trwającą 3 tygodnie), łączna częstość występowania objawów pozapiramidowych wyniosła 3,6% (7/193) lub SEROQUEL i 1,1% (1/90) dla placebo.
W tabeli 15 przedstawiono listę pacjentów z działaniami niepożądanymi potencjalnie związanymi z objawami pozapiramidowymi w krótkoterminowym kontrolowanym placebo badaniu dotyczącym monoterapii u młodzieży ze schizofrenią (6 tygodni).
tabelach 15-16 zdarzenia dystoniczne obejmowały sztywność karku, hipertonię i sztywność mięśni; parkinsonizm obejmował sztywność i drżenie koła zębatego; akatyzja obejmowała tylko akatyzję; zdarzenie dyskinetyczne obejmowało dyskinezę późną, dyskinezę i choreoatetozę; a inne zdarzenia pozapiramidowe obejmowały niepokój i zaburzenia pozapiramidowe.
W tabeli 16 przedstawiono listę pacjentów z działaniami niepożądanymi związanymi z objawami pozapiramidowymi w krótkoterminowym kontrolowanym placebo badaniu dotyczącym monoterapii u dzieci i młodzieży z manią afektywną dwubiegunową (3 tygodnie).
Zmiany laboratoryjne, EKG i parametrów życiowych obserwowane w badaniach klinicznych
Zmiany laboratoryjne
Liczba neutrofili
Dorośli ludzie
kontrolowanych placebo badaniach klinicznych dotyczących monoterapii z udziałem 3368 pacjentów otrzymujących fumaran kwetiapiny i 1515 pacjentów otrzymujących placebo, częstość występowania co najmniej jednego wystąpienia liczby neutrofili OSTRZEŻENIA I ŚRODKI ].
Podwyższenie transaminaz
Dorośli ludzie
Zgłaszano bezobjawowe, przemijające i odwracalne zwiększenie aktywności aminotransferaz w surowicy (głównie AlAT). W badaniach dotyczących schizofrenii u dorosłych, odsetek pacjentów ze zwiększeniem aktywności aminotransferaz >3 razy przekraczającym górną granicę normalnego zakresu referencyjnego w puli trwających od 3 do 6 tygodni badań kontrolowanych placebo wynosił około 6% (29/483) dla produktu SEROQUEL w porównaniu do 1% (3/194) dla placebo. W badaniach z udziałem dorosłych pacjentów z ostrym zaburzeniem afektywnym dwubiegunowym, odsetek pacjentów ze zwiększeniem aktywności aminotransferaz >3 razy przekraczającym górną granicę normalnego zakresu referencyjnego w puli trwających od 3 do 12 tygodni badań kontrolowanych placebo wynosił około 1% dla obu produktów SEROQUEL (3 /560) i placebo (3/294). Takie podwyższenie poziomu enzymów wątrobowych zwykle występowało w ciągu pierwszych 3 tygodni leczenia lekiem i szybko powracało do poziomów sprzed badania podczas trwającego leczenia produktem SEROQUEL. W badaniach nad depresją w przebiegu choroby afektywnej dwubiegunowej odsetek pacjentów ze zwiększeniem aktywności aminotransferaz >3 razy przekraczającym górną granicę normalnego zakresu referencyjnego w dwóch 8-tygodniowych badaniach kontrolowanych placebo wynosił 1% (5/698) dla produktu SEROQUEL 50 mg i 2% (6/ 347) dla placebo.
Zmniejszona hemoglobina
Dorośli ludzie
W krótkotrwałych badaniach kontrolowanych placebo, zmniejszenie stężenia hemoglobiny do ≤13 g/dl u mężczyzn, ≤12 g/dl u kobiet przynajmniej raz wystąpiło u 8,3% (594/7155) pacjentów leczonych kwetiapiną w porównaniu z 6,2% ( 219/3536) pacjentów leczonych placebo. W bazie danych kontrolowanych i niekontrolowanych badań klinicznych, zmniejszenie stężenia hemoglobiny do ≤13 g/dl u mężczyzn, ≤12 g/dl u kobiet co najmniej raz wystąpiło u 11% (2277/20729) pacjentów leczonych kwetiapiną.
Zakłócenia w badaniach moczu na narkotyki
Istnieją doniesienia literaturowe sugerujące fałszywie dodatnie wyniki testów immunoenzymatycznych na obecność metadonu i trójpierścieniowych leków przeciwdepresyjnych w moczu u pacjentów przyjmujących kwetiapinę. Należy zachować ostrożność przy interpretacji dodatnich wyników badań przesiewowych moczu na obecność tych leków i rozważyć potwierdzenie alternatywną techniką analityczną (np. metodą chromatograficzną).
Zmiany EKG
Dorośli ludzie
Porównania między grupami dla zbiorczych badań kontrolowanych placebo nie wykazały statystycznie istotnych różnic SEROQUEL/placebo w odsetku pacjentów, u których wystąpiły potencjalnie istotne zmiany parametrów EKG, w tym odstępów QT, QTc i PR. Jednak odsetek pacjentów spełniających kryteria tachykardii porównano w czterech trwających od 3 do 6 tygodni kontrolowanych placebo badaniach klinicznych dotyczących leczenia schizofrenii, które wykazały 1% (4/399) częstość występowania dla produktu SEROQUEL 100 mg w porównaniu do 0,6% (1 /156) częstość występowania dla placebo. W badaniach klinicznych dotyczących ostrej (monoterapii) maniaków afektywnych dwubiegunowych odsetek pacjentów spełniających kryteria tachykardii wynosił 0,5% (1/192) dla produktu SEROQUEL 200 mg w porównaniu z częstością 0% (0/178) dla placebo. W badaniach klinicznych z ostrą manią afektywną dwubiegunową (wspomaganą) odsetek pacjentów spełniających te same kryteria wynosił 0,6% (1/166) dla produktu SEROQUEL 100 mg w porównaniu z częstością 0% (0/171) dla placebo. W badaniach nad depresją w przebiegu choroby afektywnej dwubiegunowej u żadnego pacjenta nie wystąpił wzrost częstości akcji serca do >120 uderzeń na minutę. Stosowanie preparatu SEROQUEL 50 mg wiązało się ze średnim wzrostem częstości akcji serca, ocenianym za pomocą EKG, o 7 uderzeń na minutę w porównaniu ze średnim wzrostem o 1 uderzenie na minutę wśród pacjentów otrzymujących placebo. Ta niewielka tendencja do tachykardii u dorosłych może być związana z potencjałem SEROQUEL do wywoływania zmian ortostatycznych [patrz OSTRZEŻENIA I ŚRODKI ].
Dzieci i młodzież
W badaniu dotyczącym ostrej (6-tygodniowej) schizofrenii u młodzieży, zwiększenie częstości akcji serca (>110 uderzeń na minutę) wystąpiło u 5,2% (3/73) pacjentów otrzymujących SEROQUEL 400 mg i 8,5% (5/74) pacjentów otrzymujących SEROQUEL 800 mg w porównaniu do 0% (0/75) pacjentów otrzymujących placebo. Średni wzrost częstości akcji serca wynosił odpowiednio 3,8 bpm i 11,2 bpm w grupach SEROQUEL 400 mg i 800 mg, w porównaniu ze spadkiem o 3,3 bpm w grupie placebo [patrz OSTRZEŻENIA I ŚRODKI ].
W ostrym (3-tygodniowym) badaniu maniaków dwubiegunowych u dzieci i młodzieży zwiększenie częstości akcji serca (>110 uderzeń na minutę) wystąpiło u 1,1% (1/89) pacjentów otrzymujących SEROQUEL 400 mg i 4,7% (4/85) pacjentów otrzymujących SEROQUEL 600 mg w porównaniu z 0% (0/98) pacjentów otrzymujących placebo. Średni wzrost częstości akcji serca wyniósł odpowiednio 12,8 uderzeń na minutę i 13,4 uderzeń na minutę w grupie SEROQUEL 400 mg i 600 mg, w porównaniu ze spadkiem o 1,7 uderzeń na minutę w grupie placebo [patrz OSTRZEŻENIA I ŚRODKI ].
ostrym (8-tygodniowym) badaniu SEROQUEL XR u dzieci i młodzieży (10-17 lat) z depresją w przebiegu choroby afektywnej dwubiegunowej, w którym nie ustalono skuteczności, zaobserwowano wzrost częstości akcji serca (>110 uderzeń/min 10-12 lat i 13-17 lat). lat) wystąpiło u 0% pacjentów otrzymujących SEROQUEL XR i 1,2% pacjentów otrzymujących placebo. Średni wzrost częstości akcji serca wyniósł 3,4 bpm dla produktu SEROQUEL XR w porównaniu do 0,3 bpm w grupie placebo [patrz OSTRZEŻENIA I ŚRODKI ].
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane po zatwierdzeniu produktu SEROQUEL. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek.
Działania niepożądane zgłaszane od momentu wprowadzenia na rynek, które były czasowo związane z leczeniem kwetiapiną, obejmują reakcję anafilaktyczną, kardiomiopatię, reakcję polekową z eozynofilią i objawami ogólnoustrojowymi (DRESS), hiponatremię, zapalenie mięśnia sercowego, moczenie nocne, zapalenie trzustki, amnezję wsteczną, rabdomiolizę, zespół nieprawidłowego wydzielania hormonu antydiuretycznego (SIADH), zespół Stevensa-Johnsona (SJS), toksyczna nekroliza naskórka (TEN), zmniejszona liczba płytek krwi, ciężkie reakcje wątroby (w tym zapalenie wątroby, martwica wątroby i niewydolność wątroby), agranulocytoza, niedrożność jelit, niedokrwienie okrężnicy, zatrzymanie moczu , bezdech senny i ostra uogólniona osutka krostkowa (AGEP).
INTERAKCJE Z LEKAMI
Wpływ innych leków na kwetiapinę
Ryzyko związane ze stosowaniem produktu SEROQUEL w połączeniu z innymi lekami nie zostało szczegółowo ocenione w badaniach systematycznych. Biorąc pod uwagę podstawowe działanie produktu SEROQUEL na ośrodkowy układ nerwowy, należy zachować ostrożność podczas stosowania go w skojarzeniu z innymi lekami działającymi ośrodkowo. SEROQUEL 300 mg nasilił poznawcze i motoryczne działanie alkoholu w badaniu klinicznym u osób z wybranymi zaburzeniami psychotycznymi, a spożywanie kwetiapiny powinno być ograniczone.
Ekspozycja na kwetiapinę jest zwiększana przez prototypowe inhibitory CYP3A4 (np. ketokonazol, itrakonazol, indynawir, rytonawir, nefazodon itp.) i zmniejszana przez prototypowe induktory CYP3A4 (np. fenytoina, karbamazepina, ryfampicyna, awasimib itp.) ziele dziurawca . Konieczne będzie dostosowanie dawki kwetiapiny, jeśli jest ona podawana z silnymi induktorami lub inhibitorami CYP3A4.
Inhibitory CYP3A4
Jednoczesne podawanie ketokonazolu, silnego inhibitora cytochromu CYP3A4, powodowało znaczne zwiększenie ekspozycji na kwetiapinę. Dawkę preparatu SEROQUEL 200 mg należy zmniejszyć do jednej szóstej dawki pierwotnej, jeśli jest podawany jednocześnie z silnym inhibitorem CYP3A4 [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ].
Induktory CYP3A4
Jednoczesne podawanie kwetiapiny i fenytoiny, induktora CYP3A4, pięciokrotnie zwiększało średni klirens kwetiapiny po podaniu doustnym. W celu utrzymania kontroli objawów schizofrenii u pacjentów otrzymujących kwetiapinę i fenytoinę lub inne znane silne induktory CYP3A4 może być konieczne zwiększenie dawki produktu SEROQUEL 50 mg do 5 razy [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ]. Po odstawieniu induktora CYP3A4 dawkę SEROQUEL 25 mg należy zmniejszyć do pierwotnego poziomu w ciągu 7-14 dni [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Zbadano potencjalny wpływ kilku stosowanych jednocześnie leków na farmakokinetykę kwetiapiny [patrz FARMAKOLOGIA KLINICZNA ].
Wpływ kwetiapiny na inne leki
Ze względu na możliwość wywoływania niedociśnienia, SEROQUEL 50 mg może nasilać działanie niektórych leków przeciwnadciśnieniowych.
SEROQUEL 25mg może antagonizować działanie lewodopy i agonistów dopaminy.
Nie ma klinicznie istotnych interakcji farmakokinetycznych produktu Seroquel z innymi lekami opartymi na szlaku CYP. Seroquel 50 mg i jego metabolity nie są inhibitorami głównych metabolizujących CYP (1A2, 2C9, 2C19, 2D6 i 3A4).
Nadużywanie i uzależnienie od narkotyków
Substancja kontrolowana
SEROQUEL nie jest substancją kontrolowaną.
Nadużywać
SEROQUEL nie był systematycznie badany na zwierzętach i ludziach pod kątem możliwości nadużywania, tolerancji lub uzależnienia fizycznego. Chociaż badania kliniczne nie wykazały żadnej tendencji do jakichkolwiek zachowań związanych z poszukiwaniem leku, obserwacje te nie były systematyczne i na podstawie tego ograniczonego doświadczenia nie można przewidzieć, w jakim stopniu lek działający na OUN będzie niewłaściwie stosowany, przekierowywany, i/lub nadużywane po wprowadzeniu do obrotu. W związku z tym pacjentów należy dokładnie zbadać pod kątem historii nadużywania leków i takich pacjentów należy uważnie obserwować pod kątem oznak niewłaściwego stosowania lub nadużywania produktu SEROQUEL, np. rozwoju tolerancji, zwiększania dawki, zachowań związanych z poszukiwaniem leku.
OSTRZEŻENIA
Zawarte jako część "ŚRODKI OSTROŻNOŚCI" Sekcja
ŚRODKI OSTROŻNOŚCI
Zwiększona śmiertelność u starszych pacjentów z psychozą związaną z demencją
Pacjenci w podeszłym wieku z psychozą otępienną leczeni lekami przeciwpsychotycznymi są narażeni na zwiększone ryzyko zgonu. Analiza 17 badań kontrolowanych placebo (modalny czas trwania 10 tygodni), głównie z udziałem pacjentów przyjmujących atypowe leki przeciwpsychotyczne, wykazała, że ryzyko zgonu u pacjentów leczonych lekami jest od 1,6 do 1,7 razy większe niż ryzyko zgonu u pacjentów otrzymujących placebo. W trakcie typowego 10-tygodniowego kontrolowanego badania wskaźnik zgonów u pacjentów leczonych lekiem wynosił około 4,5%, w porównaniu do około 2,6% w grupie placebo. Chociaż przyczyny zgonów były różne, większość zgonów wydawała się mieć charakter sercowo-naczyniowy (np. niewydolność serca, nagła śmierć) lub zakaźny (np. zapalenie płuc). Badania obserwacyjne sugerują, że podobnie jak w przypadku atypowych leków przeciwpsychotycznych, leczenie konwencjonalnymi lekami przeciwpsychotycznymi może zwiększać śmiertelność. Nie jest jasne, w jakim stopniu wyniki zwiększonej śmiertelności w badaniach obserwacyjnych można przypisać lekowi przeciwpsychotycznemu w przeciwieństwie do niektórych cech pacjentów. SEROQUEL nie jest zatwierdzony do leczenia pacjentów z psychozą związaną z otępieniem [patrz OSTRZEŻENIE W PUDEŁKU ].
Myśli i zachowania samobójcze u nastolatków i młodych dorosłych
Pacjenci z ciężkimi zaburzeniami depresyjnymi (MDD), zarówno dorośli, jak i pediatryczni, mogą doświadczać nasilenia depresji i/lub pojawienia się myśli i zachowań samobójczych (samobójstwa) lub nietypowych zmian w zachowaniu, niezależnie od tego, czy przyjmują leki przeciwdepresyjne, a to ryzyko może utrzymywać się aż do wystąpienia znacznej remisji. Samobójstwo jest znanym ryzykiem depresji i niektórych innych zaburzeń psychicznych, a same te zaburzenia są najsilniejszymi predyktorami samobójstwa. Od dawna istnieje jednak obawa, że leki przeciwdepresyjne mogą odgrywać rolę w wywoływaniu nasilenia depresji i pojawianiu się myśli samobójczych u niektórych pacjentów we wczesnych fazach leczenia. Zbiorcze analizy krótkoterminowych kontrolowanych placebo badań leków przeciwdepresyjnych (SSRI i inne) wykazały, że leki te zwiększają ryzyko myśli i zachowań samobójczych (samobójstwa) u dzieci, młodzieży i młodych dorosłych (w wieku 18-24 lat) z ciężką depresją zaburzenia (MDD) i inne zaburzenia psychiczne. Badania krótkoterminowe nie wykazały wzrostu ryzyka samobójstw w przypadku stosowania leków przeciwdepresyjnych w porównaniu z placebo u osób dorosłych w wieku powyżej 24 lat; u osób dorosłych w wieku 65 lat i starszych odnotowano zmniejszenie liczby przyjmowanych leków przeciwdepresyjnych w porównaniu z placebo.
Zbiorcze analizy badań kontrolowanych placebo u dzieci i młodzieży z MDD, zaburzeniami obsesyjno-kompulsywnymi (OCD) lub innymi zaburzeniami psychicznymi obejmowały łącznie 24 krótkoterminowe badania 9 leków przeciwdepresyjnych z udziałem ponad 4400 pacjentów. Zbiorcze analizy badań kontrolowanych placebo u dorosłych z MDD lub innymi zaburzeniami psychicznymi obejmowały łącznie 295 krótkoterminowych badań (mediana czasu trwania wynosząca 2 miesiące) 11 leków przeciwdepresyjnych z udziałem ponad 77 000 pacjentów. Istniało znaczne zróżnicowanie ryzyka samobójstwa wśród leków, ale tendencja do wzrostu u młodszych pacjentów w przypadku prawie wszystkich badanych leków. Istniały różnice w bezwzględnym ryzyku samobójstwa w różnych wskazaniach, z największą częstością występowania MDD. Różnice ryzyka (lek vs placebo) były jednak stosunkowo stabilne w obrębie warstw wiekowych i we wskazaniach. Te różnice w ryzyku (różnica między lekami a placebo w liczbie przypadków samobójstw na 1000 leczonych pacjentów) przedstawiono w Tabeli 2.
żadnym z badań pediatrycznych nie doszło do samobójstw. W badaniach z udziałem dorosłych zdarzały się samobójstwa, ale liczba ta nie była wystarczająca, aby wyciągnąć jakiekolwiek wnioski na temat wpływu leku na samobójstwo.
Nie wiadomo, czy ryzyko samobójstwa rozciąga się na długotrwałe używanie, tj. dłużej niż kilka miesięcy. Jednak istnieją dowody z kontrolowanych placebo badań podtrzymujących u dorosłych z depresją, że stosowanie leków przeciwdepresyjnych może opóźnić nawrót depresji.
Wszyscy pacjenci leczeni lekami przeciwdepresyjnymi w jakimkolwiek wskazaniu powinni być odpowiednio monitorowani i obserwowani pod kątem pogorszenia stanu klinicznego, skłonności samobójczych i nietypowych zmian w zachowaniu, szczególnie w ciągu pierwszych kilku miesięcy terapii lekowej lub w czasie zmiany dawki, albo zwiększa się lub maleje.
Następujące objawy: lęk, pobudzenie, ataki paniki, bezsenność, drażliwość, wrogość, agresywność, impulsywność, akatyzję (niepokój psychoruchowy), hipomanię i manię zgłaszano również u dorosłych i dzieci leczonych lekami przeciwdepresyjnymi z powodu dużych zaburzeń depresyjnych. co do innych wskazań, zarówno psychiatrycznych, jak i niepsychiatrycznych. Chociaż nie ustalono związku przyczynowo-skutkowego między pojawieniem się takich objawów a nasileniem depresji i/lub pojawieniem się impulsów samobójczych, istnieje obawa, że takie objawy mogą być prekursorem pojawiania się samobójstw.
Należy rozważyć zmianę schematu leczenia, w tym ewentualnie odstawienie leku, u pacjentów, u których depresja jest stale nasilona lub u których pojawiają się myśli samobójcze lub objawy, które mogą być prekursorami nasilenia depresji lub myśli samobójczych, zwłaszcza jeśli objawy te są ciężkie, nagłe na początku lub nie były częścią objawów prezentowanych przez pacjenta.
Rodziny i opiekunowie pacjentów leczonych lekami przeciwdepresyjnymi z powodu zaburzeń depresyjnych lub innych wskazań, zarówno psychiatrycznych, jak i niepsychiatrycznych, powinni być ostrzeżeni o konieczności monitorowania pacjentów pod kątem pojawienia się pobudzenia, drażliwości, nietypowych zmian w zachowaniu i innych objawów opisanych powyżej, a także pojawienia się samobójstw i natychmiastowego zgłaszania takich objawów świadczeniodawcom. Taki monitoring powinien obejmować codzienną obserwację rodzin i opiekunów. Recepty na SEROQUEL należy wypisać na najmniejszą ilość tabletek, zgodnie z dobrym postępowaniem z pacjentem, aby zmniejszyć ryzyko przedawkowania.
Badanie przesiewowe pacjentów pod kątem choroby afektywnej dwubiegunowej
Poważny epizod depresyjny może być początkowym objawem choroby afektywnej dwubiegunowej. Powszechnie uważa się (chociaż nie zostało to potwierdzone w badaniach kontrolowanych), że leczenie takiego epizodu samym lekiem przeciwdepresyjnym może zwiększyć prawdopodobieństwo wystąpienia epizodu mieszanego/maniakalnego u pacjentów z ryzykiem choroby afektywnej dwubiegunowej. Nie wiadomo, czy którykolwiek z objawów opisanych powyżej reprezentuje taką konwersję. Jednak przed rozpoczęciem leczenia lekami przeciwdepresyjnymi, w tym produktem SEROQUEL, pacjenci z objawami depresji powinni zostać odpowiednio przebadani w celu ustalenia, czy są oni narażeni na wystąpienie choroby afektywnej dwubiegunowej; takie badania przesiewowe powinny obejmować szczegółowy wywiad psychiatryczny, w tym wywiad rodzinny dotyczący samobójstw, choroby afektywnej dwubiegunowej i depresji.
Działania niepożądane naczyniowo-mózgowe, w tym udar, u pacjentów w podeszłym wieku z psychozą związaną z otępieniem
W kontrolowanych placebo badaniach z zastosowaniem rysperydonu, arypiprazolu i olanzapiny u osób w podeszłym wieku z otępieniem stwierdzono większą częstość występowania działań niepożądanych ze strony naczyń mózgowych (incydentów naczyniowo-mózgowych i przemijających ataków niedokrwiennych), w tym zgonów, w porównaniu z pacjentami otrzymującymi placebo. SEROQUEL nie jest zatwierdzony do leczenia pacjentów z psychozą związaną z otępieniem [patrz także OSTRZEŻENIE W PUDEŁKU oraz Zwiększona śmiertelność u starszych pacjentów z psychozą związaną z demencją ].
Złośliwy Zespół Neuroleptyczny (NMS)
Potencjalnie śmiertelny zespół objawów, czasami określany jako złośliwy zespół neuroleptyczny (NMS), zgłaszano w związku z podawaniem leków przeciwpsychotycznych, w tym produktu SEROQUEL. Rzadkie przypadki NMS były zgłaszane podczas stosowania produktu SEROQUEL. Objawy kliniczne NMS to hiperpyreksja, sztywność mięśni, zmieniony stan psychiczny i dowody niestabilności autonomicznej (nieregularne tętno lub ciśnienie krwi, tachykardia, pocenie się i arytmia serca). Dodatkowe objawy mogą obejmować podwyższoną aktywność fosfokinazy kreatynowej, mioglobinurię (rabdomiolizę) i ostrą niewydolność nerek.
Diagnostyczna ocena pacjentów z tym zespołem jest skomplikowana. Przy ustalaniu diagnozy ważne jest, aby wykluczyć przypadki, w których obraz kliniczny obejmuje zarówno poważną chorobę medyczną (np. zapalenie płuc, zakażenie ogólnoustrojowe, itp.), jak i nieleczone lub niewłaściwie leczone objawy pozapiramidowe (EPS). Inne ważne czynniki w diagnostyce różnicowej obejmują ośrodkową toksyczność antycholinergiczną, udar cieplny, gorączkę polekową i pierwotną patologię ośrodkowego układu nerwowego (OUN).
Postępowanie w NMS powinno obejmować: 1) natychmiastowe odstawienie leków przeciwpsychotycznych i innych leków, które nie są niezbędne do jednoczesnego leczenia; 2) intensywne leczenie objawowe i monitoring medyczny; oraz 3) leczenie wszelkich współistniejących poważnych problemów medycznych, dla których dostępne są określone metody leczenia. Nie ma ogólnej zgody co do konkretnych schematów leczenia farmakologicznego NMS.
Jeśli pacjent wymaga leczenia przeciwpsychotycznego po wyzdrowieniu z NMS, należy dokładnie rozważyć możliwość ponownego włączenia terapii lekowej. Pacjenta należy uważnie monitorować, ponieważ zgłaszano nawroty NMS.
Zmiany metaboliczne
Atypowe leki przeciwpsychotyczne powiązano ze zmianami metabolicznymi, które obejmują hiperglikemię/cukrzycę, dyslipidemię i przyrost masy ciała. Chociaż wykazano, że wszystkie leki z tej klasy powodują pewne zmiany metaboliczne, każdy lek ma swój własny profil ryzyka. U niektórych pacjentów w badaniach klinicznych zaobserwowano pogorszenie więcej niż jednego z parametrów metabolicznych, takich jak masa ciała, stężenie glukozy we krwi i stężenie lipidów. Zmiany tych profili metabolicznych należy kontrolować w sposób klinicznie uzasadniony.
Hiperglikemia i cukrzyca
pacjentów leczonych atypowymi lekami przeciwpsychotycznymi, w tym kwetiapiną, zgłaszano hiperglikemię, w niektórych przypadkach skrajną i związaną z kwasicą ketonową, śpiączką hiperosmolarną lub zgonem. Ocenę związku między stosowaniem atypowych leków przeciwpsychotycznych a nieprawidłowościami glikemii komplikuje możliwość zwiększonego podstawowego ryzyka cukrzycy u pacjentów ze schizofrenią oraz wzrastająca częstość występowania cukrzycy w populacji ogólnej. Biorąc pod uwagę te czynniki, związek między stosowaniem atypowych leków przeciwpsychotycznych a działaniami niepożądanymi związanymi z hiperglikemią nie jest w pełni zrozumiały. Jednak badania epidemiologiczne sugerują zwiększone ryzyko działań niepożądanych związanych z hiperglikemią u pacjentów leczonych atypowymi lekami przeciwpsychotycznymi. Dokładne szacunki ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią u pacjentów leczonych atypowymi lekami przeciwpsychotycznymi nie są dostępne.
Pacjenci z ustalonym rozpoznaniem cukrzycy, którzy rozpoczynają leczenie atypowymi lekami przeciwpsychotycznymi, powinni być regularnie monitorowani pod kątem pogorszenia kontroli glikemii. U pacjentów z czynnikami ryzyka cukrzycy (np. otyłość, cukrzyca w wywiadzie rodzinnym), którzy rozpoczynają leczenie atypowymi lekami przeciwpsychotycznymi, należy wykonać badanie stężenia glukozy we krwi na czczo na początku leczenia oraz okresowo w trakcie leczenia. Każdy pacjent leczony atypowymi lekami przeciwpsychotycznymi powinien być monitorowany pod kątem objawów hiperglikemii, w tym polidypsji, wielomoczu, polifagii i osłabienia. U pacjentów, u których podczas leczenia atypowymi lekami przeciwpsychotycznymi wystąpią objawy hiperglikemii, należy wykonać badanie stężenia glukozy we krwi na czczo. W niektórych przypadkach hiperglikemia ustąpiła po odstawieniu atypowego leku przeciwpsychotycznego; jednak niektórzy pacjenci wymagali kontynuacji leczenia przeciwcukrzycowego pomimo odstawienia podejrzanego leku.
Dorośli ludzie
24-tygodniowym badaniu (aktywnie kontrolowanym 115 pacjentów leczonych preparatem SEROQUEL) zaprojektowanym w celu oceny stanu glikemii z doustnym badaniem tolerancji glukozy u wszystkich pacjentów, w 24. tygodniu częstość występowania po prowokacji glukozą stężenia glukozy ≥200 mg/dl wynosiła 1,7%, a częstość występowania glikemii na czczo ≥126 mg/dl wynosiła 2,6%. Średnia zmiana stężenia glukozy na czczo od wartości wyjściowej wyniosła 3,2 mg/dl, a średnia zmiana stężenia glukozy po 2 godzinach od wartości wyjściowej wyniosła -1,8 mg/dl dla kwetiapiny.
2 długoterminowych, randomizowanych badaniach klinicznych z odstawieniem placebo, kontrolowanych placebo w celu podtrzymania choroby afektywnej dwubiegunowej typu I, średnia ekspozycja 213 dni dla produktu SEROQUEL (646 pacjentów) i 152 dni dla placebo (680 pacjentów), średnia zmiana stężenia glukozy w stosunku do wartości wyjściowej wyniosła +5,0 mg /dl dla SEROQUEL 100 mg i –0,05 mg/dl dla placebo. Skorygowany na podstawie ekspozycji wskaźnik każdego podwyższonego poziomu glukozy we krwi (≥126 mg/dl) u pacjentów ponad 8 godzin od posiłku (jednak niektórzy pacjenci mogli nie być wykluczeni z przyjmowania kalorii z płynów w okresie na czczo) wynosił 18,0 na 100 pacjentolat dla produktu SEROQUEL (10,7% pacjentów; n=556) i 9,5 dla placebo na 100 pacjento-lat (4,6% pacjentów; n=581).
Dzieci i młodzież
kontrolowanym placebo badaniu SEROQUEL 25 mg w monoterapii z udziałem młodzieży (13-17 lat) ze schizofrenią (czas trwania 6 tygodni), średnia zmiana stężenia glukozy na czczo dla produktu SEROQUEL (n=138) w porównaniu z placebo (n=67) wynosił – 0,75 mg/dl w porównaniu z –1,70 mg/dl. W kontrolowanym placebo badaniu SEROQUEL 300 mg w monoterapii u dzieci i młodzieży (10-17 lat) z manią afektywną dwubiegunową (3 tygodnie) średnia zmiana stężenia glukozy na czczo dla produktu SEROQUEL (n=170) w porównaniu z placebo (n =81) wynosiła 3,62 mg/dl w porównaniu z –1,17 mg/dl. Żaden pacjent w żadnym z badań z wyjściowym prawidłowym stężeniem glukozy na czczo (
kontrolowanym placebo badaniu SEROQUEL XR w monoterapii (8 tygodni) u dzieci i młodzieży (1017 lat) z depresją w przebiegu choroby afektywnej dwubiegunowej, w którym nie ustalono skuteczności, średnia zmiana stężenia glukozy na czczo dla produktu SEROQUEL 300 mg XR (n= 60) w porównaniu z placebo (n=62) wyniosło 1,8 mg/dl w porównaniu z 1,6 mg/dl. W tym badaniu nie było pacjentów w grupach otrzymujących SEROQUEL XR lub placebo z wyjściowym prawidłowym poziomem glukozy na czczo (126 mg/dl. W grupie leczonej produktem SEROQUEL 25 mg XR wystąpił jeden pacjent z wyjściowym granicznym poziomem glukozy na czczo (>100 mg/dl i 126 mg/dl w porównaniu z 0 pacjentów w grupa placebo.
Dyslipidemia
Dorośli ludzie
Tabela 4 przedstawia odsetek dorosłych pacjentów ze zmianami w całkowitym cholesterolu, triglicerydach, cholesterolu LDL i HDL-cholesterolu w stosunku do wartości wyjściowych według wskazań w badaniach klinicznych produktu SEROQUEL.
Dzieci i młodzież
Tabela 5 przedstawia odsetek dzieci i młodzieży ze zmianami w całkowitym cholesterolu, triglicerydach, LDL-cholesterolu i HDL-cholesterolu w stosunku do wartości wyjściowych w badaniach klinicznych produktu SEROQUEL.
W kontrolowanym placebo badaniu SEROQUEL XR w monoterapii (8 tygodni) z udziałem dzieci i młodzieży (1017 lat) z depresją w przebiegu choroby afektywnej dwubiegunowej, w którym nie ustalono skuteczności, odsetek dzieci i młodzieży ze zmianami stężenia cholesterolu całkowitego (≥200 mg/dl), triglicerydy (≥150 mg/dl), cholesterol LDL (≥ 130 mg/dl) i cholesterol HDL (≤40 mg/dl) od wartości wyjściowych do poziomów istotnych klinicznie wynosiły: cholesterol całkowity 8% (7 /83) dla SEROQUEL 50mg XR vs. 6% (5/84) dla placebo; triglicerydy 28% (22/80) dla SEROQUEL 100 mg XR vs. 9% (7/82) dla placebo; Cholesterol LDL 2% (2/86) dla SEROQUEL XR vs. 4% (3/85) dla placebo i cholesterol HDL 20% (13/65) dla SEROQUEL XR vs. 15% (11/74) dla placebo.
Przybranie na wadze
badaniach klinicznych zaobserwowano zwiększenie masy ciała. Pacjenci otrzymujący kwetiapinę powinni regularnie kontrolować masę ciała.
Dorośli ludzie
W badaniach klinicznych produktu SEROQUEL 50 mg zgłaszano następujące przypadki zwiększenia masy ciała.
Dzieci i młodzież
W dwóch badaniach klinicznych z preparatem SEROQUEL 25 mg, jednym w chorobie afektywnej dwubiegunowej i jednym w schizofrenii, zgłoszone zwiększenie masy ciała przedstawiono w Tabeli 7.
Średnia zmiana masy ciała w badaniu schizofrenii wyniosła 2,0 kg w grupie SEROQUEL 25 mg i -0,4 kg w grupie placebo, a w badaniu mania afektywna dwubiegunowa 1,7 kg w grupie SEROQUEL 200 mg i 0,4 kg w grupie placebo.
otwartym badaniu, do którego włączono pacjentów z powyższych dwóch badań pediatrycznych, 63% pacjentów (241/380) ukończyło 26-tygodniowe leczenie produktem SEROQUEL. Po 26 tygodniach leczenia średni wzrost masy ciała wyniósł 4,4 kg. Czterdzieści pięć procent pacjentów przybrało ≥7% masy ciała, nieskorygowanej na normalny wzrost. W celu dostosowania do normalnego wzrostu w ciągu 26 tygodni, jako miarę klinicznie istotnej zmiany zastosowano wzrost BMI o co najmniej 0,5 odchylenia standardowego od wartości wyjściowej; 18,3% pacjentów przyjmujących SEROQUEL spełniło to kryterium po 26 tygodniach leczenia.
W badaniu klinicznym produktu SEROQUEL XR u dzieci i młodzieży (10-17 lat) z depresją w przebiegu choroby afektywnej dwubiegunowej, w którym nie ustalono skuteczności, odsetek pacjentów z przyrostem masy ciała ≥7% w dowolnym momencie wyniósł 15% ( 14/92) dla SEROQUEL 25mg XR vs. 10% (10/100) dla placebo. Średnia zmiana masy ciała wyniosła 1,4 kg w grupie SEROQUEL 50mg XR vs. 0,6 kg w grupie placebo.
Podczas leczenia pacjentów pediatrycznych produktem SEROQUEL 50 mg w jakimkolwiek wskazaniu, przyrost masy ciała należy oceniać w stosunku do oczekiwanego dla normalnego wzrostu.
Późne dyskinezy
U pacjentów leczonych lekami przeciwpsychotycznymi, w tym kwetiapiną, może rozwinąć się zespół potencjalnie nieodwracalnych, mimowolnych ruchów dyskinetycznych. Chociaż częstość występowania zespołu wydaje się być najwyższa wśród osób starszych, zwłaszcza starszych kobiet, nie można polegać na szacunkach częstości występowania, aby przewidzieć na początku leczenia przeciwpsychotycznego, u których pacjentów prawdopodobnie rozwinie się zespół. Nie wiadomo, czy produkty leków przeciwpsychotycznych różnią się potencjałem wywoływania późnych dyskinez.
Uważa się, że wraz ze wzrostem czasu trwania leczenia i całkowitej skumulowanej dawki leków przeciwpsychotycznych podawanych pacjentowi wzrasta ryzyko wystąpienia dyskinezy późnej i prawdopodobieństwo, że stanie się ona nieodwracalna. Zespół ten może jednak rozwinąć się, chociaż znacznie rzadziej, po stosunkowo krótkich okresach leczenia małymi dawkami lub nawet po przerwaniu leczenia.
Późne dyskinezy mogą ustąpić, częściowo lub całkowicie, jeśli leczenie przeciwpsychotyczne zostanie przerwane. Jednak samo leczenie przeciwpsychotyczne może tłumić (lub częściowo tłumić) oznaki i objawy zespołu, a tym samym może maskować leżący u podstaw proces. Wpływ supresji objawowej na długotrwały przebieg zespołu jest nieznany.
Biorąc pod uwagę powyższe rozważania, SEROQUEL 50 mg należy przepisywać w sposób, który najprawdopodobniej zminimalizuje występowanie późnych dyskinez. Przewlekłe leczenie przeciwpsychotyczne powinno być ogólnie zarezerwowane dla pacjentów, którzy wydają się cierpieć na przewlekłą chorobę, na którą (1) wiadomo, że reaguje na leki przeciwpsychotyczne, oraz (2) dla których alternatywne, równie skuteczne, ale potencjalnie mniej szkodliwe terapie nie są dostępne lub odpowiednie . U pacjentów, którzy wymagają przewlekłego leczenia, należy dążyć do jak najmniejszej dawki i najkrótszego czasu trwania leczenia dającego zadowalającą odpowiedź kliniczną. Konieczność kontynuacji leczenia powinna być okresowo oceniana.

Jeśli u pacjenta przyjmującego SEROQUEL 200 mg pojawią się objawy przedmiotowe i podmiotowe późnych dyskinez, należy rozważyć odstawienie leku. Jednak niektórzy pacjenci mogą wymagać leczenia SEROQUEL 200 mg pomimo obecności zespołu.
Niedociśnienie
Kwetiapina może wywoływać hipotonię ortostatyczną związaną z zawrotami głowy, tachykardią i, u niektórych pacjentów, omdleniem, zwłaszcza w początkowym okresie miareczkowania dawki, prawdopodobnie odzwierciedlając jej właściwości antagonisty receptorów α1-adrenergicznych. Omdlenie zgłoszono u 1% (28/3265) pacjentów leczonych produktem SEROQUEL, w porównaniu z 0,2% (2/954) w grupie placebo i około 0,4% (2/527) w grupie aktywnej kontroli. Niedociśnienie ortostatyczne, zawroty głowy i omdlenia mogą prowadzić do upadków.
SEROQUEL 25 mg należy stosować ze szczególną ostrożnością u pacjentów z rozpoznaną chorobą układu krążenia (zawał mięśnia sercowego lub choroba niedokrwienna serca w wywiadzie, niewydolność serca lub zaburzenia przewodzenia), chorobami naczyń mózgowych lub stanami predysponującymi pacjentów do niedociśnienia (odwodnienie, hipowolemia i leczenie leki przeciwnadciśnieniowe). Ryzyko niedociśnienia ortostatycznego i omdleń można zminimalizować, ograniczając dawkę początkową do 25 mg dwa razy na dobę [patrz DAWKOWANIE I SPOSÓB PODAWANIA ]. Jeśli niedociśnienie wystąpi podczas dostosowywania dawki docelowej, właściwy jest powrót do poprzedniej dawki w schemacie dostosowywania dawki.
Spada
Atypowe leki przeciwpsychotyczne, w tym SEROQUEL, mogą powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków, a w konsekwencji złamań lub innych urazów. W przypadku pacjentów z chorobami, stanami lub lekami, które mogą nasilać te skutki, należy przeprowadzić pełną ocenę ryzyka upadków na początku leczenia przeciwpsychotycznego oraz ponownie w przypadku pacjentów poddawanych długotrwałemu leczeniu przeciwpsychotycznemu.
Wzrost ciśnienia krwi (dzieci i młodzież)
kontrolowanych placebo badaniach u dzieci i młodzieży ze schizofrenią (trwający 6 tygodni) lub manią afektywną dwubiegunową (trwający 3 tygodnie), częstość występowania w dowolnym momencie wzrostu skurczowego ciśnienia krwi (≥20 mmHg) wynosiła 15,2% (51/335). ) dla SEROQUEL 50 mg i 5,5% (9/163) dla placebo; częstość występowania w dowolnym momencie wzrostu rozkurczowego ciśnienia krwi (≥10 mmHg) wynosiła 40,6% (136/335) dla produktu SEROQUEL i 24,5% (40/163) dla placebo. W 26-tygodniowym, otwartym badaniu klinicznym, u jednego dziecka z historią nadciśnienia tętniczego wystąpił przełom nadciśnieniowy. Ciśnienie krwi u dzieci i młodzieży należy mierzyć na początku oraz okresowo w trakcie leczenia.
kontrolowanym placebo badaniu klinicznym SEROQUEL XR (8 tygodni) u dzieci i młodzieży (10-17 lat) z depresją w przebiegu choroby afektywnej dwubiegunowej, w którym nie ustalono skuteczności, częstość występowania w dowolnym momencie wzrostu skurczowego ciśnienia krwi (≥ 20 mmHg) wynosiło 6,5% (6/92) dla produktu SEROQUEL XR i 6,0% (6/100) dla placebo; częstość występowania w dowolnym momencie wzrostu rozkurczowego ciśnienia krwi (≥10 mmHg) wynosiła 46,7% (43/92) dla produktu SEROQUEL 25mg XR i 36,0% (36/100) dla placebo.
leukopenia, neutropenia i agranulocytoza
W badaniach klinicznych i po wprowadzeniu produktu do obrotu zgłaszano przypadki leukopenii/neutropenii związane czasowo ze stosowaniem atypowych leków przeciwpsychotycznych, w tym produktu SEROQUEL. Zgłaszano agranulocytozę.
przypadku kwetiapiny zgłaszano przypadki agranulocytozy (definiowanej jako bezwzględna liczba neutrofili
Możliwe czynniki ryzyka leukopenii/neutropenii obejmują istniejącą wcześniej niską liczbę białych krwinek (WBC) i historię leukopenii/neutropenii polekowej. U pacjentów z wcześniej występującym niskim poziomem WBC lub z leukopenią/neutropenią polekową w wywiadzie należy często monitorować morfologię krwi (CBC) w ciągu pierwszych kilku miesięcy leczenia i powinni odstawić SEROQUEL 50 mg przy pierwszych oznakach zmniejszenia liczby białych krwinek. brak innych czynników sprawczych.
Pacjentów z neutropenią należy uważnie monitorować pod kątem gorączki lub innych objawów lub oznak zakażenia i niezwłocznie leczyć, jeśli takie objawy lub oznaki wystąpią. Pacjenci z ciężką neutropenią (bezwzględna liczba neutrofili
Zaćma
Rozwój zaćmy obserwowano w związku z leczeniem kwetiapiną w badaniach nad psami przewlekłymi [patrz Toksykologia niekliniczna ]. Zmiany w soczewkach obserwowano również u dorosłych, dzieci i młodzieży podczas długotrwałego leczenia produktem SEROQUEL 100 mg, ale nie ustalono związku przyczynowego ze stosowaniem produktu SEROQUEL 200 mg. Niemniej jednak nie można obecnie wykluczyć możliwości zmian soczewkowych. Dlatego badanie soczewki metodami odpowiednimi do wykrycia powstawania zaćmy, takimi jak badanie lampą szczelinową lub innymi odpowiednio czułymi metodami, jest zalecane na początku leczenia lub krótko po nim, a także w odstępach 6-miesięcznych podczas leczenia przewlekłego.
Przedłużenie QT
badaniach klinicznych kwetiapina nie wiązała się z utrzymującym się wydłużeniem odstępów QT. Jednak efekt QT nie był systematycznie oceniany w dokładnym badaniu QT. W doświadczeniach po wprowadzeniu do obrotu zgłaszano przypadki wydłużenia odstępu QT u pacjentów, którzy przedawkowali kwetiapinę [patrz PRZEDAWKOWAĆ ], u pacjentów ze współistniejącymi chorobami oraz u pacjentów przyjmujących leki, o których wiadomo, że powodują zaburzenia równowagi elektrolitowej lub wydłużają odstęp QT [patrz INTERAKCJE Z LEKAMI ].
Należy unikać stosowania kwetiapiny w połączeniu z innymi lekami, o których wiadomo, że wydłużają odstęp QTc, w tym lekami przeciwarytmicznymi klasy 1A (np. chinidyna, prokainamid) lub lekami przeciwarytmicznymi klasy III (np. amiodaron, sotalol), lekami przeciwpsychotycznymi (np. zyprazydon, chlorpromazyna, tiorydazyna), antybiotyki (np. gatifloksacyna, moksyfloksacyna) lub jakakolwiek inna grupa leków, o których wiadomo, że wydłużają odstęp QTc (np. pentamidyna, octan lewometadylu, metadon).
Kwetiapiny należy również unikać w sytuacjach, które mogą zwiększać ryzyko wystąpienia torsade de pointes i (lub) nagłego zgonu, w tym (1) arytmii serca w wywiadzie, takich jak bradykardia; (2) hipokaliemia lub hipomagnezemia; (3) jednoczesne stosowanie innych leków wydłużających odstęp QTc; oraz (4) obecność wrodzonego wydłużenia odstępu QT.
Należy również zachować ostrożność przepisując kwetiapinę pacjentom ze zwiększonym ryzykiem wydłużenia odstępu QT (np. choroba układu krążenia, wydłużenie odstępu QT w wywiadzie rodzinnym, osoby w podeszłym wieku, zastoinowa niewydolność serca i przerost serca).
Napady padaczkowe
Podczas badań klinicznych drgawki wystąpiły u 0,5% (20/3490) pacjentów leczonych produktem SEROQUEL w porównaniu z 0,2% (2/954) w grupie placebo i 0,7% (4/527) w grupie aktywnej kontroli. Podobnie jak w przypadku innych leków przeciwpsychotycznych, SEROQUEL 25 mg należy stosować ostrożnie u pacjentów z napadami drgawkowymi w wywiadzie lub ze stanami potencjalnie obniżającymi próg drgawkowy, np. otępieniem typu Alzheimera. Stany, które obniżają próg drgawkowy, mogą występować częściej w populacji osób w wieku 65 lat lub starszych.
Niedoczynność tarczycy
Dorośli ludzie
Badania kliniczne kwetiapiny wykazały zależne od dawki zmniejszenie stężenia hormonów tarczycy. Zmniejszenie całkowitej i wolnej tyroksyny (T4) o około 20% w górnym końcu zakresu dawek terapeutycznych było maksymalne w pierwszych sześciu tygodniach leczenia i utrzymywało się bez adaptacji lub progresji podczas bardziej przewlekłego leczenia. Niemal we wszystkich przypadkach przerwanie leczenia kwetiapiną wiązało się z odwróceniem wpływu na całkowitą i wolną T4, niezależnie od czasu trwania leczenia. Mechanizm działania kwetiapiny na oś tarczycy jest niejasny. Jeśli występuje wpływ na oś podwzgórze-przysadka, pomiar samego TSH może nie odzwierciedlać dokładnie stanu tarczycy pacjenta. Dlatego zarówno TSH, jak i wolna T4, oprócz oceny klinicznej, powinny być mierzone na początku i podczas obserwacji.
badaniach uzupełniających dotyczących manii, w których SEROQUEL 50 mg dodawano do litu lub diwalproexu, 12% (24/196) pacjentów leczonych SEROQUEL 200 mg w porównaniu do 7% (15/203) pacjentów otrzymujących placebo miało podwyższony poziom TSH. Spośród pacjentów leczonych SEROQUEL 300 mg z podwyższonym poziomem TSH, 3 miało jednocześnie niski poziom wolnej T4 (wolna T4
Około 0,7% (26/3489) pacjentów z produktem SEROQUEL doświadczyło wzrostu TSH w badaniach monoterapii. U niektórych pacjentów z podwyższonym stężeniem TSH konieczne jest leczenie zastępcze tarczycy.
We wszystkich badaniach z kwetiapiną częstość zmian hormonów tarczycy i TSH wynosiła1: zmniejszenie wolnej T4 (5mIU/l), 4,9% (956/19412). U ośmiu pacjentów, u których mierzono TBG, poziomy TBG pozostały niezmienione.
Tabela 8 przedstawia częstość występowania tych zmian w krótkoterminowych badaniach klinicznych kontrolowanych placebo.
W krótkoterminowych badaniach z grupą kontrolną otrzymującą placebo w monoterapii częstość występowania wzajemnych zmian T3 i TSH wynosiła 0,0% zarówno dla kwetiapiny (1/4800), jak i placebo (0/2190), a dla T4 i TSH zmiany te wynosiły 0,1% (7 /6154) dla kwetiapiny w porównaniu z 0,0% (1/3007) dla placebo.
Dzieci i młodzież
W ostrych badaniach kontrolowanych placebo u dzieci i młodzieży ze schizofrenią (trwający 6 tygodni) lub manią afektywną dwubiegunową (trwający 3 tygodnie), częstość występowania zmian w wartościach czynności tarczycy w dowolnym momencie u pacjentów leczonych produktem Seroquel 100 mg i pacjentów otrzymujących placebo dla podwyższonego TSH wynosiło odpowiednio 2,9% (8/280) vs. 0,7% (1/138), a dla obniżonej całkowitej tyroksyny odpowiednio 2,8% (8/289) vs. 0% (0/145). Spośród pacjentów leczonych preparatem SEROQUEL z podwyższonym poziomem TSH, 1 miał jednocześnie niski poziom wolnej T4 pod koniec leczenia.
Hiperprolaktynemia
Dorośli ludzie
Podczas badań klinicznych z kwetiapiną częstość występowania zmian stężeń prolaktyny do wartości klinicznie istotnych wystąpiła u 3,6% (158/4416) pacjentów leczonych kwetiapiną w porównaniu z 2,6% (51/1968) w grupie placebo.
Dzieci i młodzież
W ostrych badaniach kontrolowanych placebo u dzieci i młodzieży z manią afektywną dwubiegunową (trwającą 3 tygodnie) lub schizofrenią (trwającą 6 tygodni), częstość występowania zmian stężenia prolaktyny do wartości (>20 μg/l mężczyźni; >26 μg) /L kobiet w dowolnym czasie) wynosił 13,4% (18/134) dla SEROQUEL w porównaniu do 4% (3/75) dla placebo u mężczyzn i 8,7% (9/104) dla SEROQUEL 25 mg w porównaniu do 0% (0/39) dla placebo u kobiet.
Podobnie jak inne leki, które antagonizują receptory dopaminergiczne D2, SEROQUEL 300 mg podnosi poziom prolaktyny u niektórych pacjentów, który może utrzymywać się podczas długotrwałego podawania. Hiperprolaktynemia, niezależnie od etiologii, może hamować podwzgórze GnRH, powodując zmniejszenie wydzielania gonadotropin przysadkowych. To z kolei może hamować funkcje rozrodcze poprzez upośledzenie steroidogenezy gonad zarówno u kobiet, jak iu mężczyzn. Mlekotok, brak miesiączki, ginekomastię i impotencję zgłaszano u pacjentów otrzymujących związki zwiększające poziom prolaktyny. Długotrwała hiperprolaktynemia w połączeniu z hipogonadyzmem może prowadzić do zmniejszenia gęstości kości zarówno u kobiet, jak iu mężczyzn.
Eksperymenty na kulturach tkankowych wskazują, że około jedna trzecia ludzkich raków piersi jest zależna od prolaktyny in vitro, co jest czynnikiem o potencjalnym znaczeniu, jeśli rozważy się przepisanie tych leków u pacjentki z wcześniej wykrytym rakiem piersi. Podobnie jak w przypadku związków, które zwiększają uwalnianie prolaktyny, w badaniach rakotwórczości przeprowadzonych na myszach i szczurach obserwowano neoplazję gruczołu sutkowego i komórek wysp trzustkowych (gruczolakorak sutka, przysadki i gruczolaki trzustki). Ani badania kliniczne, ani badania epidemiologiczne przeprowadzone do tej pory nie wykazały związku między przewlekłym podawaniem tej klasy leków a nowotworzeniem u ludzi, ale dostępne dowody są zbyt ograniczone, aby były rozstrzygające [patrz Toksykologia niekliniczna ].
Możliwość upośledzenia funkcji poznawczych i motorycznych
Senność była często zgłaszanym zdarzeniem niepożądanym zgłaszanym u pacjentów leczonych produktem SEROQUEL, zwłaszcza w okresie 3-5 dni początkowego dostosowywania dawki. W badaniach dotyczących schizofrenii senność zgłaszano u 18% (89/510) pacjentów przyjmujących SEROQUEL 200 mg w porównaniu do 11% (22/206) pacjentów otrzymujących placebo. W badaniach klinicznych dotyczących ostrej choroby afektywnej dwubiegunowej, w których stosowano SEROQUEL 200 mg w monoterapii, senność zgłaszano u 16% (34/209) pacjentów przyjmujących SEROQUEL 300 mg w porównaniu do 4% pacjentów otrzymujących placebo. W badaniach klinicznych dotyczących ostrej choroby afektywnej dwubiegunowej, w których stosowano SEROQUEL jako terapię wspomagającą, senność zgłaszano u 34% (66/196) pacjentów przyjmujących SEROQUEL w porównaniu do 9% (19/203) pacjentów otrzymujących placebo. W badaniach dotyczących depresji w przebiegu choroby afektywnej dwubiegunowej senność zgłaszano u 57% (398/698) pacjentów przyjmujących SEROQUEL 50 mg w porównaniu do 15% (51/347) pacjentów otrzymujących placebo. Ponieważ SEROQUEL 25 mg może zaburzać osąd, myślenie lub zdolności motoryczne, pacjentów należy ostrzec przed wykonywaniem czynności wymagających czujności umysłowej, takich jak prowadzenie pojazdów mechanicznych (w tym samochodów) lub obsługiwanie niebezpiecznych maszyn, dopóki nie upewnią się, że terapia SEROQUEL-em jest skuteczna. nie wpływają na nie niekorzystnie. Senność może prowadzić do upadków.
Regulacja temperatury ciała
Chociaż nie odnotowano tego w przypadku SEROQUEL 100 mg, zakłócenie zdolności organizmu do obniżania temperatury głębokiej ciała przypisuje się środkom przeciwpsychotycznym. Zaleca się zachowanie odpowiedniej ostrożności podczas przepisywania produktu SEROQUEL 300 mg pacjentom, u których wystąpią warunki, które mogą przyczyniać się do podwyższenia temperatury głębokiej ciała, np. intensywnie ćwiczą, narażą się na ekstremalne ciepło, przyjmują jednocześnie leki o działaniu antycholinergicznym lub są odwodnieni.
Dysfagia
Zaburzenia motoryki przełyku i aspiracja były związane ze stosowaniem leków przeciwpsychotycznych. Aspiracyjne zapalenie płuc jest częstą przyczyną zachorowalności i śmiertelności u pacjentów w podeszłym wieku, zwłaszcza z zaawansowaną demencją Alzheimera. SEROQUEL 100 mg i inne leki przeciwpsychotyczne należy stosować ostrożnie u pacjentów zagrożonych zachłystowym zapaleniem płuc.
Zespół odstawienia
Po nagłym odstawieniu atypowych leków przeciwpsychotycznych, w tym SEROQUEL, opisywano ostre objawy odstawienia, takie jak bezsenność, nudności i wymioty. W krótkotrwałych badaniach klinicznych z grupą kontrolną otrzymującą placebo w monoterapii produktu SEROQUEL 25 mg XR, które obejmowały fazę odstawienia oceniającą objawy odstawienne, łączna częstość występowania jednego lub więcej objawów odstawiennych po nagłym odstawieniu leku SEROQUEL XR wyniosła 12,1% (241/1993). i 6,7% (71/1065) dla placebo. Częstość występowania poszczególnych działań niepożądanych (tj. bezsenności, nudności, bólu głowy, biegunki, wymiotów, zawrotów głowy i drażliwości) nie przekraczała 5,3% w żadnej grupie leczenia i zwykle ustępowała po 1 tygodniu od przerwania leczenia. Zaleca się stopniowe wycofywanie. [Widzieć Używaj w określonych populacjach ]
Efekty antycholinergiczne (przeciwmuskarynowe)
Norkwetiapina, aktywny metabolit kwetiapiny, wykazuje umiarkowane do silnego powinowactwo do kilku podtypów receptorów muskarynowych. Przyczynia się to do antycholinergicznych działań niepożądanych, gdy SEROQUEL 25 mg jest stosowany w dawkach terapeutycznych, przyjmowany jednocześnie z innymi lekami antycholinergicznymi lub przyjmowany w przedawkowaniu. SEROQUEL należy stosować ostrożnie u pacjentów przyjmujących leki o działaniu antycholinergicznym (przeciwmuskarynowym) [patrz PRZEDAWKOWAĆ oraz FARMAKOLOGIA KLINICZNA ].
Zaparcie było często zgłaszanym zdarzeniem niepożądanym u pacjentów leczonych kwetiapiną i stanowi czynnik ryzyka niedrożności jelit. W przypadku kwetiapiny zgłaszano przypadki niedrożności jelit, w tym przypadki zgonów u pacjentów, którzy otrzymywali jednocześnie wiele leków zmniejszających perystaltykę jelit.
SEROQUEL 300 mg należy stosować ostrożnie u pacjentów z aktualnym rozpoznaniem lub w wywiadzie zatrzymaniem moczu, klinicznie istotnym przerostem gruczołu krokowego, zaparciami lub zwiększonym ciśnieniem wewnątrzgałkowym.
Informacje dotyczące poradnictwa dla pacjentów
Poinformuj pacjenta, aby przeczytał zatwierdzone przez FDA oznakowanie pacjenta (Przewodnik po lekach).
Pacjentów należy poinformować o następujących problemach i poprosić ich o powiadomienie lekarza przepisującego lek, jeśli wystąpią one podczas przyjmowania leku SEROQUEL.
Zwiększona śmiertelność u pacjentów w podeszłym wieku z psychozą otępienną Należy poinformować pacjentów i ich opiekunów, że pacjenci w podeszłym wieku z psychozą otępienną leczeni atypowymi lekami przeciwpsychotycznymi mają zwiększone ryzyko zgonu w porównaniu z placebo. Kwetiapina nie jest dopuszczona do stosowania u pacjentów w podeszłym wieku z psychozą związaną z otępieniem [patrz OSTRZEŻENIA I ŚRODKI ].
Myśli i zachowania samobójcze
Należy zachęcać pacjentów, ich rodziny i ich opiekunów do wyczulenia na pojawienie się lęku, pobudzenia, ataków paniki, bezsenności, drażliwości, wrogości, agresywności, impulsywności, akatyzji (niepokoju psychoruchowego), hipomanii, manii i innych nietypowych zmian w zachowaniu , nasilenie depresji i myśli samobójcze, szczególnie na początku leczenia przeciwdepresyjnego oraz przy zwiększaniu lub zmniejszaniu dawki. Rodzinom i opiekunom pacjentów należy zalecić, aby codziennie zwracali uwagę na pojawienie się takich objawów, ponieważ zmiany mogą być nagłe. Takie objawy należy zgłaszać lekarzowi przepisującemu pacjentowi lub pracownikowi służby zdrowia, zwłaszcza jeśli są one ciężkie, mają nagły początek lub nie były częścią objawów występujących u pacjenta. Takie objawy mogą wiązać się ze zwiększonym ryzykiem myśli i zachowań samobójczych i wskazują na potrzebę bardzo ścisłego monitorowania i ewentualnie zmian w leczeniu [patrz OSTRZEŻENIA I ŚRODKI ].
Złośliwy Zespół Neuroleptyczny (NMS)
Pacjentom należy doradzić, aby zgłaszali lekarzowi wszelkie oznaki lub objawy, które mogą być związane z NMS. Mogą to być sztywność mięśni i wysoka gorączka [patrz OSTRZEŻENIA I ŚRODKI ].
Hiperglikemia i cukrzyca
Pacjenci powinni być świadomi objawów hiperglikemii (wysokiego poziomu cukru we krwi) i cukrzycy. U pacjentów, u których zdiagnozowano cukrzycę, z czynnikami ryzyka cukrzycy lub u których te objawy wystąpią podczas leczenia, należy monitorować stężenie glukozy we krwi na początku i okresowo w trakcie leczenia [patrz OSTRZEŻENIA I ŚRODKI ].
Hiperlipidemia
Należy poinformować pacjentów, że może wystąpić podwyższenie stężenia cholesterolu całkowitego, cholesterolu LDL i triglicerydów oraz zmniejszenie stężenia cholesterolu HDL. Pacjenci powinni mieć monitorowany profil lipidowy na początku i okresowo w trakcie leczenia [patrz OSTRZEŻENIA I ŚRODKI ].
Przybranie na wadze
Pacjentów należy pouczyć, że mogą wystąpić przyrosty masy ciała. Pacjenci powinni regularnie monitorować swoją wagę [patrz OSTRZEŻENIA I ŚRODKI ].
Niedociśnienie ortostatyczne
Pacjentów należy poinformować o ryzyku wystąpienia niedociśnienia ortostatycznego (objawy obejmują zawroty głowy lub uczucie pustki w głowie po wstaniu, co może prowadzić do upadków), zwłaszcza w okresie początkowego dostosowywania dawki, a także w czasie ponownego rozpoczynania leczenia lub zwiększania dawki [ Widzieć OSTRZEŻENIA I ŚRODKI ].
Podwyższone ciśnienie krwi u dzieci i młodzieży
U dzieci i młodzieży należy mierzyć ciśnienie krwi na początku i okresowo w trakcie leczenia [patrz OSTRZEŻENIA I ŚRODKI ].
Leukopenia/Neutropenia
Należy pouczyć pacjentów, u których wcześniej występował niski poziom WBC lub polekowa leukopenia/neutropenia w wywiadzie, że powinni monitorować morfologię krwi podczas przyjmowania produktu SEROQUEL. Pacjentom należy zalecić jak najszybsze skontaktowanie się z lekarzem, jeśli wystąpią u nich gorączka, objawy grypopodobne, ból gardła lub jakiekolwiek inne zakażenie, ponieważ może to być wynikiem bardzo niskiego poziomu WBC, co może wymagać podania produktu SEROQUEL 100 mg. przerwać leczenie i/lub zastosować leczenie [patrz OSTRZEŻENIA I ŚRODKI ].
Zakłócenia sprawności poznawczej i motorycznej
Pacjentów należy poinformować o ryzyku wystąpienia senności lub sedacji (które mogą prowadzić do upadków), zwłaszcza w okresie początkowego dostosowywania dawki. Należy ostrzec pacjentów przed wykonywaniem jakichkolwiek czynności wymagających czujności umysłowej, takich jak prowadzenie pojazdów mechanicznych (w tym samochodów) lub obsługiwanie maszyn, dopóki nie upewnią się, że leczenie kwetiapiną nie wpływa na nich niekorzystnie [patrz OSTRZEŻENIA I ŚRODKI ].
Ekspozycja na ciepło i odwodnienie
Pacjentów należy pouczyć o zachowaniu odpowiedniej ostrożności w celu uniknięcia przegrzania i odwodnienia [patrz OSTRZEŻENIA I ŚRODKI ].
Leki towarzyszące
Podobnie jak w przypadku innych leków, pacjentom należy doradzić, aby powiadamiali swoich lekarzy o przyjmowaniu lub planowaniu przyjmowania jakichkolwiek leków na receptę lub leków dostępnych bez recepty [patrz INTERAKCJE Z LEKAMI ].
Ciąża
Należy doradzić kobietom w ciąży, aby powiadomiły swojego lekarza, jeśli zajdą w ciążę lub zamierzają zajść w ciążę podczas leczenia preparatem SEROQUEL. Należy poinformować pacjentów, że SEROQUEL może powodować objawy pozapiramidowe i (lub) odstawienia (pobudzenie, hipertonia, hipotonia, drżenie, senność, niewydolność oddechowa i zaburzenia odżywiania) u noworodka. Poinformuj pacjentki, że istnieje rejestr ciąż, który monitoruje przebieg ciąży u kobiet narażonych na SEROQUEL 25 mg podczas ciąży [patrz Używaj w określonych populacjach ].
Bezpłodność
Należy poinformować samice o potencjale rozrodczym, że SEROQUEL może zaburzać płodność ze względu na wzrost stężenia prolaktyny w surowicy. Wpływ na płodność jest odwracalny [patrz Używaj w określonych populacjach ].
Potrzeba kompleksowego programu leczenia
SEROQUEL jest wskazany jako integralna część kompleksowego programu leczenia młodzieży ze schizofrenią i pediatryczną chorobą afektywną dwubiegunową, który może obejmować inne środki (psychologiczne, edukacyjne i społeczne). Skuteczność i bezpieczeństwo preparatu SEROQUEL 100 mg nie zostały ustalone u dzieci w wieku poniżej 13 lat w przypadku schizofrenii lub w wieku poniżej 10 lat w przypadku manii afektywnej dwubiegunowej. Odpowiednie umiejscowienie edukacyjne jest niezbędne, a interwencja psychospołeczna jest często pomocna. Decyzja o przepisaniu atypowych leków przeciwpsychotycznych będzie zależeć od oceny przez lekarza przewlekłości i nasilenia objawów pacjenta [zob. WSKAZANIA ].
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Karcynogeneza
Badania rakotwórczości przeprowadzono na myszach C57BL i szczurach Wistar. Kwetiapinę podawano w diecie myszom w dawkach 20, 75, 250 i 750 mg/kg, a szczurom przez zgłębnik w dawkach 25, 75 i 250 mg/kg przez dwa lata. Dawki te są równoważne 0,1, 0,5, 1,5 i 4,5-krotności MRHD 800 mg/dobę na podstawie mg/m2 powierzchni ciała (myszy) lub 0,3, 1 i 3 razy MRHD na podstawie mg/m2 powierzchni ciała (szczury). Obserwowano statystycznie istotne zwiększenie gruczolaków pęcherzykowych tarczycy u samców myszy przy dawkach 1,5 i 4,5-krotności MRHD w przeliczeniu na mg/m2 powierzchni ciała oraz u samców szczurów przy dawce 3 razy większej od MRHD na mg/m2 powierzchni ciała. Liczba gruczolakoraków gruczołu sutkowego była statystycznie istotnie zwiększona u samic szczurów we wszystkich badanych dawkach (0,3, 1 i 3 razy większe od MRHD na podstawie mg/m2 powierzchni ciała).
Gruczolaki komórek pęcherzykowych tarczycy mogą być wynikiem przewlekłej stymulacji tarczycy przez hormon stymulujący tarczycę (TSH), wynikającej ze zwiększonego metabolizmu i usuwania tyroksyny przez wątrobę gryzoni. Zmiany klirensu TSH, tyroksyny i tyroksyny zgodne z tym mechanizmem obserwowano w badaniach toksyczności podprzewlekłej u szczurów i myszy oraz w rocznym badaniu toksyczności u szczurów; jednak wyniki tych badań nie były ostateczne. Znaczenie wzrostu liczby gruczolaków z komórek pęcherzykowych tarczycy na ryzyko u ludzi, niezależnie od mechanizmu, nie jest znane.
Wykazano, że leki przeciwpsychotyczne chronicznie podwyższają poziom prolaktyny u gryzoni. Pomiary w surowicy w rocznym badaniu toksyczności wykazały, że kwetiapina zwiększała medianę stężenia prolaktyny w surowicy maksymalnie 32- i 13-krotnie u samców i samic szczurów. Wzrost zachorowań na nowotwory gruczołu mlekowego stwierdzono u gryzoni po długotrwałym podawaniu innych leków przeciwpsychotycznych i uważa się, że jest on związany z prolaktyną. Znaczenie tej zwiększonej częstości występowania nowotworów gruczołu sutkowego, w których pośredniczy prolaktyna u szczurów, dla ryzyka u ludzi nie jest znane [patrz OSTRZEŻENIA I ŚRODKI ].
Mutageneza
Kwetiapina nie wykazywała działania mutagennego ani klastogennego w standardowych testach genotoksyczności. Potencjał mutagenny kwetiapiny badano w teście mutacji genów bakterii Amesa in vitro oraz w teście mutacji genów ssaków in vitro w komórkach jajnika chomika chińskiego. Potencjał klastogenny kwetiapiny badano w teście aberracji chromosomowych in vitro w hodowlach ludzkich limfocytów oraz w teście mikrojądrowym szpiku kostnego in vivo u szczurów do dawki 500 mg/kg, co stanowi 6-krotność maksymalnej zalecanej dawki u ludzi w przeliczeniu na mg/m2 pc. powierzchnia ciała.
Upośledzenie płodności
Kwetiapina zmniejszała kojarzenie się i płodność samców szczurów rasy Sprague-Dawley w dawkach doustnych 50 i 150 mg/kg lub około 1 i 3 razy większej niż MRHD wynosząca 800 mg/dobę w przeliczeniu na mg/m2 powierzchni ciała. Efekty związane z lekami obejmowały zwiększenie odstępów między kojarzeniami oraz liczby kojarzeń wymaganych do udanej zapłodnienia. Efekty te były nadal obserwowane przy 3-krotności MRHD nawet po dwutygodniowym okresie bez leczenia. Dawka niepowodująca efektu w przypadku zaburzeń kojarzenia się i płodności samców szczurów wynosiła 25 mg/kg lub 0,3-krotność dawki MRHD w przeliczeniu na mg/m2 powierzchni ciała. Kwetiapina wpływała niekorzystnie na krycie i płodność samic szczurów rasy Sprague-Dawley po podaniu doustnym dawki około 1 razy większej niż MRHD wynosząca 800 mg/dobę w przeliczeniu na mg/m2 powierzchni ciała. Skutki związane z lekiem obejmowały zmniejszenie liczby kojarzeń i kojarzeń skutkujących ciążą oraz wydłużenie odstępu między kojarzeniami. Zwiększenie nieregularnych cykli rui zaobserwowano przy dawkach 10 i 50 mg/kg lub około 0,1 i 1 razy MRHD 800 mg/dobę na podstawie mg/m2 powierzchni ciała. Dawka niepowodująca efektu u samic szczurów wynosiła 1 mg/kg lub 0,01-krotność MRHD 800 mg/dobę na podstawie mg/m2 powierzchni ciała.
Używaj w określonych populacjach
Ciąża
Rejestr ekspozycji w ciąży
Istnieje rejestr ekspozycji w czasie ciąży, który monitoruje przebieg ciąży u kobiet narażonych w czasie ciąży na atypowe leki przeciwpsychotyczne, w tym SEROQUEL 50 mg. Zachęcamy świadczeniodawców do rejestrowania pacjentów, kontaktując się z Krajowym Rejestrem Ciąży dla Atypowych Leków Przeciwpsychotycznych pod numerem 1-866-961-2388 lub online pod adresem http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Podsumowanie ryzyka
Noworodki narażone na leki przeciwpsychotyczne (w tym SEROQUEL) w trzecim trymestrze ciąży są narażone na wystąpienie objawów pozapiramidowych i (lub) objawów odstawienia po porodzie (patrz Rozważania kliniczne ). Ogólne dostępne dane z opublikowanych badań epidemiologicznych kobiet w ciąży narażonych na działanie kwetiapiny nie wykazały związanego z lekiem ryzyka wystąpienia poważnych wad wrodzonych, poronienia ani niekorzystnych skutków dla matki lub płodu (patrz Dane ). Istnieje ryzyko dla matki związane z nieleczoną schizofrenią, chorobą afektywną dwubiegunową typu I lub ciężką depresją oraz z ekspozycją na leki przeciwpsychotyczne, w tym SEROQUEL 200 mg, w czasie ciąży (patrz Rozważania kliniczne ).
W badaniach na zwierzętach wystąpiła toksyczność zarodka i płodu, w tym opóźnienie kostnienia szkieletu po około 1- i 2-krotności maksymalnej zalecanej dawki u ludzi (MRHD) wynoszącej 800 mg/dobę zarówno u szczurów, jak i królików, a także zwiększona częstość zgięcia nadgarstka/tarcza (niewielkie anomalii tkanek miękkich) u płodów królików przy około 2-krotności MRHD. Ponadto masa płodów uległa zmniejszeniu u obu gatunków. Toksyczność dla matki (obserwowana jako zmniejszenie masy ciała i (lub) zgon) wystąpiła przy 2-krotności MRHD u szczurów i około 1-2-krotności MRHD u królików.
Szacowane ryzyko tła poważnych wad wrodzonych i poronienia dla wskazanych populacji jest nieznane. Wszystkie ciąże wiążą się z ryzykiem wady wrodzonej, utraty lub innych niekorzystnych skutków. W ogólnej populacji USA szacowane podstawowe ryzyko poważnych wad wrodzonych i poronienia w klinicznie rozpoznanych ciążach wynosi odpowiednio 2 do 4% i 15 do 20%.
Rozważania kliniczne
Związane z chorobą ryzyko matki i/lub płodu
Dla matki istnieje ryzyko nieleczonej schizofrenii lub choroby afektywnej dwubiegunowej typu I, w tym zwiększone ryzyko nawrotu, hospitalizacji i samobójstwa. Schizofrenia i choroba afektywna dwubiegunowa typu I wiążą się z częstszymi niekorzystnymi następstwami okołoporodowymi, w tym przedwczesnym porodem. Nie wiadomo, czy jest to bezpośredni skutek choroby, czy innych współistniejących czynników.
Prospektywne, podłużne badanie objęło 201 ciężarnych kobiet z wywiadem poważnych zaburzeń depresyjnych, które były w stanie eutymii i przyjmowały leki przeciwdepresyjne na początku ciąży. Kobiety, które odstawiły leki przeciwdepresyjne w czasie ciąży, częściej doświadczały nawrotu ciężkiej depresji niż kobiety, które kontynuowały przyjmowanie leków przeciwdepresyjnych. Rozważ ryzyko nieleczonej depresji, przerywając lub zmieniając leczenie lekami przeciwdepresyjnymi w czasie ciąży i połogu.
Działania niepożądane u płodu/noworodka
noworodków, które były narażone na leki przeciwpsychotyczne, w tym SEROQUEL 50 mg, w trzecim trymestrze ciąży zgłaszano objawy pozapiramidowe i (lub) odstawienia, w tym pobudzenie, hipertonię, hipotonię, drżenie, senność, niewydolność oddechową i zaburzenia odżywiania. Objawy te różniły się nasileniem. Monitoruj noworodki pod kątem objawów pozapiramidowych i/lub objawów odstawienia i odpowiednio zarządzaj objawami. Niektóre noworodki wyzdrowiały w ciągu kilku godzin lub dni bez specjalnego leczenia; inne wymagały przedłużonej hospitalizacji.
Dane
Dane ludzkie
Opublikowane dane z badań obserwacyjnych, rejestrów urodzeń i opisów przypadków stosowania atypowych leków przeciwpsychotycznych podczas ciąży nie wykazują wyraźnego związku z lekami przeciwpsychotycznymi i poważnymi wadami wrodzonymi. Retrospektywne badanie kohortowe z bazy danych Medicaid obejmującej 9258 kobiet narażonych na leki przeciwpsychotyczne w czasie ciąży nie wykazało ogólnego zwiększonego ryzyka poważnych wad wrodzonych.
Dane zwierząt
Gdy ciężarne szczury i króliki były narażone na kwetiapinę podczas organogenezy, nie stwierdzono działania teratogennego u płodów. Dawki wynosiły 25, 50 i 200 mg/kg u szczurów oraz 25, 50 i 100 mg/kg u królików, co stanowiło około 0,3, 0,6 i 2 razy (szczury) oraz 0,6, 1 i 2 razy (króliki) MRHD dla schizofrenia 800 mg/dobę na podstawie mg/m2 powierzchni ciała. Ujawniono jednak dowody na toksyczność zarodkowo-płodową, w tym opóźnienia w kostnieniu szkieletu przy około 1- i 2-krotnej MRHD wynoszącej 800 mg/dobę zarówno u szczurów, jak i królików, oraz zwiększoną częstość występowania zgięcia nadgarstka/tarcza (drobna anomalia tkanek miękkich) u płody królika przy około 2-krotności MRHD. Ponadto masa płodów uległa zmniejszeniu u obu gatunków. Toksyczność u matek (obserwowana jako zmniejszenie masy ciała i (lub) zgon) wystąpiła przy 2-krotności MRHD u szczurów i około 1-2-krotności MRHD (wszystkie badane dawki) u królików.
badaniach na szczurach dotyczących reprodukcji w okresie około- i poporodowym nie zaobserwowano wpływu leku, gdy ciężarne samice leczono kwetiapiną w dawkach 0,01, 0,1 i 0,2 razy większych niż MRHD wynosząca 800 mg/dobę w przeliczeniu na mg/m2 powierzchni ciała. Jednak we wstępnym badaniu około-/poporodowym zaobserwowano wzrost śmiertelności płodów i młodych oraz spadek średniej masy miotu przy 3-krotności MRHD.
Laktacja
Podsumowanie ryzyka
Ograniczone dane z opublikowanego piśmiennictwa wskazują na obecność kwetiapiny w mleku kobiecym we względnej dawce niemowlęcia wynoszącej
Kobiety i mężczyźni o potencjale rozrodczym
Bezpłodność
Kobiety
Biorąc pod uwagę farmakologiczne działanie kwetiapiny (antagonizm D2), leczenie produktem SEROQUEL może powodować zwiększenie stężenia prolaktyny w surowicy, co może prowadzić do odwracalnego zmniejszenia płodności u kobiet w wieku rozrodczym [patrz OSTRZEŻENIA I ŚRODKI ].
Zastosowanie pediatryczne
Ogólnie rzecz biorąc, działania niepożądane obserwowane u dzieci i młodzieży podczas badań klinicznych były podobne do tych w populacji dorosłych, z nielicznymi wyjątkami. Wzrosty skurczowego i rozkurczowego ciśnienia krwi występowały u dzieci i młodzieży i nie występowały u dorosłych. Niedociśnienie ortostatyczne występowało częściej u dorosłych (4-7%) w porównaniu z dziećmi i młodzieżą ( OSTRZEŻENIA I ŚRODKI oraz DZIAŁANIA NIEPOŻĄDANE ].
Schizofrenia
Skuteczność i bezpieczeństwo preparatu SEROQUEL 50 mg w leczeniu schizofrenii u młodzieży w wieku 13-17 lat wykazano w jednym 6-tygodniowym badaniu z podwójnie ślepą próbą, kontrolowanym placebo [patrz WSKAZANIA , DAWKOWANIE I SPOSÓB PODAWANIA , DZIAŁANIA NIEPOŻĄDANE , oraz Studia kliniczne ].
Bezpieczeństwo i skuteczność produktu SEROQUEL 300 mg u dzieci w wieku poniżej 13 lat ze schizofrenią nie zostały ustalone.
Konserwacja
Nie ustalono bezpieczeństwa i skuteczności produktu SEROQUEL w leczeniu podtrzymującym choroby afektywnej dwubiegunowej u dzieci w wieku poniżej 18 lat. Bezpieczeństwo i skuteczność produktu SEROQUEL w leczeniu podtrzymującym schizofrenii nie zostały ustalone w żadnej populacji pacjentów, w tym u dzieci i młodzieży.
Mania dwubiegunowa
Skuteczność i bezpieczeństwo preparatu SEROQUEL w leczeniu manii u dzieci i młodzieży w wieku 10-17 lat z chorobą afektywną dwubiegunową typu I wykazano w 3-tygodniowym, wieloośrodkowym badaniu z podwójnie ślepą próbą, kontrolowanym placebo [patrz WSKAZANIA , DAWKOWANIE I SPOSÓB PODAWANIA , DZIAŁANIA NIEPOŻĄDANE , oraz Studia kliniczne ]. Bezpieczeństwo i skuteczność produktu SEROQUEL u dzieci w wieku poniżej 10 lat z manią afektywną dwubiegunową nie zostały ustalone.
Depresja dwubiegunowa
Bezpieczeństwo i skuteczność produktu SEROQUEL 300 mg u dzieci w wieku poniżej 18 lat z depresją w przebiegu choroby afektywnej dwubiegunowej nie zostały ustalone. Badanie kliniczne preparatu SEROQUEL XR przeprowadzono u dzieci i młodzieży (10-17 lat) z depresją w przebiegu choroby afektywnej dwubiegunowej, skuteczność nie została ustalona.
Zaobserwowano pewne różnice w farmakokinetyce kwetiapiny między dziećmi/młodzieżami (10-17 lat) a dorosłymi. Po uwzględnieniu masy ciała, wartości AUC i Cmax kwetiapiny były odpowiednio o 41% i 39% mniejsze u dzieci i młodzieży w porównaniu z dorosłymi. Farmakokinetyka aktywnego metabolitu, norkwetiapiny, była podobna u dzieci/młodzieży i dorosłych po dostosowaniu do masy ciała [patrz FARMAKOLOGIA KLINICZNA ].
Zastosowanie geriatryczne
Spośród około 3700 pacjentów biorących udział w badaniach klinicznych produktu SEROQUEL 300 mg, 7% (232) miało 65 lat lub więcej. Ogólnie rzecz biorąc, nie stwierdzono różnic w tolerancji preparatu SEROQUEL u osób starszych w porównaniu z młodszymi dorosłymi. Niemniej jednak obecność czynników, które mogą zmniejszać klirens farmakokinetyczny, zwiększać odpowiedź farmakodynamiczną na SEROQUEL 200 mg lub powodować gorszą tolerancję lub ortostazę, powinna skłaniać do rozważenia mniejszej dawki początkowej, wolniejszego zwiększania dawki i starannego monitorowania w początkowym okresie dawkowania w Starsi. Średni klirens osoczowy produktu SEROQUEL 25 mg był zmniejszony o 30% do 50% u pacjentów w podeszłym wieku w porównaniu z młodszymi pacjentami [patrz FARMAKOLOGIA KLINICZNA oraz DAWKOWANIE I SPOSÓB PODAWANIA ].
Zaburzenia czynności nerek
Doświadczenie kliniczne ze stosowaniem produktu SEROQUEL u pacjentów z zaburzeniami czynności nerek jest ograniczone [patrz FARMAKOLOGIA KLINICZNA ].
Niewydolność wątroby
Ponieważ kwetiapina jest w znacznym stopniu metabolizowana w wątrobie, u pacjentów z zaburzeniami czynności wątroby można spodziewać się wyższych jej stężeń w osoczu. W tej populacji zaleca się małą dawkę początkową 25 mg/dobę, a dawkę można zwiększać stopniowo o 25 mg/dobę-50 mg/dobę [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ].
PRZEDAWKOWAĆ
Ludzkie doświadczenie
W badaniach klinicznych odnotowano przeżycie w przypadku ostrego przedawkowania do 30 gramów kwetiapiny. U większości pacjentów, którzy przedawkowali, nie wystąpiły żadne działania niepożądane lub całkowicie wyzdrowiała po zgłoszonych zdarzeniach. W badaniu klinicznym zgłoszono zgon po przedawkowaniu 13,6 grama samej kwetiapiny. Ogólnie rzecz biorąc, zgłaszane oznaki i objawy były wynikiem nasilenia znanych efektów farmakologicznych leku, tj. senności, uspokojenia, tachykardii, niedociśnienia i toksyczności antycholinergicznej, w tym śpiączki i majaczenia. Pacjenci z istniejącą wcześniej ciężką chorobą sercowo-naczyniową mogą być narażeni na zwiększone ryzyko skutków przedawkowania [patrz OSTRZEŻENIA I ŚRODKI ]. Jeden przypadek, obejmujący szacowane przedawkowanie 9600 mg, był związany z hipokaliemią i blokiem serca pierwszego stopnia. Po wprowadzeniu produktu do obrotu zgłaszano przypadki wydłużenia odstępu QT po przedawkowaniu.
Zarządzanie przedawkowaniem
Zapewnij i utrzymuj drogi oddechowe oraz zapewnij odpowiednie natlenienie i wentylację. Monitorowanie sercowo-naczyniowe powinno rozpocząć się natychmiast i powinno obejmować ciągłe monitorowanie elektrokardiograficzne w celu wykrycia ewentualnych arytmii.
Podstawą zarządzania są odpowiednie środki wspomagające. Aby uzyskać najbardziej aktualne informacje na temat postępowania w przypadku przedawkowania Seroquel XR, skontaktuj się z certyfikowanym Regionalnym Centrum Kontroli Zatruć (1-800-222-1222).
PRZECIWWSKAZANIA
Nadwrażliwość na kwetiapinę lub na którąkolwiek substancję pomocniczą preparatu SEROQUEL XR. U pacjentów leczonych produktem SEROQUEL XR zgłaszano reakcje anafilaktyczne.
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Mechanizm działania kwetiapiny w wymienionych wskazaniach jest niejasny. Jednak skuteczność kwetiapiny w tych wskazaniach może wynikać z połączenia antagonistycznego działania dopaminy typu 2 (D2) i serotoniny typu 2 (5HT2). Aktywny metabolit, N-dealkilokwetiapina (norkwetiapina), wykazuje podobną aktywność w D2, ale większą aktywność w stosunku do receptorów 5HT2A, niż lek macierzysty (kwetiapina).
Farmakodynamika
Kwetiapina i jej metabolit norkwetiapina wykazują powinowactwo do wielu receptorów neuroprzekaźników, przy czym norkwetiapina wiąże się z większym powinowactwem niż kwetiapina ogólnie. Wartości Ki dla kwetiapiny i norkwetiapiny przy D1 dopaminy wynoszą 428/99,8 nM, przy D2 626/489nM, przy serotoninie 5HT1A 1040/191 nM przy 5HT2A 38/2,9 nM, przy histaminie H1 4,4/1,1 nM, przy muskarynowym M1 1086/ 38,3 nM, a przy adrenergicznym a1b 14,6/46,4 nM, a przy receptorach a2 odpowiednio 617/1290 nM. Kwetiapina i norkwetiapina nie wykazują znaczącego powinowactwa do receptorów benzodiazepinowych.
Wpływ na odstęp QT
badaniach klinicznych kwetiapina nie wiązała się z utrzymującym się wydłużeniem odstępów QT. Jednak efekt QT nie był systematycznie oceniany w dokładnym badaniu QT. W doświadczeniach po wprowadzeniu do obrotu zgłaszano przypadki wydłużenia odstępu QT u pacjentów, którzy przedawkowali kwetiapinę [patrz PRZEDAWKOWAĆ ], u pacjentów ze współistniejącymi chorobami oraz u pacjentów przyjmujących leki, o których wiadomo, że powodują zaburzenia równowagi elektrolitowej lub wydłużają odstęp QT.
Farmakokinetyka
Dorośli ludzie
Aktywność fumaranu kwetiapiny wynika przede wszystkim z leku macierzystego. Farmakokinetyka kwetiapiny po podaniu wielokrotnym jest proporcjonalna do dawki w proponowanym zakresie dawek klinicznych, a kumulacja kwetiapiny jest przewidywalna po podaniu wielokrotnym. Eliminacja kwetiapiny odbywa się głównie poprzez metabolizm wątrobowy, ze średnim końcowym okresem półtrwania wynoszącym około 6 godzin w proponowanym zakresie dawek klinicznych. Oczekuje się, że stężenia w stanie stacjonarnym zostaną osiągnięte w ciągu dwóch dni od podania. Jest mało prawdopodobne, aby kwetiapina wpływała na metabolizm leków metabolizowanych przez enzymy cytochromu P450.
Dzieci i młodzież
stanie stacjonarnym farmakokinetyka związku macierzystego u dzieci i młodzieży (10-17 lat) była podobna jak u dorosłych. Jednak po dostosowaniu do dawki i masy AUC i Cmax związku macierzystego były odpowiednio o 41% i 39% niższe u dzieci i młodzieży niż u dorosłych. W przypadku aktywnego metabolitu, norkwetiapiny, wartości AUC i Cmax były odpowiednio o 45% i 31% większe u dzieci i młodzieży niż u dorosłych. Po dostosowaniu do dawki i masy ciała farmakokinetyka metabolitu norkwetiapiny była podobna u dzieci i młodzieży oraz u dorosłych [patrz Używaj w określonych populacjach ].
Wchłanianie
Fumaran kwetiapiny jest szybko wchłaniany po podaniu doustnym, osiągając maksymalne stężenie w osoczu po 1,5 godziny. Formuła tabletki jest w 100% biodostępna w stosunku do roztworu. Na biodostępność kwetiapiny nieznacznie wpływa podawanie z pokarmem, przy czym wartości Cmax i AUC wzrastają odpowiednio o 25% i 15%.
Dystrybucja
Kwetiapina jest szeroko dystrybuowana w organizmie z pozorną objętością dystrybucji 10±4 l/kg. W 83% wiąże się z białkami osocza w stężeniach terapeutycznych. In vitro kwetiapina nie wpływała na wiązanie warfaryny lub diazepamu z albuminą surowicy ludzkiej. Z kolei ani warfaryna, ani diazepam nie zmieniały wiązania kwetiapiny.
Metabolizm i eliminacja
Po doustnym podaniu pojedynczej dawki 14C-kwetiapiny mniej niż 1% podanej dawki zostało wydalone w postaci niezmienionej, co wskazuje, że kwetiapina jest silnie metabolizowana. Około 73% i 20% dawki odzyskano odpowiednio z moczem i kałem.
Kwetiapina jest intensywnie metabolizowana w wątrobie. Główne szlaki metaboliczne to sulfoksydacja do metabolitu sulfotlenku i utlenianie do macierzystego metabolitu kwasowego; oba metabolity są nieaktywne farmakologicznie. Badania in vitro z użyciem mikrosomów wątroby ludzkiej wykazały, że izoenzym cytochromu P450 3A4 bierze udział w metabolizmie kwetiapiny do jej głównego, ale nieaktywnego metabolitu sulfotlenku oraz w metabolizmie jej aktywnego metabolitu N-dealkilokwetiapiny.
Wiek
Klirens kwetiapiny po podaniu doustnym był zmniejszony o 40% u pacjentów w podeszłym wieku (≥ 65 lat, n=9) w porównaniu z młodymi pacjentami (n=12) i może być konieczne dostosowanie dawki [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Płeć
Płeć nie ma wpływu na farmakokinetykę kwetiapiny.
Wyścig
Nie ma wpływu rasy na farmakokinetykę kwetiapiny.
Palenie
Palenie nie ma wpływu na klirens kwetiapiny po podaniu doustnym.
Niewydolność nerek
pacjentów z ciężkimi zaburzeniami czynności nerek (Clcr=10-30 ml/min/1,73 m2, n=8) średni klirens po podaniu doustnym był o 25% niższy niż u osób zdrowych (Clcr > 80 ml/min/1,73 m2, n=8), ale Stężenia kwetiapiny w osoczu u osób z niewydolnością nerek mieściły się w zakresie stężeń obserwowanych u zdrowych osób otrzymujących tę samą dawkę. W związku z tym u tych pacjentów nie jest konieczne dostosowanie dawki [patrz Używaj w określonych populacjach ].
Niewydolność wątroby
Pacjenci z zaburzeniami czynności wątroby (n=8) mieli o 30% niższy średni klirens kwetiapiny po podaniu doustnym niż osoby zdrowe. U dwóch z 8 pacjentów z zaburzeniami czynności wątroby wartości AUC i Cmax były 3 razy większe niż wartości obserwowane typowo u zdrowych osób. Ponieważ kwetiapina jest w znacznym stopniu metabolizowana przez wątrobę, w populacji z zaburzeniami czynności wątroby można spodziewać się wyższych stężeń w osoczu i może być konieczne dostosowanie dawki [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz STOSOWANIE W OKREŚLONYCH POPULACJACH ].
Badania interakcji między lekami
Oceny in vivo wpływu innych leków na farmakokinetykę kwetiapiny podsumowano w Tabeli 17 [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz INTERAKCJE Z LEKAMI ].
Dane dotyczące hamowania enzymów in vitro sugerują, że kwetiapina i 9 jej metabolitów miałyby niewielki wpływ hamujący na metabolizm in vivo za pośrednictwem cytochromów CYP 1A2, 2C9, 2C19, 2D6 i 3A4. Kwetiapina w dawkach 750 mg/dobę nie wpływała na farmakokinetykę pojedynczej dawki antypiryny, litu lub lorazepamu (Tabela 18) [patrz INTERAKCJE Z LEKAMI ].
Toksykologia i/lub farmakologia zwierząt
Kwetiapina powodowała zależne od dawki zwiększenie odkładania się pigmentu w tarczycy w badaniach toksyczności na szczurach, które trwały 4 tygodnie lub dłużej, oraz w 2-letnim badaniu rakotwórczości na myszach. Dawki wynosiły 10, 25, 50, 75, 150 i 250 mg/kg w badaniach na szczurach, co stanowiło około 0,1, 0,3, 0,6, 1, 2 i 3-krotność MRHD wynoszącą 800 mg/dobę w oparciu o mg/m2 powierzchni ciała , odpowiednio. Dawki w badaniu rakotwórczości u myszy wynosiły 20, 75, 250 i 750 mg/kg, co stanowi około 0,1, 0,5, 1,5 i 4,5-krotność MRHD wynoszącej 800 mg/dobę w przeliczeniu na mg/m2 powierzchni ciała. Wykazano, że osadzanie pigmentu jest nieodwracalne u szczurów. Nie udało się ustalić tożsamości pigmentu, ale stwierdzono, że jest on zlokalizowany razem z kwetiapiną w komórkach nabłonka pęcherzykowego tarczycy. Skutki funkcjonalne i znaczenie tego odkrycia dla ryzyka dla ludzi są nieznane.
psów otrzymujących kwetiapinę przez 6 lub 12 miesięcy, ale nie przez 1 miesiąc, ogniskowa zaćma trójkątna pojawiła się na połączeniu szwów tylnych w zewnętrznej korze soczewki w dawce 100 mg/kg, czyli 4 razy większej niż MRHD 800 mg/dobę na podstawie mg/m2 powierzchni ciała. Odkrycie to może wynikać z hamowania biosyntezy cholesterolu przez kwetiapinę. Kwetiapina powodowała zależne od dawki zmniejszenie stężenia cholesterolu w osoczu w badaniach po podaniu wielokrotnym na psach i małpach; jednak nie było korelacji między poziomem cholesterolu w osoczu a obecnością zaćmy u poszczególnych psów. Pojawienie się delta-8cholestanolu w osoczu jest zgodne z hamowaniem późnego etapu biosyntezy cholesterolu u tych gatunków. W specjalnym badaniu na samicach psów leczonych kwetiapiną zaobserwowano również 25% zmniejszenie zawartości cholesterolu w zewnętrznej korze soczewki. Zaćmy związanej z lekami nie zaobserwowano u żadnego innego gatunku; jednak w rocznym badaniu na małpach, prążkowany wygląd przedniej powierzchni soczewki wykryto u 2/7 samic przy dawce 225 mg/kg lub 5,5-krotności MRHD wynoszącej 800 mg/dobę w oparciu o mg/m2 ciała powierzchnia.
Studia kliniczne
Schizofrenia
Krótkoterminowe Próby – Dorośli
Skuteczność preparatu SEROQUEL 50mg w leczeniu schizofrenii potwierdzono w 3 krótkoterminowych (6-tygodniowych) kontrolowanych badaniach klinicznych z udziałem pacjentów hospitalizowanych ze schizofrenią spełniających kryteria DSM III-R dla schizofrenii. Chociaż jedno ramię haloperidolu o ustalonej dawce zostało włączone jako leczenie porównawcze w jednym z trzech badań, ta grupa z pojedynczą dawką haloperidolu była niewystarczająca, aby zapewnić wiarygodne i trafne porównanie SEROQUEL 200 mg i haloperidolu.
badaniach tych wykorzystano kilka narzędzi do oceny objawów i symptomów psychicznych, w tym Krótkiej Skali Oceny Psychiatrycznej (BPRS), wielopunktowego spisu ogólnej psychopatologii, tradycyjnie stosowanego do oceny efektów leczenia farmakologicznego w schizofrenii. Klaster psychoz BPRS (dezorganizacja pojęciowa, zachowanie halucynacyjne, podejrzliwość i nietypowa treść myśli) jest uważany za szczególnie przydatny podzbiór do oceny pacjentów ze schizofrenią psychotyczną. Druga tradycyjna ocena, Clinical Global Impression (CGI), odzwierciedla wrażenie wykwalifikowanego obserwatora, w pełni zaznajomionego z objawami schizofrenii, na temat ogólnego stanu klinicznego pacjenta.
Wyniki prób są następujące:
Pierwotne wyniki skuteczności tych trzech badań w leczeniu schizofrenii u dorosłych przedstawiono w Tabeli 19.
Badanie podgrup populacji (rasa, płeć i wiek) nie wykazało żadnej zróżnicowanej reakcji na podstawie rasy lub płci, z wyraźnie większym efektem u pacjentów w wieku poniżej 40 lat w porównaniu z osobami w wieku powyżej 40 lat. Istotność kliniczna to odkrycie jest nieznane.
Młodzież (13-17 lat)
Skuteczność preparatu SEROQUEL 300 mg w leczeniu schizofrenii u młodzieży (13-17 lat) wykazano w 6-tygodniowym, podwójnie zaślepionym badaniu kontrolowanym placebo (badanie 4). Pacjenci spełniający kryteria diagnostyczne schizofrenii DSM-IV zostali losowo przydzieleni do jednej z trzech grup terapeutycznych: SEROQUEL 400 mg/dobę (n=73), SEROQUEL 800 mg/dobę (n=74) lub placebo (n=75). Badany lek rozpoczęto w dawce 50 mg/dobę, a drugiego dnia zwiększono do 100 mg/dobę (podzielone i podawane dwa lub trzy razy dziennie). Następnie dawkę miareczkowano do dawki docelowej 400 mg/dobę lub 800 mg/dobę, zwiększając ją o 100 mg/dobę, podzielono i podawano dwa lub trzy razy na dobę. Pierwszorzędową zmienną skuteczności była średnia zmiana w stosunku do wartości wyjściowej w całkowitej skali zespołów pozytywnych i negatywnych (PANSS).
SEROQUEL w dawkach 400 mg/dobę i 800 mg/dobę przewyższał placebo pod względem zmniejszenia całkowitego wyniku PANSS. Pierwotne wyniki skuteczności tego badania w leczeniu schizofrenii u młodzieży przedstawiono w tabeli 19.
Zaburzenie afektywne dwubiegunowe
Zaburzenie dwubiegunowe typu I, epizody maniakalne lub mieszane
Dorośli ludzie
Skuteczność produktu SEROQUEL w ostrym leczeniu epizodów maniakalnych ustalono w 3 badaniach kontrolowanych placebo u pacjentów spełniających kryteria DSM-IV dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi. Badania te obejmowały pacjentów z objawami psychotycznymi lub bez nich, a wykluczono pacjentów z epizodami szybkiej zmiany cyklu i epizodami mieszanymi. Spośród tych badań 2 dotyczyły monoterapii (12 tygodni), a 1 terapii skojarzonej (3 tygodnie) z litem lub diwalproeksem. Kluczowymi wynikami w tych badaniach były zmiany w stosunku do wartości wyjściowych w skali oceny Young Mania (YMRS) po 3 i 12 tygodniach dla monoterapii oraz po 3 tygodniach dla terapii wspomagającej. Terapię wspomagającą definiuje się jako jednoczesne rozpoczęcie lub kolejne podawanie produktu SEROQUEL 100 mg z litem lub diwalproeksem.
Podstawowym instrumentem oceny objawów maniakalnych w tych badaniach była YMRS, 11-punktowa skala oceniana przez lekarza, tradycyjnie stosowana do oceny stopnia symptomatologii maniakalnej (drażliwość, destrukcyjne/agresywne zachowanie, sen, podwyższony nastrój, mowa, zwiększona aktywność, zainteresowanie seksualne, zaburzenia języka/myśli, treść myśli, wygląd i wgląd) w zakresie od 0 (brak cech maniakalnych) do 60 (maksymalny wynik).
Wyniki prób są następujące:
Monoterapia
Skuteczność preparatu SEROQUEL w ostrym leczeniu manii afektywnej dwubiegunowej ustalono w 2 badaniach kontrolowanych placebo. W dwóch 12-tygodniowych badaniach (n=300, n=299) porównujących SEROQUEL z placebo, SEROQUEL 300 mg był skuteczniejszy niż placebo pod względem zmniejszenia całkowitego wyniku YMRS w 3. i 12. tygodniu. Większość pacjentów w tych badaniach przyjmowała SEROQUEL 100 mg były dawkowane w zakresie od 400 mg/dobę do 800 mg na dobę (badania 1 i 2 w Tabeli 20).
Terapia uzupełniająca
tym 3-tygodniowym badaniu kontrolowanym placebo 170 pacjentów z manią afektywną dwubiegunową (YMRS ≥20) zostało losowo przydzielonych do grupy otrzymującej SEROQUEL 100 mg lub placebo jako leczenie uzupełniające litem lub diwalproeksem. Pacjenci przed randomizacją mogli otrzymać lub nie otrzymać odpowiedniej kuracji litem lub diwalproeksem. SEROQUEL 50 mg przewyższał placebo po dodaniu do samego litu lub samego diwalproeksu pod względem zmniejszenia całkowitej punktacji YMRS (badanie 3 w Tabeli 20).
Większość pacjentów biorących udział w tym badaniu, przyjmujących SEROQUEL 25 mg, otrzymywała dawki w zakresie od 400 mg/dobę do 800 mg/dobę. W podobnie zaprojektowanym badaniu (n=200), SEROQUEL wiązał się z poprawą wyników w skali YMRS, ale nie wykazywał wyższości nad placebo, prawdopodobnie z powodu silniejszego efektu placebo.
Pierwotne wyniki skuteczności tych badań w leczeniu manii u dorosłych przedstawiono w Tabeli 20.
Dzieci i młodzież (10-17 lat)
Skuteczność produktu SEROQUEL w ostrym leczeniu epizodów maniakalnych związanych z chorobą afektywną dwubiegunową typu I u dzieci i młodzieży (10-17 lat) wykazano w 3-tygodniowym, wieloośrodkowym badaniu z podwójnie ślepą próbą, kontrolowanym placebo (badanie 4 w Tabela 20). Pacjenci spełniający kryteria diagnostyczne DSM-IV epizodu maniakalnego zostali losowo przydzieleni do jednej z trzech grup terapeutycznych: SEROQUEL 400 mg/dobę (n=95), SEROQUEL 600 mg/dobę (n=98) lub placebo (n=91). . Badany lek rozpoczęto w dawce 50 mg/dobę, a drugiego dnia zwiększono do 100 mg/dobę (dawki podzielone podawane dwa lub trzy razy dziennie). Następnie dawkę miareczkowano do dawki docelowej 400 mg/dobę lub 600 mg/dobę, zwiększając ją o 100 mg/dobę, podawaną w dawkach podzielonych dwa lub trzy razy na dobę. Pierwszorzędową zmienną skuteczności była średnia zmiana w stosunku do wartości wyjściowej w całkowitym wyniku YMRS.
SEROQUEL 400 mg/dobę i 600 mg/dobę przewyższał placebo pod względem zmniejszenia całkowitego wyniku YMRS (Tabela 20).
Choroba afektywna dwubiegunowa, epizody depresyjne
Dorośli ludzie
Skuteczność produktu SEROQUEL 25 mg w ostrym leczeniu epizodów depresyjnych związanych z chorobą afektywną dwubiegunową ustalono w 2 identycznie zaprojektowanych 8-tygodniowych, randomizowanych badaniach z podwójnie ślepą próbą, kontrolowanych placebo (N=1045) (badania 5 i 6 w Tabeli 21). . Badania te obejmowały pacjentów z zaburzeniem afektywnym dwubiegunowym typu I lub II oraz z lub bez szybkiego kursu rowerowego. Pacjenci przydzieleni losowo do grupy otrzymującej SEROQUEL 200 mg otrzymywali stałe dawki 300 mg lub 600 mg raz na dobę.
Podstawowym narzędziem oceny używanym do oceny objawów depresji w tych badaniach była Skala Oceny Depresji Montgomery-Asberg (MADRS), 10-punktowa skala oceniana przez klinicystów z punktacją w zakresie od 0 do 60. Pierwszorzędowym punktem końcowym w obu badaniach była zmiana punkt początkowy w punktacji MADRS w 8. tygodniu. W obu badaniach produkt SEROQUEL 50 mg był skuteczniejszy niż placebo pod względem zmniejszenia punktacji w skali MADRS. Poprawę objawów, mierzoną zmianą wyniku MADRS w porównaniu z placebo, zaobserwowano w obu badaniach w dniu 8 (tydzień 1) i później. W badaniach tych nie zaobserwowano dodatkowych korzyści związanych z dawką 600 mg. W grupie dawki 300 mg zaobserwowano statystycznie istotną poprawę w porównaniu z placebo w ogólnej jakości życia i satysfakcji związanej z różnymi obszarami funkcjonowania, mierzonej za pomocą Q-LES-Q(SF).
Pierwotne wyniki skuteczności tych badań w ostrym leczeniu epizodów depresyjnych związanych z chorobą afektywną dwubiegunową u dorosłych przedstawiono w Tabeli 21.
Leczenie podtrzymujące jako dodatek do litu lub divalproex
Skuteczność produktu SEROQUEL 100 mg w leczeniu podtrzymującym choroby afektywnej dwubiegunowej typu I została potwierdzona w 2 badaniach kontrolowanych placebo u pacjentów (n=1326), którzy spełniali kryteria DSM-IV dla choroby afektywnej dwubiegunowej typu I (badania 7 i 8 na rycinach 1 i 2). Badania obejmowały pacjentów, których ostatnim epizodem był stan maniakalny, depresyjny lub mieszany, z objawami psychotycznymi lub bez nich. W fazie otwartej, pacjenci musieli być ustabilizowani przez co najmniej 12 tygodni, otrzymując SEROQUEL plus lit lub diwalproex, aby mogli być randomizowani. Pacjenci byli ustabilizowani średnio przez 15 tygodni. W fazie randomizacji pacjenci kontynuowali leczenie litem lub diwalproeksem i zostali losowo przydzieleni do grupy otrzymującej SEROQUEL (podawany dwa razy na dobę w dawce od 400 mg/dobę do 800 mg/dobę) lub placebo. Około 50% pacjentów przerwało leczenie produktem SEROQUEL do dnia 280, a 50% grupy placebo przerwało leczenie do 117 dnia leczenia metodą podwójnie ślepej próby. Pierwszorzędowym punktem końcowym w tych badaniach był czas do nawrotu epizodu nastroju (epizodu maniakalnego, mieszanego lub depresyjnego). Zdarzenie nastroju zdefiniowano jako rozpoczęcie leczenia lub hospitalizację z powodu epizodu nastroju; wynik YMRS ≥20 lub wynik MADRS ≥20 w 2 kolejnych ocenach; lub przerwanie badania z powodu zdarzenia związanego z nastrojem (ryc. 1 i ryc. 2).
obu badaniach SEROQUEL był skuteczniejszy od placebo pod względem wydłużania czasu do nawrotu jakiegokolwiek zdarzenia związanego z nastrojem. Efekt leczenia był obecny przez wydłużenie czasu do nawrotu zarówno epizodów maniakalnych, jak i depresyjnych. Działanie produktu SEROQUEL było niezależne od jakiejkolwiek konkretnej podgrupy (przypisany stabilizator nastroju, płeć, wiek, rasa, ostatni epizod dwubiegunowy lub szybki przebieg rowerowy).
Rysunek 1: Krzywe Kaplana-Meiera czasu do nawrotu zdarzenia nastroju (Badanie 7)
Rysunek 2: Krzywe Kaplana-Meiera czasu do nawrotu zdarzenia nastroju (Badanie 8)
INFORMACJA O PACJENCIE
SEROQUEL (SER-oh-kwell) (fumaran kwetiapiny) Tabletki
Przeczytaj ten Przewodnik po lekach, zanim zaczniesz zażywać SEROQUEL i za każdym razem, gdy otrzymasz uzupełnienie. Mogą pojawić się nowe informacje. Informacje te nie zastępują rozmowy z lekarzem o stanie zdrowia lub leczeniu.
Jakie są najważniejsze informacje, które powinienem wiedzieć o SEROQUEL?
SEROQUEL 100mg może powodować poważne skutki uboczne, w tym:
- Porozmawiaj z lekarzem swojego lub członka rodziny o:
- wszystkie zagrożenia i korzyści wynikające z leczenia lekami przeciwdepresyjnymi.
- wszystkie możliwości leczenia depresji lub innej poważnej choroby psychicznej
- Leki przeciwdepresyjne mogą nasilać myśli lub działania samobójcze u niektórych dzieci, nastolatków i młodych dorosłych w ciągu pierwszych kilku miesięcy leczenia.
- Depresja i inne poważne choroby psychiczne są najważniejszymi przyczynami myśli i działań samobójczych. Niektóre osoby mogą być szczególnie narażone na myśli lub działania samobójcze. Należą do nich osoby, które mają (lub mają w rodzinie) depresję, chorobę afektywną dwubiegunową (zwaną również chorobą maniakalno-depresyjną) lub myśli lub działania samobójcze.
- Jak mogę obserwować i próbować zapobiegać myślom i działaniom samobójczym u siebie lub członka rodziny?
- Zwróć szczególną uwagę na wszelkie zmiany, zwłaszcza nagłe zmiany nastroju, zachowań, myśli lub uczuć. Jest to bardzo ważne w przypadku rozpoczęcia przyjmowania leku przeciwdepresyjnego lub zmiany dawki.
- Natychmiast zadzwoń do lekarza, aby zgłosić nowe lub nagłe zmiany nastroju, zachowania, myśli lub uczuć.
- Zachowaj wszystkie wizyty kontrolne u lekarza zgodnie z planem. Zadzwoń do lekarza między wizytami w razie potrzeby, zwłaszcza jeśli masz obawy dotyczące objawów.
Zadzwoń do lekarza natychmiast, jeśli ty lub członek twojej rodziny ma którykolwiek z poniższych objawów, zwłaszcza jeśli są nowe, gorsze lub martwią cię:
- myśli o samobójstwie lub śmierci
- próby popełnienia samobójstwa
- nowa lub gorsza depresja
- nowy lub gorszy niepokój
- czuję się bardzo poruszony lub niespokojny
- atak paniki
- kłopoty ze snem (bezsenność)
- nowa lub gorsza drażliwość
- zachowywanie się agresywnie, złość lub przemoc
- działając na niebezpieczne impulsy
- ekstremalny wzrost aktywności i mówienia (mania)
- inne nietypowe zmiany w zachowaniu lub nastroju
Co jeszcze muszę wiedzieć o lekach przeciwdepresyjnych?
- Nigdy nie odstawiaj leku przeciwdepresyjnego bez uprzedniej rozmowy z lekarzem. Nagłe zatrzymanie leku przeciwdepresyjnego może spowodować inne objawy.
- Antydepresanty to leki stosowane w leczeniu depresji i innych chorób. Ważne jest omówienie wszystkich zagrożeń związanych z leczeniem depresji, a także zagrożeń związanych z jej nieleczeniem. Pacjenci i ich rodziny lub inni opiekunowie powinni omówić z lekarzem wszystkie opcje leczenia, a nie tylko stosowanie leków przeciwdepresyjnych.
- Leki przeciwdepresyjne mają inne skutki uboczne. Porozmawiaj z lekarzem o skutkach ubocznych leku przepisanego Tobie lub członkowi Twojej rodziny.
- Leki przeciwdepresyjne mogą wchodzić w interakcje z innymi lekami. Poznaj wszystkie leki, które przyjmujesz Ty lub członek Twojej rodziny. Zachowaj listę wszystkich leków, aby pokazać je lekarzowi. Nie rozpoczynaj nowych leków bez uprzedniej konsultacji z lekarzem.
- Nie wszystkie leki przeciwdepresyjne przepisywane dzieciom są zatwierdzone przez FDA do stosowania u dzieci. Porozmawiaj z lekarzem swojego dziecka, aby uzyskać więcej informacji.
Co to jest SEROQUEL 300mg?
SEROQUEL 100mg to lek na receptę stosowany w leczeniu:
- schizofrenia u osób w wieku 13 lat lub starszych
- choroba afektywna dwubiegunowa u dorosłych, w tym:
- epizody depresyjne związane z chorobą afektywną dwubiegunową
- epizody maniakalne związane z zaburzeniem afektywnym dwubiegunowym typu I samym lub z litem lub diwalproeksem
- długotrwałe leczenie choroby afektywnej dwubiegunowej typu I litem lub diwalproeksem
- epizody maniakalne związane z chorobą afektywną dwubiegunową typu I u dzieci w wieku 10-17 lat
Nie wiadomo, czy SEROQUEL 100 mg jest bezpieczny i skuteczny u dzieci poniżej 10 roku życia.
O czym powinienem powiedzieć lekarzowi przed zażyciem SEROQUEL 100mg?
Przed przyjęciem leku SEROQUEL 200 mg należy poinformować lekarza, jeśli pacjent ma lub miał:
- cukrzyca lub wysoki poziom cukru we krwi u Ciebie lub Twojej rodziny. Twój lekarz powinien sprawdzić poziom cukru we krwi przed rozpoczęciem stosowania SEROQUEL 300 mg, a także w trakcie terapii
- wysoki poziom cholesterolu całkowitego, trójglicerydów lub cholesterolu LDL lub niski poziom cholesterolu HDL
- niskie lub wysokie ciśnienie krwi
- mała liczba białych krwinek
- zaćma
- drgawki
- nieprawidłowe wyniki badań tarczycy
- wysoki poziom prolaktyny
- problemy sercowe
- problemy z wątrobą
- wszelkie inne schorzenia
- ciąża lub plany zajścia w ciążę. Nie wiadomo, czy SEROQUEL 100 mg zaszkodzi nienarodzonemu dziecku.
- Jeśli zajdziesz w ciążę podczas przyjmowania leku SEROQUEL, porozmawiaj ze swoim lekarzem o rejestracji w Krajowym Rejestrze Ciąży dla Atypowych Leków Przeciwpsychotycznych. Możesz zarejestrować się dzwoniąc pod numer 1-866-961-2388 lub przejdź do http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- karmienie piersią lub plany karmienia piersią. SEROQUEL może przenikać do mleka matki. Porozmawiaj ze swoim lekarzem o najlepszym sposobie karmienia dziecka, jeśli otrzymujesz SEROQUEL.
- jeśli masz lub miałeś stan, w którym nie możesz całkowicie opróżnić pęcherza (zatrzymanie moczu), masz powiększoną prostatę, zaparcia lub zwiększone ciśnienie w oczach.
Poinformuj lekarza o wszystkich lekach, które przyjmujesz lub ostatnio przyjmowałeś tym leki na receptę, leki dostępne bez recepty, suplementy ziołowe i witaminy.
SEROQUEL 300 mg i inne leki mogą wzajemnie na siebie oddziaływać, powodując poważne działania niepożądane. SEROQUEL 200 mg może wpływać na działanie innych leków, a inne leki mogą wpływać na działanie leku SEROQUEL 200 mg.
Poinformuj swojego lekarza, jeśli masz badanie na obecność narkotyków w moczu, ponieważ SEROQUEL może wpływać na wyniki testu. Powiedz osobom wykonującym test, że przyjmujesz SEROQUEL.
Jak powinienem przyjmować SEROQUEL?
- SEROQUEL należy przyjmować zgodnie z zaleceniami lekarza. Nie należy samodzielnie zmieniać dawki.
- SEROQUEL 25 mg należy przyjmować doustnie, z jedzeniem lub bez jedzenia.
- Jeśli czujesz, że musisz odstawić SEROQUEL 25mg, najpierw porozmawiaj ze swoim lekarzem. W przypadku nagłego przerwania stosowania leku SEROQUEL mogą wystąpić działania niepożądane, takie jak problemy ze snem lub problemy z zasypianiem (bezsenność), nudności i wymioty.
- przypadku pominięcia dawki SEROQUEL 25 mg należy ją przyjąć, gdy tylko sobie o tym przypomnisz. Jeśli zbliżasz się do następnej dawki, pomiń pominiętą dawkę. Po prostu weź następną dawkę o zwykłej porze. Nie należy przyjmować 2 dawek jednocześnie, chyba że zaleci to lekarz. Jeśli nie masz pewności co do dawkowania, skontaktuj się z lekarzem.
Czego powinienem unikać stosując SEROQUEL 100mg?
- Nie prowadź pojazdów, nie obsługuj maszyn ani nie wykonuj innych niebezpiecznych czynności, dopóki nie dowiesz się, jak SEROQUEL wpływa na Ciebie. SEROQUEL może powodować senność.
- Unikaj przegrzania lub odwodnienia.
- Nie przesadzaj.
- W czasie upałów pozostań w chłodnym miejscu, jeśli to możliwe.
- Trzymaj się z dala od słońca. Nie noś zbyt dużej lub ciężkiej odzieży.
- Pić dużo wody.
- Podczas przyjmowania leku SEROQUEL nie należy pić alkoholu. Może to pogorszyć niektóre działania niepożądane leku SEROQUEL.
Jakie są możliwe skutki uboczne SEROQUEL 300mg?
SEROQUEL 200mg może powodować poważne skutki uboczne, w tym:
- Zobacz „Jakie są najważniejsze informacje, które powinienem wiedzieć o SEROQUEL 200mg?”
- udar, który może prowadzić do śmierci, może wystąpić u osób starszych z demencją, które przyjmują leki takie jak SEROQUEL
- złośliwy zespół neuroleptyczny (NMS). NMS jest rzadkim, ale bardzo poważnym schorzeniem, które może wystąpić u osób przyjmujących leki przeciwpsychotyczne, w tym SEROQUEL. NMS może spowodować śmierć i musi być leczony w szpitalu. Zadzwoń do swojego lekarza natychmiast, jeśli poważnie zachorujesz i wystąpią niektóre lub wszystkie z tych objawów:
- wysoka gorączka
- nadmierne pocenie
- sztywne mięśnie
- dezorientacja
- zmiany w oddychaniu, rytmie serca i ciśnieniu krwi
- spada może się zdarzyć u niektórych osób przyjmujących SEROQUEL. Te upadki mogą spowodować poważne obrażenia.
- wysoki poziom cukru we krwi (hiperglikemia). Wysoki poziom cukru we krwi może wystąpić, jeśli masz już cukrzycę lub nigdy nie miałeś cukrzycy. Wysoki poziom cukru we krwi może prowadzić do:
- nagromadzenie kwasu we krwi z powodu ketonów (kwasica ketonowa)
- śpiączka
- śmierć
niektórych osób przyjmujących SEROQUEL może wystąpić podwyższenie poziomu cukru we krwi. Niezwykle wysoki poziom cukru we krwi może prowadzić do śpiączki lub śmierci. Jeśli masz cukrzycę lub czynniki ryzyka cukrzycy (takie jak nadwaga lub cukrzyca w wywiadzie rodzinnym), Twój lekarz powinien sprawdzić poziom cukru we krwi przed rozpoczęciem stosowania SEROQUEL 50 mg i podczas leczenia. Zadzwoń do swojego lekarza, jeśli wystąpi którykolwiek z tych objawów wysokiego poziomu cukru we krwi (hiperglikemia) podczas przyjmowania leku SEROQUEL:
- czuję się bardzo spragniony
- trzeba oddawać mocz częściej niż zwykle
- czuć się bardzo głodnym
- czuć się słabym lub zmęczonym
- czujesz się chory na żołądek
- czujesz się zdezorientowany lub twój oddech pachnie owocowo
- wysoki poziom tłuszczów we krwi (podwyższony poziom cholesterolu i trójglicerydów). Wysoki poziom tłuszczu może wystąpić u osób leczonych SEROQUEL. Możesz nie mieć żadnych objawów, więc Twój lekarz może zdecydować o badaniu poziomu cholesterolu i trójglicerydów podczas leczenia lekiem SEROQUEL.
- wzrost masy ciała (przyrost masy ciała). Przyrost masy ciała jest powszechny u osób przyjmujących SEROQUEL, dlatego Ty i Twój lekarz powinniście regularnie sprawdzać swoją wagę. Porozmawiaj ze swoim lekarzem o sposobach kontrolowania przyrostu masy ciała, takich jak zdrowa, zbilansowana dieta i ćwiczenia.
- ruchy twarzy, języka lub innych części ciała, których nie możesz kontrolować (dyskineza późna). Mogą to być oznaki poważnego stanu. Późne dyskinezy mogą nie ustąpić, nawet po zaprzestaniu przyjmowania leku SEROQUEL. Późne dyskinezy mogą również rozpocząć się po zaprzestaniu przyjmowania leku SEROQUEL.
- obniżone ciśnienie krwi (niedociśnienie ortostatyczne), w tym zawroty głowy lub omdlenia spowodowane nagłą zmianą częstości akcji serca i ciśnienia krwi podczas zbyt szybkiego wstawania z pozycji siedzącej lub leżącej.
- wzrost ciśnienia krwi u dzieci i młodzieży. Lekarz prowadzący powinien sprawdzać ciśnienie krwi u dzieci i młodzieży przed rozpoczęciem stosowania leku SEROQUEL oraz w trakcie leczenia.
- mała liczba białych krwinek. Poinformuj swojego lekarza tak szybko, jak to możliwe, jeśli masz gorączkę, objawy grypopodobne lub jakiekolwiek inne zakażenie, ponieważ może to być wynikiem bardzo niskiego poziomu białych krwinek. Twój lekarz może sprawdzić poziom białych krwinek, aby ustalić, czy potrzebne jest dalsze leczenie lub inne działanie.
- zaćma
- drgawki
- nieprawidłowe testy tarczycy. Twój lekarz może wykonać badania krwi, aby sprawdzić poziom hormonu tarczycy.
- wzrost poziomu prolaktyny
- senność, senność, uczucie zmęczenia, trudności z myśleniem i wykonywaniem normalnych czynności
- podwyższona temperatura ciała
- trudności z połykaniem
- problemy ze snem lub problemy z zasypianiem (bezsenność), nudności lub wymioty w przypadku nagłego przerwania stosowania leku SEROQUEL. Objawy te zwykle ustępują tydzień po ich wystąpieniu.
Do najczęstszych skutków ubocznych SEROQUEL 50mg należą:
U dorosłych:
- senność
- nagły spadek ciśnienia krwi po wstaniu
- przybranie na wadze
- ospałość
- nieprawidłowe wyniki testów wątrobowych
- rozstrój żołądka
- suchość w ustach
- zawroty głowy
- słabość
- ból brzucha
- zaparcie
- ból gardła
dzieci i młodzieży:
- senność
- zawroty głowy
- zmęczenie
- mdłości
- suchość w ustach
- przybranie na wadze
- zwiększony apetyt
- wymioty
- szybkie bicie serca
To nie wszystkie możliwe skutki uboczne stosowania SEROQUEL. Aby uzyskać więcej informacji, zapytaj swojego lekarza lub farmaceutę.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
Jak przechowywać SEROQUEL 100mg?
- Przechowywać SEROQUEL 100mg w temperaturze pokojowej, między 68 ° F do 77 ° F (20 ° C do 25 ° C).
- Lek SEROQUEL i wszystkie leki należy przechowywać w miejscu niedostępnym dla dzieci.
Ogólne informacje o bezpiecznym i skutecznym stosowaniu SEROQUEL
Leki są czasami przepisywane do celów innych niż wymienione w Przewodniku po lekach. Nie należy stosować SEROQUEL w stanach, na które nie został przepisany. Nie należy podawać leku SEROQUEL innym osobom, nawet jeśli mają takie same objawy jak ty. Może im to zaszkodzić.
Ten przewodnik po lekach podsumowuje najważniejsze informacje o SEROQUEL. Jeśli chcesz uzyskać więcej informacji, porozmawiaj ze swoim lekarzem. Możesz poprosić swojego farmaceutę lub pracownika służby zdrowia o informacje na temat SEROQUEL 100 mg, który jest przeznaczony dla pracowników służby zdrowia.
Aby uzyskać więcej informacji, przejdź do www.SEROQUEL.pl lub zadzwoń pod numer 1-800-236-9933.
Jakie są składniki SEROQUEL 200mg?
Składnik czynny: fumaran kwetiapiny
Nieaktywne składniki: powidon, dwuwodny fosforan dwuwapniowy, celuloza mikrokrystaliczna, glikolan sodowy skrobi, laktoza jednowodna, stearynian magnezu, hypromeloza, glikol polietylenowy i dwutlenek tytanu. Tabletki 25 mg zawierają czerwony i żółty tlenek żelaza. Tabletki 100 mg i 400 mg zawierają wyłącznie żółty tlenek żelaza.
Ten przewodnik po lekach został zatwierdzony przez amerykańską Agencję ds. Żywności i Leków.
