Aceon 2mg, 4mg, 8mg Perindopril Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Aceon 4mg i jak się go stosuje?
Aceon 8mg to lek na receptę stosowany w leczeniu objawów wysokiego ciśnienia krwi (nadciśnienia) i stabilnej choroby wieńcowej (CAD). Aceon może być stosowany samodzielnie lub z innymi lekami.
Aceon należy do klasy leków zwanych inhibitorami ACE.
Nie wiadomo, czy Aceon jest bezpieczny i skuteczny u dzieci.
Jakie są możliwe skutki uboczne Aceon 4mg?
Aceon może powodować poważne skutki uboczne, w tym:
- pokrzywka,
- trudności w oddychaniu,
- obrzęk twarzy, warg, języka lub gardła,
- słabość,
- wolne lub nieregularne bicie serca,
- półomdlały,
- mdłości,
- wymioty,
- utrata apetytu,
- ból brzucha,
- zażółcenie oczu lub skóry (żółtaczka),
- ciemny mocz i
- silne zawroty głowy
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Aceon 2mg to:
- zawroty głowy,
- zawroty,
- zmęczenie i
- suchy kaszel
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Aceon. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OSTRZEŻENIE
TOKSYCZNOŚĆ PŁODU
- W przypadku wykrycia ciąży należy jak najszybciej odstawić ACEON 4 mg. OSTRZEŻENIA I ŚRODKI
- Leki działające bezpośrednio na układ renina-angiotensyna mogą powodować urazy i śmierć rozwijającego się płodu. OSTRZEŻENIA I ŚRODKI
OPIS
Tabletki ACEON® (perindopril erbumine) zawierają sól tert-butyloaminy perindoprilu, estru etylowego niesulfhydrylowego inhibitora konwertazy angiotensyny (ACE). Erbumina perindoprilu jest chemicznie opisana jako kwas (2S,3DS,7DS)-1-[(S)-N-[(S)-1-karboksy-butylo]alanylo]heksahydro-2-indolinokarboksylowy, 1-ester etylowy, związek z tert-butyloamina (1:1). Jego wzór cząsteczkowy to C19H32N2O5C4H11N. Jego wzór strukturalny to:
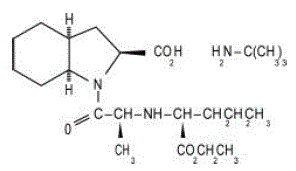
Erbumina perindoprilu jest białym, krystalicznym proszkiem o masie cząsteczkowej 368,47 (wolny kwas) lub 441,61 (postać soli). Jest dobrze rozpuszczalny w wodzie (60% w/w), alkoholu i chloroformie.
Perindopril jest postacią wolnego kwasu soli tertbutyloaminowej perindoprilu, jest prolekiem i jest metabolizowany in vivo przez hydrolizę grupy estrowej do perindoprilatu, biologicznie aktywnego metabolitu.
ACEON jest dostępny w dawkach 2 mg, 4 mg i 8 mg do podawania doustnego. Oprócz soli tertbutyloaminowej perindoprilu każda tabletka zawiera następujące składniki nieaktywne: krzemionkę koloidalną (hydrofobową), laktozę, stearynian magnezu i celulozę mikrokrystaliczną. Tabletki 4 mg i 8 mg zawierają również tlenek żelaza.
WSKAZANIA
Nadciśnienie
ACEON jest wskazany w leczeniu pacjentów z nadciśnieniem pierwotnym. ACEON może być stosowany samodzielnie lub podawany z innymi grupami leków przeciwnadciśnieniowych, zwłaszcza diuretykami tiazydowymi.
Stabilna choroba wieńcowa
ACEON 8 mg jest wskazany w leczeniu pacjentów ze stabilną chorobą wieńcową w celu zmniejszenia ryzyka zgonu z przyczyn sercowo-naczyniowych lub zawału mięśnia sercowego niezakończonego zgonem. ACEON może być stosowany w konwencjonalnym leczeniu choroby wieńcowej, takim jak terapia przeciwpłytkowa, hipotensyjna lub obniżająca poziom lipidów.
DAWKOWANIE I SPOSÓB PODAWANIA
Nadciśnienie
Stosowanie u pacjentów z niepowikłanym nadciśnieniem tętniczym
U pacjentów z nadciśnieniem pierwotnym zalecana dawka początkowa wynosi 4 mg raz na dobę. W razie potrzeby dawkę można zwiększać maksymalnie do 16 mg na dobę. Zwykle zakres dawek podtrzymujących wynosi od 4 mg do 8 mg podawanych jako pojedyncza dawka dobowa lub w dwóch dawkach podzielonych.
Stosowanie u pacjentów w podeszłym wieku
Zalecana początkowa dawka dobowa preparatu ACEON 4 mg dla osób w podeszłym wieku wynosi 4 mg na dobę, podawana w jednej lub dwóch dawkach podzielonych. Doświadczenie ze stosowaniem preparatu ACEON u osób w podeszłym wieku w dawkach przekraczających 8 mg jest ograniczone. Dawki powyżej 8 mg należy podawać z uważnym monitorowaniem ciśnienia krwi i dostosowywaniem dawki [patrz Używaj w określonych populacjach ].
Używaj z diuretykami
pacjentów, którzy są obecnie leczeni lekami moczopędnymi, po podaniu początkowej dawki preparatu ACEON może wystąpić objawowe niedociśnienie. Rozważyć zmniejszenie dawki leku moczopędnego przed rozpoczęciem ACEON [patrz INTERAKCJE Z LEKAMI ].
Stabilna choroba wieńcowa
U pacjentów ze stabilną chorobą wieńcową ACEON 4 mg należy podawać w dawce początkowej 4 mg raz na dobę przez 2 tygodnie, a następnie zwiększać w miarę tolerancji do dawki podtrzymującej 8 mg raz na dobę. U pacjentów w podeszłym wieku (powyżej 70 lat) ACEON należy podawać w dawce 2 mg raz na dobę w pierwszym tygodniu, a następnie 4 mg raz na dobę w drugim tygodniu i 8 mg raz na dobę w dawce podtrzymującej, jeśli jest tolerowana.
Dostosowanie dawki w niewydolności nerek i dializie
Eliminacja peryndoprylatu jest zmniejszona u pacjentów z zaburzeniami czynności nerek. ACEON nie jest zalecany u pacjentów z klirensem kreatyniny
JAK DOSTARCZONE
Formy dawkowania i mocne strony
Tabletki są podłużne z nacięciem po jednej stronie.
Tabletka 2 mg jest biała z wytłoczonym napisem „ACN 2” po stronie bez rowka dzielącego.
Tabletka 4 mg jest różowa z wytłoczonym napisem „ACN 4” po stronie bez rowka dzielącego.
Tabletka 8 mg jest łososiowa z wytłoczonym napisem „ACN 8” po stronie bez rowka dzielącego.
Składowania i stosowania
Tabletki są podłużne z nacięciem po jednej stronie.
Trzymać z dala od dzieci.
Przechowywać w kontrolowanej temperaturze pokojowej 20° do 25°C (68° do 77°F) [patrz USP]. Chronić przed wilgocią.
Aby uzyskać więcej informacji, zadzwoń do naszego działu komunikacji medycznej pod bezpłatny numer 888-985-7657.
Producent: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 USA. Poprawiono: wrzesień 2017
SKUTKI UBOCZNE
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania zdarzeń niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce.
Doświadczenie w badaniach klinicznych
Następujące działania niepożądane omówiono w innym miejscu na etykiecie:
- Reakcje rzekomoanafilaktyczne, w tym obrzęk naczynioruchowy [patrz OSTRZEŻENIA I ŚRODKI ]
- Niedociśnienie [patrz OSTRZEŻENIA I ŚRODKI ]
- Neutropenia i agranulocytoza [patrz OSTRZEŻENIA I ŚRODKI ]
- Upośledzona czynność nerek [patrz OSTRZEŻENIA I ŚRODKI ]
- Hiperkaliemia [patrz OSTRZEŻENIA I ŚRODKI ]
- Kaszel [patrz OSTRZEŻENIA I ŚRODKI ]
Nadciśnienie
Bezpieczeństwo ACEON 4 mg oceniono u około 3400 pacjentów z nadciśnieniem w amerykańskich i zagranicznych badaniach klinicznych. Przedstawione tutaj dane są oparte na wynikach 1417 pacjentów leczonych ACEON, którzy uczestniczyli w badaniach klinicznych w USA. Ponad 220 z tych pacjentów było leczonych ACEON® (erbumina perindoprilu) przez co najmniej rok.
amerykańskich badaniach klinicznych kontrolowanych placebo, częstość przedwczesnego przerwania leczenia z powodu działań niepożądanych wynosiła 6,5% u pacjentów leczonych ACEON 2 mg i 6,7% u pacjentów otrzymujących placebo. Najczęstszymi przyczynami były kaszel, ból głowy, osłabienie i zawroty głowy.
Wśród 1012 pacjentów w badaniach kontrolowanych placebo w Stanach Zjednoczonych, ogólna częstość zgłaszanych zdarzeń niepożądanych była podobna u pacjentów leczonych ACEON i placebo (około 75% w każdej grupie). Jedynymi zdarzeniami niepożądanymi, których częstość występowania po podaniu preparatu ACEON 4 mg była o co najmniej 2% większa niż w przypadku placebo, był kaszel (12% w porównaniu z 4,5%) i ból pleców (5,8% w porównaniu z 3,1%).
Zawroty głowy nie były zgłaszane częściej w grupie perindoprilu (8,2%) niż w grupie placebo (8,5%), ale ich prawdopodobieństwo wzrastało wraz z dawką, co sugeruje związek przyczynowy z perindoprilem.
Stabilna choroba wieńcowa
Bezpieczeństwo peryndoprylu oceniano w badaniu EUROPA, prowadzonym metodą podwójnie ślepej próby, kontrolowanym placebo z udziałem 12218 pacjentów ze stabilną chorobą wieńcową. Ogólny wskaźnik przerwania leczenia wynosił około 22% w przypadku leku i placebo. Najczęstszymi przyczynami medycznymi przerwania leczenia, które występowały częściej w przypadku perindoprilu niż placebo, był kaszel, nietolerancja leku i niedociśnienie.
Doświadczenie postmarketingowe
Dobrowolnie zgłaszane zdarzenia niepożądane u pacjentów przyjmujących ACEON, które pojawiły się od momentu wprowadzenia na rynek i mają nieznany związek przyczynowy z ACEON 8 mg, obejmują: zatrzymanie akcji serca, eozynofilowe zapalenie płuc, neutropenia/agranulocytoza, pancytopenia, niedokrwistość (w tym hemolityczna i aplastyczna), małopłytkowość, ostra niewydolność nerek, zapalenie nerek, niewydolność wątroby, żółtaczka (wątrobowokomórkowa lub cholestatyczna), objawowa hiponatremia, pemfigoid pęcherzowy, pęcherzyca, ostre zapalenie trzustki, upadki, łuszczyca, złuszczające zapalenie skóry i zespół, który może obejmować: bóle stawów/stawów, zapalenie naczyń, zapalenie błony surowiczej, bóle mięśni, gorączkę , wysypka lub inne objawy dermatologiczne, dodatni wynik przeciwciał przeciwjądrowych (ANA), leukocytoza, eozynofilia lub podwyższony wskaźnik sedymentacji erytrocytów (OB).
Wyniki badań laboratoryjnych klinicznych
Hematologia
Niewielkie zmniejszenie stężenia hemoglobiny i hematokrytu często występuje u pacjentów z nadciśnieniem leczonych ACEON 8 mg, ale rzadko ma znaczenie kliniczne. W kontrolowanych badaniach klinicznych żaden pacjent nie przerwał leczenia z powodu rozwoju niedokrwistości. Leukopenia (w tym neutropenia) była obserwowana u 0,1% pacjentów w badaniach klinicznych w USA [patrz OSTRZEŻENIA I ŚRODKI ].
Testy funkcji wątroby
W badaniach klinicznych kontrolowanych placebo obserwowano zwiększenie aktywności AlAT (1,6% ACEON w porównaniu z 0,9% placebo) i AspAT (0,5% ACEON 2 mg w porównaniu z 0,4% placebo). Podwyższenia były na ogół łagodne i przemijające i ustępowały po przerwaniu leczenia.
INTERAKCJE Z LEKAMI
Diuretyki
Pacjenci przyjmujący leki moczopędne, a zwłaszcza ci, którzy rozpoczęli niedawno leczenie, mogą czasami doświadczać nadmiernego obniżenia ciśnienia krwi po rozpoczęciu leczenia preparatem ACEON. Możliwość działania hipotensyjnego można zminimalizować poprzez zmniejszenie dawki lub odstawienie leku moczopędnego lub zwiększenie spożycia soli przed rozpoczęciem leczenia peryndoprylem. Jeśli nie można zmienić leczenia moczopędnego, należy zapewnić ścisłą kontrolę lekarską z pierwszą dawką ACEON przez co najmniej dwie godziny i do czasu ustabilizowania się ciśnienia krwi przez kolejną godzinę [patrz OSTRZEŻENIA I ŚRODKI ].
Jednoczesne stosowanie leków moczopędnych nie wpływa na szybkość i stopień wchłaniania i eliminacji peryndoprylu. Biodostępność peryndoprylatu była jednak zmniejszana przez leki moczopędne, co wiązało się ze zmniejszeniem hamowania ACE w osoczu.
Suplementy potasu i leki moczopędne oszczędzające potas
ACEON 8 mg może zwiększać stężenie potasu w surowicy ze względu na możliwość zmniejszenia produkcji aldosteronu. Stosowanie leków moczopędnych oszczędzających potas (spironolakton, amiloryd, triamteren i inne), suplementów potasu lub innych leków zwiększających stężenie potasu w surowicy (indometacyna, heparyna, cyklosporyna i inne) może zwiększać ryzyko hiperkaliemii. Dlatego też, jeśli wskazane jest jednoczesne stosowanie takich leków, należy często monitorować stężenie potasu w surowicy pacjenta.
Lit
U pacjentów otrzymujących jednocześnie lit i inhibitor ACE zgłaszano zwiększenie stężenia litu w surowicy i objawy toksyczności litu. Zaleca się częste monitorowanie stężenia litu w surowicy. Stosowanie leków moczopędnych może dodatkowo zwiększać ryzyko zatrucia litem.
Złoto
Reakcje po podaniu azotanów (objawy obejmują zaczerwienienie twarzy, nudności, wymioty i niedociśnienie) były rzadko zgłaszane u pacjentów leczonych złotem do wstrzykiwań (aurotiojabłczan sodu) i jednocześnie stosującym inhibitor ACE, w tym ACEON.
Digoksyna
Kontrolowane badanie farmakokinetyczne nie wykazało wpływu na stężenie digoksyny w osoczu podczas jednoczesnego podawania z ACEON, ale nie wykluczono wpływu digoksyny na stężenie peryndoprylu/peryndoprylatu w osoczu.
Gentamycyna
Dane na zwierzętach sugerują możliwość interakcji między peryndoprylem i gentamycyną. Jednak nie zostało to zbadane w badaniach na ludziach.
Niesteroidowe środki przeciwzapalne, w tym selektywne inhibitory cyklooksygenazy-2 (inhibitory COX-2)
U pacjentów w podeszłym wieku, odwodnionych (w tym leczonych diuretykami) lub z zaburzeniami czynności nerek, jednoczesne podawanie NLPZ, w tym selektywnych inhibitorów COX-2, z inhibitorami ACE, w tym peryndoprylem, może spowodować pogorszenie czynności nerek , w tym możliwej ostrej niewydolności nerek. Efekty te są zwykle odwracalne. Okresowo monitorować czynność nerek u pacjentów otrzymujących peryndopryl i NLPZ.
Działanie przeciwnadciśnieniowe inhibitorów ACE, w tym peryndoprylu, może być osłabione przez NLPZ, w tym selektywne inhibitory COX-2.
Podwójna blokada układu renina-angiotensyna (RAS)
Podwójna blokada RAS za pomocą antagonistów receptora angiotensyny, inhibitorów ACE lub aliskirenu wiąże się ze zwiększonym ryzykiem niedociśnienia, hiperkaliemii i zmian w czynności nerek (w tym ostrej niewydolności nerek) w porównaniu z monoterapią. Większość pacjentów otrzymujących kombinację dwóch inhibitorów RAS nie uzyskuje żadnych dodatkowych korzyści w porównaniu z monoterapią. Ogólnie należy unikać łącznego stosowania inhibitorów RAS. Ściśle monitorować ciśnienie krwi, czynność nerek i elektrolity u pacjentów przyjmujących ACEON 2 mg i inne leki wpływające na RAS.
Nie należy podawać aliskirenu jednocześnie z ACEON 8mg u pacjentów z cukrzycą. Należy unikać stosowania aliskirenu z ACEON 2 mg u pacjentów z zaburzeniami czynności nerek (GFR
Inhibitory mTOR
Pacjenci przyjmujący jednocześnie inhibitor mTOR (ssaczy cel rapamycyny) mogą być narażeni na zwiększone ryzyko obrzęku naczynioruchowego [patrz OSTRZEŻENIA I ŚRODKI ].
Inhibitor neprylizyny
Pacjenci przyjmujący jednocześnie inhibitory neprylizyny mogą być narażeni na zwiększone ryzyko obrzęku naczynioruchowego. [Widzieć OSTRZEŻENIA I ŚRODKI ]
OSTRZEŻENIA
Zawarte jako część "ŚRODKI OSTROŻNOŚCI" Sekcja
ŚRODKI OSTROŻNOŚCI
Reakcje rzekomoanafilaktyczne i prawdopodobnie powiązane
Przypuszczalnie dlatego, że inhibitory konwertazy angiotensyny wpływają na metabolizm eikozanoidów i polipeptydów, w tym endogennej bradykininy, pacjenci otrzymujący inhibitory ACE (w tym ACEON) mogą być narażeni na różne zdarzenia niepożądane, niektóre z nich poważne. Pacjenci rasy czarnej otrzymujący inhibitory ACE mają większą częstość występowania obrzęku naczynioruchowego w porównaniu z osobami innych ras.
Obrzęk naczynioruchowy głowy i szyi
pacjentów leczonych inhibitorami ACE, w tym ACEON, zgłaszano obrzęk naczynioruchowy twarzy, kończyn, warg, języka, głośni lub krtani (0,1% pacjentów leczonych ACEON w badaniach klinicznych w USA). Obrzęk naczynioruchowy związany z zajęciem języka, głośni lub krtani może być śmiertelny. W takich przypadkach należy natychmiast przerwać leczenie preparatem ACEON i obserwować do ustąpienia obrzęku. Jeśli zajęcie języka, głośni lub krtani może spowodować niedrożność dróg oddechowych, należy niezwłocznie zastosować odpowiednią terapię, taką jak podskórny roztwór adrenaliny 1:1000 (0,3 do 0,5 ml).
Pacjenci przyjmujący jednocześnie inhibitor mTOR (np. temsyrolimus) lub inhibitor neprylizyny mogą być narażeni na zwiększone ryzyko obrzęku naczynioruchowego [patrz INTERAKCJE Z LEKAMI ].
Obrzęk naczynioruchowy jelit
pacjentów leczonych inhibitorami ACE zgłaszano obrzęk naczynioruchowy jelit. Pacjenci ci zgłaszali się z bólem brzucha (z nudnościami lub wymiotami lub bez nich); w niektórych przypadkach nie było wcześniej obrzęku naczynioruchowego twarzy, a poziomy C-1 esterazy były prawidłowe. Obrzęk naczynioruchowy rozpoznano za pomocą takich procedur, jak tomografia komputerowa jamy brzusznej, USG lub zabieg chirurgiczny, a objawy ustąpiły po odstawieniu inhibitora ACE. Obrzęk naczynioruchowy jelit należy uwzględnić w diagnostyce różnicowej pacjentów z bólami brzucha leczonych inhibitorami ACE.
Niedociśnienie
ACEON 4mg może powodować objawowe niedociśnienie. ACEON był związany z niedociśnieniem u 0,3% pacjentów z niepowikłanym nadciśnieniem w amerykańskich badaniach kontrolowanych placebo. Objawy związane z hipotonią ortostatyczną zgłoszono u kolejnych 0,8% pacjentów.
Objawowe niedociśnienie jest najbardziej prawdopodobne u pacjentów odwodnionych lub odwodnionych w wyniku długotrwałego leczenia moczopędnego, ograniczenia soli w diecie, dializy, biegunki lub wymiotów [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Inhibitory ACE mogą powodować nadmierne niedociśnienie i mogą być związane ze skąpomoczem lub azotemią, a rzadko z ostrą niewydolnością nerek i śmiercią. U pacjentów z chorobą niedokrwienną serca lub chorobą naczyń mózgowych nadmierny spadek ciśnienia krwi może spowodować zawał mięśnia sercowego lub udar naczyniowy mózgu.
U pacjentów zagrożonych nadmiernym niedociśnieniem terapię ACEON należy rozpoczynać pod bardzo ścisłą kontrolą lekarską. Pacjenci powinni pozostawać pod ścisłą obserwacją przez pierwsze dwa tygodnie leczenia oraz za każdym razem, gdy dawka ACEON 2 mg i (lub) leku moczopędnego zostanie zwiększona.
przypadku wystąpienia nadmiernego niedociśnienia należy natychmiast ułożyć pacjenta na plecach i w razie potrzeby podać dożylną infuzję soli fizjologicznej. Leczenie preparatem ACEON 4 mg można zwykle kontynuować po przywróceniu objętości i ciśnienia krwi.

Neutropenia/agranulocytoza
Inhibitory ACE są związane z agranulocytozą i zahamowaniem czynności szpiku kostnego, najczęściej u pacjentów z zaburzeniami czynności nerek, zwłaszcza u pacjentów z kolagenową chorobą naczyń, taką jak toczeń rumieniowaty układowy lub twardzina skóry.
Toksyczność płodu
Kategoria ciąży D
Stosowanie leków działających na układ renina-angiotensyna w drugim i trzecim trymestrze ciąży zmniejsza czynność nerek płodu oraz zwiększa śmiertelność i śmiertelność płodu i noworodka. Powstałe małowodzie może być związane z hipoplazją płuc płodu i deformacjami szkieletu. Potencjalne działania niepożądane u noworodków obejmują hipoplazję czaszki, bezmocz, niedociśnienie, niewydolność nerek i zgon. W przypadku wykrycia ciąży należy jak najszybciej przerwać stosowanie preparatu ACEON 4 mg [patrz Używaj w określonych populacjach ].
Upośledzona funkcja nerek
W wyniku hamowania układu renina-angiotensyna-aldosteron można spodziewać się zmian w czynności nerek u osób wrażliwych. U pacjentów otrzymujących ACEON należy okresowo monitorować czynność nerek [patrz DAWKOWANIE I SPOSÓB PODAWANIA ], [Widzieć INTERAKCJE Z LEKAMI ].
pacjentów z ciężką zastoinową niewydolnością serca, gdzie czynność nerek może zależeć od aktywności układu renina-angiotensynaaldosteron, leczenie inhibitorami ACE, w tym ACEON, może wiązać się ze skąpomoczem, postępującą azotemią i, rzadko, ostrą niewydolnością nerek i zgonem.
U pacjentów z nadciśnieniem tętniczym i jednostronnym lub obustronnym zwężeniem tętnicy nerkowej może wystąpić zwiększenie stężenia azotu mocznikowego we krwi i kreatyniny w surowicy; zwykle odwracalne po odstawieniu inhibitora ACE. U takich pacjentów w ciągu pierwszych kilku tygodni leczenia należy monitorować czynność nerek.
U niektórych pacjentów leczonych preparatem ACEON wystąpił nieznaczny i przemijający wzrost stężenia azotu mocznikowego we krwi i kreatyniny w surowicy, zwłaszcza u pacjentów leczonych jednocześnie lekami moczopędnymi.
Hiperkaliemia
niektórych pacjentów leczonych inhibitorami ACE, w tym ACEON, obserwowano zwiększenie stężenia potasu w surowicy. W większości przypadków były pojedyncze pojedyncze wartości, które nie wydawały się istotne klinicznie i rzadko były powodem do wycofania. Czynniki ryzyka rozwoju hiperkaliemii obejmują niewydolność nerek, cukrzycę i jednoczesne stosowanie leków, takich jak leki moczopędne oszczędzające potas, suplementy potasu i/lub substytuty soli zawierające potas [patrz INTERAKCJE Z LEKAMI ].
U pacjentów otrzymujących ACEON należy okresowo kontrolować stężenie potasu w surowicy.
Kaszel
Przypuszczalnie z powodu zahamowania rozkładu endogennej bradykininy, po wszystkich inhibitorach ACE zgłaszano uporczywy kaszel nieproduktywny, ustępujący na ogół po przerwaniu leczenia. Rozważ kaszel wywołany inhibitorem ACE w diagnostyce różnicowej kaszlu.
Niewydolność wątroby
Rzadko inhibitory ACE są związane z zespołem, który zaczyna się od żółtaczki cholestatycznej i rozwija się do piorunującej martwicy wątroby, a czasem do śmierci. Mechanizm tego zespołu nie jest poznany. Pacjenci otrzymujący inhibitory ACE, u których wystąpi żółtaczka lub znaczne zwiększenie aktywności enzymów wątrobowych, powinni odstawić inhibitor ACE i poddać się odpowiedniej obserwacji lekarskiej.
Chirurgia/znieczulenie
U pacjentów poddawanych zabiegom chirurgicznym lub podczas znieczulenia środkami wywołującymi niedociśnienie, ACEON może blokować tworzenie angiotensyny II, które w innym przypadku wystąpiłoby wtórnie do kompensacyjnego uwalniania reniny. Niedociśnienie przypisywane temu mechanizmowi można skorygować poprzez zwiększenie objętości.
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Rakotwórczość
Nie zaobserwowano dowodów działania rakotwórczego w badaniach na szczurach i myszach, gdy perindopril podawano w dawkach do 20-krotności (mg/kg) lub 2 do 4-krotności (mg/m2) maksymalnej proponowanej dawki klinicznej (16 mg/dobę) dla 104 tygodnie.
Mutageneza
różnych badaniach in vitro i in vivo, w tym w teście Amesa, teście Saccharomyces cerevisiae D4, hodowanych ludzkich limfocytach, teście chłoniaka TK ± myszy, testach mikrojądrowych myszy i szczurów oraz u chomika chińskiego nie wykryto potencjału genotoksycznego dla ACEON, peryndoprylatu i innych metabolitów test szpiku kostnego.
Upośledzenie płodności
Nie stwierdzono znaczącego wpływu na zdolności rozrodcze lub płodność u szczurów, którym podano do 30-krotności (mg/kg) lub 6-krotności (mg/m2) proponowanej maksymalnej dawki klinicznej ACEON 2 mg w okresie spermatogenezy u samców lub oogenezy i ciąży u kobiet.
Używaj w określonych populacjach
Ciąża
Ciąża Kategoria D [patrz PUDEŁKO OSTRZEŻENIE oraz OSTRZEŻENIA I ŚRODKI ].
Stosowanie leków działających na układ renina-angiotensyna w drugim i trzecim trymestrze ciąży zmniejsza czynność nerek płodu oraz zwiększa śmiertelność i śmiertelność płodu i noworodka. Powstałe małowodzie może być związane z hipoplazją płuc płodu i deformacjami szkieletu. Potencjalne działania niepożądane u noworodków obejmują hipoplazję czaszki, bezmocz, niedociśnienie, niewydolność nerek i zgon. W przypadku wykrycia ciąży należy jak najszybciej odstawić ACEON. Te niekorzystne skutki są zwykle związane ze stosowaniem tych leków w drugim i trzecim trymestrze ciąży. W większości badań epidemiologicznych oceniających nieprawidłowości płodu po ekspozycji na leki hipotensyjne w pierwszym trymestrze nie odróżniano leków wpływających na układ renina-angiotensyna od innych leków hipotensyjnych.
Odpowiednie leczenie nadciśnienia u matki w czasie ciąży jest ważne dla optymalizacji wyników zarówno dla matki, jak i płodu.
nietypowym przypadku, gdy nie ma odpowiedniej alternatywy dla terapii lekami wpływającymi na układ renina-angiotensyna dla konkretnego pacjenta, należy uprzedzić matkę o potencjalnym ryzyku dla płodu. Wykonuj seryjne badania ultrasonograficzne w celu oceny środowiska wewnątrzowodniowego. W przypadku zaobserwowania małowodzia należy odstawić ACEON 2 mg, chyba że uzna się to za ratowanie życia matki. Testy płodu mogą być odpowiednie w zależności od tygodnia ciąży. Pacjenci i lekarze powinni być jednak świadomi, że małowodzie może pojawić się dopiero po nieodwracalnym uszkodzeniu płodu. Uważnie obserwuj niemowlęta z historią ekspozycji in utero na ACEON pod kątem niedociśnienia, skąpomoczu i hiperkaliemii [patrz Zastosowanie pediatryczne ].
Radioaktywność była wykrywalna u płodów po podaniu 14C-perindoprilu ciężarnym szczurom.
Matki karmiące
Mleko karmiących szczurów zawierało radioaktywność po podaniu 14C-perindoprilu. Nie wiadomo, czy perindopril przenika do mleka ludzkiego. Ponieważ wiele leków wydzielanych jest do mleka ludzkiego, należy zachować ostrożność podając preparat ACEON matkom karmiącym.
Zastosowanie pediatryczne
Noworodki z historią ekspozycji w macicy na ACEON
W przypadku wystąpienia skąpomoczu lub niedociśnienia należy zwrócić uwagę na wspomaganie ciśnienia krwi i perfuzji nerek. Transfuzje wymienne lub dializy mogą być wymagane jako sposób odwrócenia niedociśnienia i/lub zastąpienia zaburzeń czynności nerek. Peryndopryl, który przenika przez łożysko, może teoretycznie zostać usunięty z krążenia noworodka w ten sposób, ale ograniczone doświadczenie nie wykazało, że takie usuwanie ma kluczowe znaczenie w leczeniu tych niemowląt.
Bezpieczeństwo i skuteczność ACEON 8 mg u dzieci nie zostały ustalone.
Zastosowanie geriatryczne
Średni wpływ peryndoprylu na ciśnienie krwi był nieco mniejszy u pacjentów po 60. roku życia niż u młodszych pacjentów, chociaż różnica nie była istotna. Stężenia peryndoprylu i peryndoprylatu w osoczu były zwiększone u pacjentów w podeszłym wieku w porównaniu ze stężeniami u młodszych pacjentów. U starszych pacjentów nie wystąpiły wyraźnie nasilone działania niepożądane, z wyjątkiem zawrotów głowy i możliwej wysypki.
Zacznij od małej dawki i miareczkuj powoli w razie potrzeby. Monitoruj zawroty głowy z powodu możliwości upadków.
Doświadczenie ze stosowaniem preparatu ACEON 8 mg u pacjentów w podeszłym wieku w dawkach dobowych przekraczających 8 mg jest ograniczone.
Zaburzenia czynności nerek
U pacjentów z zaburzeniami czynności nerek może być konieczne dostosowanie dawkowania [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz FARMAKOLOGIA KLINICZNA ].
Niewydolność wątroby
Biodostępność peryndoprylatu jest zwiększona u pacjentów z zaburzeniami czynności wątroby [patrz FARMAKOLOGIA KLINICZNA ].
PRZEDAWKOWAĆ
zwierząt dawki perindoprilu do 2500 mg/kg u myszy, 3000 mg/kg u szczurów i 1600 mg/kg u psów nie były śmiertelne. Wcześniejsze doświadczenia były skąpe, ale sugerowały, że przedawkowanie innych inhibitorów ACE było również dość dobrze tolerowane przez ludzi. Najbardziej prawdopodobnym objawem jest niedociśnienie, a leczenie powinno być objawowe i podtrzymujące. Należy przerwać terapię inhibitorem ACE i obserwować pacjenta. Odwodnienie, zaburzenia równowagi elektrolitowej i niedociśnienie należy leczyć zgodnie z ustalonymi procedurami.
Wśród zgłoszonych przypadków przedawkowania peryndoprylu pacjenci, o których wiadomo, że przyjęli dawkę od 80 mg do 120 mg, wymagali wspomaganej wentylacji i wspomagania krążenia. Jeden dodatkowy pacjent rozwinął hipotermię, zatrzymanie krążenia i zmarł po spożyciu do 180 mg perindoprilu. Interwencja w przypadku przedawkowania peryndoprylu może wymagać energicznego wsparcia.
Laboratoryjne oznaczenia stężeń perindoprilu i jego metabolitów w surowicy nie są powszechnie dostępne, a takie oznaczenia w każdym razie nie mają ustalonej roli w postępowaniu w przypadku przedawkowania perindoprilu.
Brak dostępnych danych sugerujących manewry fizjologiczne (np. manewry mające na celu zmianę pH moczu), które mogłyby przyspieszyć eliminację peryndoprylu i jego metabolitów. Perindopril można usunąć za pomocą hemodializy, z klirensem 52 ml/min dla perindoprilu i 67 ml/min dla perindoprilatu.
Angiotensyna II mogłaby prawdopodobnie służyć jako swoisty antagonista-antidotum w przypadku przedawkowania perindoprilu, ale angiotensyna II jest zasadniczo niedostępna poza rozproszonymi ośrodkami badawczymi. Ponieważ działanie hipotensyjne peryndoprylu uzyskuje się poprzez rozszerzenie naczyń krwionośnych i skuteczną hipowolemię, uzasadnione jest leczenie przedawkowania peryndoprylu poprzez infuzję normalnego roztworu soli fizjologicznej.
PRZECIWWSKAZANIA
ACEON® (perindopril erbumine) jest przeciwwskazany u pacjentów, u których stwierdzono nadwrażliwość (w tym obrzęk naczynioruchowy) na ten produkt lub jakikolwiek inny inhibitor ACE. ACEON 4 mg jest również przeciwwskazany u pacjentów z dziedzicznym lub idiopatycznym obrzękiem naczynioruchowym.
Nie należy podawać aliskirenu jednocześnie z ACEON u pacjentów z cukrzycą. [Widzieć INTERAKCJE Z LEKAMI ]
ACEON jest przeciwwskazany w połączeniu z inhibitorem neprylizyny (np. sakubitryl). Nie należy podawać preparatu ACEON 8 mg w ciągu 36 godzin od zmiany na sakubitryl/walsartan, inhibitora neprylizyny lub z sakubitrylu/walsartanu [patrz OSTRZEŻENIA I ŚRODKI ].
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
ACEON® (perindopril erbumine) jest prolekiem perindoprilatu, który hamuje ACE u ludzi i zwierząt. Uważa się, że mechanizm, poprzez który perindoprylat obniża ciśnienie krwi, polega przede wszystkim na hamowaniu aktywności ACE. ACE jest dipeptydazą peptydylową, która katalizuje konwersję nieaktywnego dekapeptydu, angiotensyny I, do środka zwężającego naczynia, angiotensyny II. Angiotensyna II jest silnym środkiem zwężającym naczynia obwodowe, który stymuluje wydzielanie aldosteronu przez korę nadnerczy i zapewnia negatywną informację zwrotną na wydzielanie reniny. Hamowanie ACE powoduje zmniejszenie stężenia angiotensyny II w osoczu, co prowadzi do zmniejszenia skurczu naczyń, zwiększenia aktywności reninowej osocza i zmniejszenia wydzielania aldosteronu. To ostatnie powoduje diurezę i natriurezę i może być związane z niewielkim wzrostem stężenia potasu w surowicy.
ACE jest identyczny z kininazą II, enzymem rozkładającym bradykininę. Pozostaje do wyjaśnienia, czy zwiększone poziomy bradykininy, silnego peptydu wazodepresyjnego, odgrywają rolę w działaniu terapeutycznym ACEON 4 mg.
Chociaż uważa się, że główny mechanizm obniżania ciśnienia krwi przez perindopril odbywa się za pośrednictwem układu renina-angiotensinaldosteron, inhibitory ACE mają pewien wpływ nawet w pozornym nadciśnieniu niskoreninowym. Peryndopryl badano u stosunkowo niewielu pacjentów rasy czarnej, zwykle w populacji o niskiej zawartości reniny, a średnia odpowiedź rozkurczowego ciśnienia krwi na peryndopryl stanowiła około połowę odpowiedzi obserwowanej u pacjentów innych ras, co jest zgodne z wcześniejszym doświadczeniem dotyczącym innych inhibitorów ACE.
Farmakodynamika
Po podaniu peryndoprylu ACE ulega zahamowaniu w sposób zależny od dawki i stężenia we krwi, przy czym maksymalne hamowanie 80 do 90% osiągane po podaniu 8 mg utrzymuje się przez 10 do 12 godzin. Dwudziestoczterogodzinne hamowanie ACE wynosi około 60% po tych dawkach. Stopień hamowania ACE osiągnięty przez daną dawkę wydaje się zmniejszać z czasem (wzrost ID50). Odpowiedź presyjna na wlew angiotensyny I jest zmniejszona przez perindopril, ale efekt ten nie jest tak trwały jak wpływ na ACE; po 24 godzinach po podaniu dawki 12 mg następuje około 35% zahamowanie.
Farmakokinetyka
Wchłanianie
Po podaniu doustnym ACEON maksymalne stężenie w osoczu występuje po około 1 godzinie. Całkowita biodostępność peryndoprylu po podaniu doustnym wynosi około 75%. Po wchłonięciu około 30 do 50% ogólnoustrojowo dostępnego peryndoprylu jest hydrolizowane do aktywnego metabolitu peryndoprylatu, którego średnia biodostępność wynosi około 25%. Maksymalne stężenie peryndoprylatu w osoczu osiągane jest 3 do 7 godzin po podaniu peryndoprylu. Doustne podawanie produktu ACEON 8 mg z posiłkiem nie zmniejsza znacząco szybkości ani stopnia wchłaniania peryndoprylu w porównaniu ze stanem na czczo. Jednak stopień biotransformacji peryndoprylu do aktywnego metabolitu, peryndoprylatu, jest zmniejszony o około 43%, co powoduje zmniejszenie krzywej hamowania ACE w osoczu o około 20%, prawdopodobnie nieistotne klinicznie. W badaniach klinicznych peryndopryl podawano na ogół nie na czczo.
Przy dawkach 4 mg, 8 mg i 16 mg ACEONu, Cmax i AUC peryndoprylu i peryndoprylatu wzrastają proporcjonalnie do dawki zarówno po jednorazowym podaniu doustnym, jak i w stanie stacjonarnym w schemacie wielokrotnego dawkowania raz na dobę.
Dystrybucja
Około 60% krążącego peryndoprylu wiąże się z białkami osocza, a tylko 10 do 20% peryndoprylatu jest związane. Dlatego nie przewiduje się interakcji leków, w których pośredniczy wpływ na wiązanie z białkami.
Metabolizm i eliminacja
Po podaniu doustnym peryndopryl wykazuje farmakokinetykę wieloprzedziałową, w tym głęboki przedział tkankowy (miejsca wiązania ACE). Średni okres półtrwania peryndoprylu związany z większością jego eliminacji wynosi około 0,8 do 1 godziny.
Peryndopryl jest intensywnie metabolizowany po podaniu doustnym, a jedynie 4 do 12% dawki jest wydalane w postaci niezmienionej w moczu. Zidentyfikowano sześć metabolitów powstających w wyniku hydrolizy, glukuronidacji i cyklizacji poprzez odwodnienie. Należą do nich aktywny inhibitor ACE, peryndopryl (hydrolizowany perindopril), glukuronidy perindoprilu i perindoprilatu, peryndopryl odwodniony i diastereoizomery perindoprilatu odwodnionego. Wydaje się, że u ludzi za hydrolizę perindoprilu odpowiedzialna jest esteraza wątrobowa.
Aktywny metabolit, peryndoprylat, wykazuje również farmakokinetykę wielokompartmentową po doustnym podaniu ACEON. Tworzenie się peryndoprylatu jest stopniowe, a maksymalne stężenie w osoczu występuje pomiędzy 3 a 7 godzinami. Późniejszy spadek stężenia w osoczu wykazuje pozorny średni okres półtrwania wynoszący 3 do 10 godzin dla większości eliminacji, z wydłużonym okresem półtrwania w końcowej fazie eliminacji wynoszącym 30 do 120 godzin wynikającym z powolnej dysocjacji peryndoprylatu z wiązania ACE z osoczem/tkankami witryny. Podczas wielokrotnego doustnego podawania peryndoprylu raz na dobę, peryndoprylat kumuluje się około 1,5 do 2 razy i osiąga stan stacjonarny w osoczu w ciągu 3 do 6 dni. Klirens peryndoprylatu i jego metabolitów zachodzi prawie wyłącznie w nerkach.
Osoby starsze
Stężenia peryndoprylu i peryndoprylatu w osoczu u pacjentów w podeszłym wieku (powyżej 70 lat) są około dwukrotnie większe niż obserwowane u młodszych pacjentów, co odzwierciedla zarówno zwiększoną konwersję peryndoprylu do peryndoprylatu, jak i zmniejszone wydalanie peryndoprylatu przez nerki [patrz DAWKOWANIE I SPOSÓB PODAWANIA oraz Używaj w określonych populacjach ].
Niewydolność serca
Klirens peryndoprylatu jest zmniejszony u pacjentów z zastoinową niewydolnością serca, co skutkuje zwiększeniem AUC pomiędzy dawkami o 40%.
Zaburzenia czynności nerek
Przy dawkach peryndoprylu od 2 mg do 4 mg, AUC peryndoprylatu wzrasta wraz ze zmniejszaniem się czynności nerek. Przy klirensach kreatyniny od 30 do 80 ml/min, AUC jest około dwukrotnie większe niż przy 100 ml/min. Gdy klirens kreatyniny spada poniżej 30 ml/min, AUC wzrasta wyraźniej.
U ograniczonej liczby badanych pacjentów klirens peryndoprylu podczas dializy wynosił od około 40 do 80 ml/min. Klirens peryndoprylatu podczas dializy wahał się od około 40 do 90 ml/min [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Niewydolność wątroby
Biodostępność peryndoprylatu jest zwiększona u pacjentów z zaburzeniami czynności wątroby. Stężenia peryndoprylatu w osoczu u pacjentów z zaburzeniami czynności wątroby były o około 50% większe niż u osób zdrowych lub pacjentów z nadciśnieniem i prawidłową czynnością wątroby.
Studia kliniczne
Nadciśnienie
kontrolowanych placebo badaniach monoterapii peryndoprylem (2 mg do 16 mg raz na dobę) u pacjentów ze średnim ciśnieniem krwi około 150/100 mm Hg, 2 mg wywierało niewielki wpływ, ale dawki 4 mg do 16 mg obniżały ciśnienie krwi. Dawki 8 mg i 16 mg były nie do odróżnienia i obie miały większy efekt niż dawka 4 mg. W tych badaniach dawki 8 mg i 16 mg dziennie dawały efekt w pozycji leżącej, obniżając ciśnienie krwi o 9 do 15/5 do 6 mm Hg. Gdy porównano dawkowanie raz dziennie i dwa razy dziennie, schemat dawkowania dwa razy dziennie był ogólnie nieco lepszy, ale nie więcej niż około 0,5 mm Hg do 1 mm Hg. Po dawkach 2 mg do 16 mg perindoprilu, minimalne średnie skurczowe i rozkurczowe ciśnienie krwi wyniosły około 75 do 100% efektów szczytowych.
Wpływ peryndoprylu na ciśnienie krwi był podobny, gdy był podawany w monoterapii lub na tle 25 mg hydrochlorotiazydu. Ogólnie działanie peryndoprylu wystąpiło szybko, przy czym jego działanie nieznacznie narastało w ciągu kilku tygodni.
Formalne badania interakcji ACEON® (perindopril erbumine) nie zostały przeprowadzone ze środkami przeciwnadciśnieniowymi innymi niż tiazydy. Ograniczone doświadczenie w kontrolowanych i niekontrolowanych badaniach, w których podawano ACEON 2 mg jednocześnie z blokerem kanału wapniowego, diuretykiem pętlowym lub terapią potrójną (beta-bloker, środek rozszerzający naczynia krwionośne i diuretyk), nie sugeruje żadnych nieoczekiwanych interakcji. Ogólnie rzecz biorąc, inhibitory ACE mają mniej niż addytywne działanie, gdy są podawane z blokerami beta-adrenergicznymi, prawdopodobnie dlatego, że oba działają częściowo poprzez układ renina-angiotensyna.
W niekontrolowanych badaniach u pacjentów z cukrzycą insulinozależną, peryndopryl nie wpływał na kontrolę glikemii. W przypadku długotrwałego stosowania u tych pacjentów nie zaobserwowano wpływu na wydalanie białek z moczem.
Na skuteczność preparatu ACEON 4 mg nie miała wpływu płeć i był on mniej skuteczny u pacjentów rasy czarnej niż u pacjentów innych ras. U pacjentów w podeszłym wieku (powyżej lub równej 60. roku życia) średni wpływ ciśnienia tętniczego był nieco mniejszy niż u młodszych pacjentów, chociaż różnica nie była istotna.
Stabilna choroba wieńcowa
Europejskie badanie dotyczące zmniejszenia częstości występowania incydentów sercowych produktem Perindopril w stabilnej chorobie wieńcowej (EUROPA) było wieloośrodkowym, randomizowanym badaniem z podwójnie ślepą próbą i grupą kontrolną placebo, przeprowadzonym z udziałem 12 218 pacjentów, u których stwierdzono stabilną chorobę wieńcową bez klinicznej niewydolności serca. Pacjenci mieli dowody choroby wieńcowej udokumentowane przez przebyty zawał mięśnia sercowego ponad 3 miesiące przed badaniem przesiewowym, rewaskularyzację wieńcową ponad 6 miesięcy przed badaniem przesiewowym, angiograficzne dowody zwężenia (co najmniej 70% zwężenie jednej lub więcej głównych tętnic wieńcowych) lub dodatni stres test u mężczyzn z historią bólu w klatce piersiowej. Po czterotygodniowym okresie wstępnym, podczas którego wszyscy pacjenci otrzymywali peryndopryl w dawce 2 mg do 8 mg, pacjenci zostali losowo przydzieleni do grupy otrzymującej perindopril 8 mg raz na dobę (n=6110) lub odpowiadające placebo (n=6108). Średni czas obserwacji wyniósł 4,2 roku. W badaniu oceniano odległy wpływ perindoprilu na czas do pierwszego zdarzenia zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego niezakończonego zgonem lub zatrzymania akcji serca u pacjentów ze stabilną chorobą wieńcową.
Średni wiek pacjentów wynosił 60 lat; 85% stanowili mężczyźni, 92% przyjmowało inhibitory płytek krwi, 63% przyjmowało β-adrenolityki, a 56% przyjmowało leczenie hipolipemizujące. Badanie EUROPA wykazało, że perindopril znacząco zmniejsza względne ryzyko wystąpienia zdarzeń pierwszorzędowego punktu końcowego (Tabela 1). Ten korzystny efekt można w dużej mierze przypisać zmniejszeniu ryzyka zawału mięśnia sercowego niezakończonego zgonem. Ten korzystny wpływ perindoprilu na pierwszorzędowy punkt końcowy był widoczny po około roku leczenia (ryc. 1). Wynik był podobny we wszystkich predefiniowanych podgrupach według wieku, choroby podstawowej lub jednocześnie stosowanych leków (ryc. 2).
Rycina 1. Czas do pierwszego wystąpienia pierwszorzędowego punktu końcowego 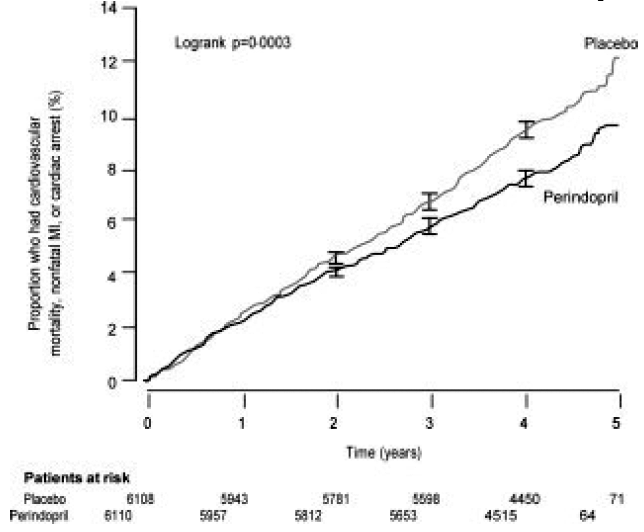
Rycina 2. Korzystny wpływ leczenia peryndoprylem na pierwszorzędowy punkt końcowy w predefiniowanych podgrupach 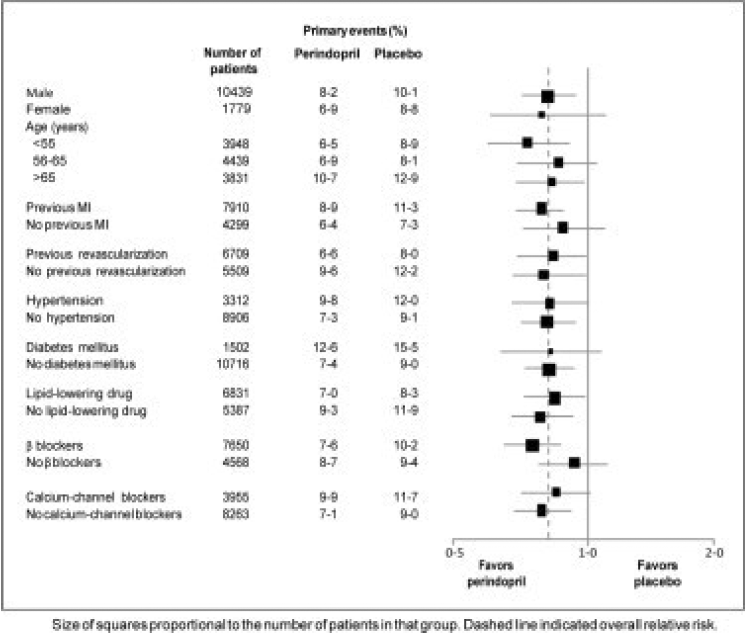
INFORMACJA O PACJENCIE
Pacjentki w wieku rozrodczym należy poinformować o konsekwencjach narażenia na ACEON 2 mg podczas ciąży. Omów możliwości leczenia z kobietami planującymi ciążę. Pacjentki należy poprosić o jak najszybsze zgłoszenie ciąży swoim lekarzom.
Należy poinformować pacjentów, aby niezwłocznie zgłaszali wszelkie oznaki infekcji (np. ból gardła, gorączka), które mogą być oznaką neutropenii.
