Avapro 150mg, 300mg Irbesartan Zastosowanie, skutki uboczne i dawkowanie. Cena w aptece internetowej. Leki generyczne bez recepty.
Co to jest Avapro 300mg i jak się go stosuje?
Avapro 300mg to lek na receptę stosowany w leczeniu objawów wysokiego ciśnienia krwi (nadciśnienia), bólu nerwów wywołanych cukrzycą typu 2. Avapro może być stosowany samodzielnie lub z innymi lekami.
Avapro 300mg należy do klasy leków ARB.
Nie wiadomo, czy Avapro 150mg jest bezpieczny i skuteczny u dzieci w wieku poniżej 6 lat.
Jakie są możliwe skutki uboczne Avapro 300mg?
Avapro może powodować poważne skutki uboczne, w tym:
- niewyjaśniony ból mięśni,
- tkliwość lub słabość,
- gorączka,
- niezwykłe zmęczenie,
- ciemny kolor moczu,
- zawroty,
- małe lub brak oddawania moczu,
- obrzęk,
- szybki przyrost masy ciała,
- dezorientacja,
- utrata apetytu,
- wymioty i
- ból w boku lub w dolnej części pleców
Natychmiast uzyskaj pomoc medyczną, jeśli wystąpi którykolwiek z wymienionych powyżej objawów.
Najczęstsze skutki uboczne Avapro to:
- biegunka,
- zgaga,
- rozstrój żołądka i
- uczucie zmęczenia
Poinformuj lekarza, jeśli wystąpią jakiekolwiek skutki uboczne, które Ci przeszkadzają lub które nie ustępują.
To nie wszystkie możliwe skutki uboczne Avapro. Aby uzyskać więcej informacji, skontaktuj się z lekarzem lub farmaceutą.
Zadzwoń do lekarza, aby uzyskać poradę medyczną na temat skutków ubocznych. Możesz zgłosić skutki uboczne do FDA pod numerem 1-800-FDA-1088.
OSTRZEŻENIE
TOKSYCZNOŚĆ PŁODU
- przypadku wykrycia ciąży należy jak najszybciej odstawić AVAPRO.
- Leki działające bezpośrednio na układ renina-angiotens w organizmie mogą spowodować obrażenia i śmierć rozwijającego się płodu [patrz OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI].
OPIS
AVAPRO (irbesartan) jest antagonistą receptora angiotensyny II (podtyp AT1).
Irbesartan jest związkiem niepeptydowym, chemicznie opisanym jako 2-butyl-3-[p-(o-1H-tetrazol-5-ilofenylo)benzylo]-1,3-diazaspiro[4.4]non-1-en-4 -jeden.
Jego wzór empiryczny to C25H28N6O, a wzór strukturalny:
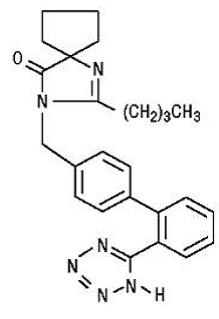
Irbesartan jest krystalicznym proszkiem o barwie od białej do białawej o masie cząsteczkowej 428,5. Jest to związek niepolarny o współczynniku podziału (oktanol/woda) 10,1 przy pH 7,4. Irbesartan jest słabo rozpuszczalny w alkoholu i chlorku metylenu i praktycznie nierozpuszczalny w wodzie.
AVAPRO jest dostępny do podawania doustnego w tabletkach bez rowka dzielącego, zawierających 75 mg, 150 mg lub 300 mg irbesartanu. Składniki nieaktywne to: laktoza, celuloza mikrokrystaliczna, wstępnie żelowana skrobia, kroskarmeloza sodowa, poloksamer 188, dwutlenek krzemu i stearynian magnezu.
WSKAZANIA
Nadciśnienie
AVAPRO® jest wskazany w leczeniu nadciśnienia, w celu obniżenia ciśnienia krwi. Obniżenie ciśnienia krwi zmniejsza ryzyko śmiertelnych i niezakończonych zgonem zdarzeń sercowo-naczyniowych (CV), głównie udarów i zawału mięśnia sercowego. Korzyści te zaobserwowano w kontrolowanych badaniach leków przeciwnadciśnieniowych z wielu różnych klas farmakologicznych, w tym tego leku.
Kontrola wysokiego ciśnienia krwi powinna być częścią kompleksowego zarządzania ryzykiem sercowo-naczyniowym, w tym, w stosownych przypadkach, kontroli lipidów, leczenia cukrzycy, leczenia przeciwzakrzepowego, zaprzestania palenia, ćwiczeń i ograniczonego spożycia sodu. Wielu pacjentów będzie wymagało więcej niż 1 leku, aby osiągnąć cele dotyczące ciśnienia krwi. Aby uzyskać szczegółowe porady dotyczące celów i zarządzania, zobacz opublikowane wytyczne, takie jak wytyczne Wspólnego Narodowego Komitetu ds. Zapobiegania, Wykrywania, Oceny i Leczenia Wysokiego Ciśnienia Krwi (National High Blood Pressure Education Program's Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure).
randomizowanych kontrolowanych badaniach klinicznych wykazano, że liczne leki przeciwnadciśnieniowe z różnych klas farmakologicznych i o różnych mechanizmach działania zmniejszają chorobowość i śmiertelność sercowo-naczyniową, i można wywnioskować, że jest to obniżenie ciśnienia krwi, a nie jakaś inna właściwość farmakologiczna leki, które są w dużej mierze odpowiedzialne za te korzyści. Największą i najbardziej spójną korzyścią dla sercowo-naczyniowych punktów końcowych było zmniejszenie ryzyka udaru mózgu, ale regularnie obserwowano również zmniejszenie zawału mięśnia sercowego i śmiertelności z przyczyn sercowo-naczyniowych.
Podwyższone ciśnienie skurczowe lub rozkurczowe powoduje zwiększone ryzyko sercowo-naczyniowe, a bezwzględny wzrost ryzyka na mmHg jest większy przy wyższym ciśnieniu krwi, tak że nawet niewielkie zmniejszenie ciężkiego nadciśnienia może przynieść znaczne korzyści. Zmniejszenie względnego ryzyka wynikającego z obniżenia ciśnienia krwi jest podobne w populacjach o różnym ryzyku bezwzględnym, więc bezwzględna korzyść jest większa u pacjentów z wyższym ryzykiem niezależnie od nadciśnienia tętniczego (na przykład pacjenci z cukrzycą lub hiperlipidemią) i takich pacjentów można oczekiwać aby skorzystać z bardziej agresywnego leczenia w celu obniżenia ciśnienia krwi.
Niektóre leki przeciwnadciśnieniowe mają mniejszy wpływ na ciśnienie krwi (jako monoterapia) u pacjentów rasy czarnej, a wiele leków przeciwnadciśnieniowych ma dodatkowe zatwierdzone wskazania i działania (np. na dusznicę bolesną, niewydolność serca lub cukrzycową chorobę nerek). Te rozważania mogą kierować wyborem terapii.
AVAPRO 300mg może być stosowany samodzielnie lub w połączeniu z innymi lekami przeciwnadciśnieniowymi.
Nefropatia u pacjentów z cukrzycą typu 2
AVAPRO jest wskazany w leczeniu nefropatii cukrzycowej u pacjentów z cukrzycą typu 2 i nadciśnieniem, podwyższonym poziomem kreatyniny w surowicy i białkomoczem (>300 mg/dobę). W tej populacji AVAPRO zmniejsza tempo progresji nefropatii mierzonej występowaniem podwojenia stężenia kreatyniny w surowicy lub schyłkowej niewydolności nerek (konieczność dializy lub przeszczepu nerki) [patrz Studia kliniczne ].
DAWKOWANIE I SPOSÓB PODAWANIA
Uwagi ogólne
AVAPRO można podawać z innymi lekami przeciwnadciśnieniowymi oraz z posiłkiem lub bez posiłku.
Nadciśnienie
Zalecana dawka początkowa leku AVAPRO 300 mg wynosi 150 mg raz na dobę. Dawkę można zwiększyć do maksymalnej dawki 300 mg raz na dobę w celu kontrolowania ciśnienia krwi [patrz Studia kliniczne ].
Nefropatia u pacjentów z cukrzycą typu 2
Zalecana dawka to 300 mg raz na dobę [patrz Studia kliniczne ].
Dostosowanie dawki u pacjentów objętościowych i ubogich w sól
Zalecana dawka początkowa wynosi 75 mg raz na dobę u pacjentów ze zmniejszoną objętością wewnątrznaczyniową lub zmniejszoną zawartością soli (np. pacjenci intensywnie leczeni lekami moczopędnymi lub poddawani hemodializie) [patrz OSTRZEŻENIA I ŚRODKI ].
JAK DOSTARCZONE
Formy dawkowania i mocne strony
AVAPRO 75 mg to biała lub biaława, dwuwypukła, owalna tabletka powlekana z wytłoczonym sercem po jednej stronie i „2871” po drugiej.
AVAPRO 150 mg to biała lub biaława, dwuwypukła, owalna tabletka powlekana z wytłoczonym sercem po jednej stronie i „2872” po drugiej.
AVAPRO 300 mg to biała lub biaława, dwuwypukła, owalna tabletka powlekana z wytłoczonym sercem po jednej stronie i „2873” po drugiej.
Składowania i stosowania
AVAPRO (irbesartan) jest dostępny w postaci białych lub prawie białych, obustronnie wypukłych, owalnych tabletek powlekanych, z wytłoczonym kształtem serca po jednej stronie i kodem po drugiej (patrz Tabela poniżej). Butelki jednorazowego użytku zawierają 30 lub 90 tabletek powlekanych w następujący sposób:
Przechowywać w 25°C (77°F); wycieczki dozwolone do 15°C–30°C (59°F–86°F) [patrz Temperatura pokojowa kontrolowana przez USP ].
Sanofi- Aventis US LLC, Bridgewater, NJ 08807, A SANOFI COMPANY. Poprawiono: wrzesień 2021
SKUTKI UBOCZNE
Następujące ważne działania niepożądane opisano w innym miejscu na etykiecie:
- Niedociśnienie u pacjentów objętościowych lub ubogich w sól [patrz OSTRZEŻENIA I ŚRODKI ]
- Upośledzona funkcja nerek [patrz OSTRZEŻENIA I ŚRODKI ]
Doświadczenie w badaniach klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanych w praktyce. Informacje o działaniach niepożądanych z badań klinicznych stanowią jednak podstawę do identyfikacji zdarzeń niepożądanych, które wydają się być związane z zażywaniem narkotyków, oraz do przybliżania wskaźników.
Nadciśnienie
AVAPRO został oceniony pod kątem bezpieczeństwa u ponad 4300 pacjentów z nadciśnieniem i ogółem około 5000 pacjentów. To doświadczenie obejmuje 1303 pacjentów leczonych przez ponad 6 miesięcy i 407 pacjentów przez 1 rok lub dłużej.
badaniach klinicznych kontrolowanych placebo u co najmniej 1% pacjentów leczonych preparatem AVAPRO (n=1965) zgłoszono następujące działania niepożądane, które występowały częściej w porównaniu z placebo (n=641), z wyjątkiem tych, które były zbyt ogólne, aby były nie są racjonalnie związane ze stosowaniem leku, ponieważ były związane z leczonym stanem lub są bardzo częste w leczonej populacji, obejmują: biegunkę (3% vs 2%), niestrawność/zgagę (2% vs 1%) i zmęczenie (4% vs 3%).
Stosowanie irbesartanu nie wiązało się ze zwiększoną częstością występowania suchego kaszlu, co jest zwykle związane ze stosowaniem inhibitorów ACE. W badaniach kontrolowanych placebo częstość występowania kaszlu u pacjentów leczonych irbesartanem wynosiła 2,8% w porównaniu z 2,7% u pacjentów otrzymujących placebo.
Nefropatia u pacjentów z cukrzycą typu 2
Hiperkaliemia
badaniu Irbesartan Diabetic Nephroopathy Trial (IDNT) (białkomocz ≥900 mg/dobę i stężenie kreatyniny w surowicy w zakresie 1,0-3,0 mg/dl) odsetek pacjentów z potasem >6 mEq/l wyniósł 18,6% w grupie AVAPRO 300 mg w porównaniu z 6,0% w grupie placebo. Przerwanie leczenia z powodu hiperkaliemii w grupie AVAPRO 150 mg wyniosło 2,1% w porównaniu z 0,4% w grupie placebo.
W IDNT działania niepożądane były podobne do tych obserwowanych u pacjentów z nadciśnieniem, z wyjątkiem zwiększonej częstości występowania objawów ortostatycznych, które występowały częściej w grupie AVAPRO 150 mg w porównaniu z grupą placebo: zawroty głowy (10,2% vs 6,0%), zawroty głowy ortostatyczne (5,4 % vs 2,7%) i niedociśnienie ortostatyczne (5,4% vs 3,2%).
Doświadczenie postmarketingowe
Następujące działania niepożądane zostały zidentyfikowane po dopuszczeniu produktu AVAPRO do obrotu. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek.
pokrzywka; obrzęk naczynioruchowy (obejmujący obrzęk twarzy, warg, gardła i (lub) języka); reakcja anafilaktyczna obejmująca wstrząs anafilaktyczny; zwiększone testy czynności wątroby; żółtaczka; zapalenie wątroby; hiperkaliemia; niedokrwistość; małopłytkowość; zwiększony CPK; szum w uszach; i hipoglikemia u pacjentów z cukrzycą.
INTERAKCJE Z LEKAMI
Środki zwiększające poziom potasu w surowicy
Jednoczesne podawanie preparatu AVAPRO z innymi lekami zwiększającymi stężenie potasu w surowicy może powodować hiperkaliemię, czasami ciężką. U takich pacjentów należy monitorować stężenie potasu w surowicy.
Lit
Podczas jednoczesnego stosowania irbesartanu i litu zgłaszano zwiększenie stężenia litu w surowicy i toksyczność litu. Monitoruj poziom litu u pacjentów otrzymujących irbesartan i lit.
Niesteroidowe leki przeciwzapalne (NLPZ), w tym selektywne inhibitory cyklooksygenazy-2 (inhibitory COX-2)
pacjentów w podeszłym wieku, odwodnionych (w tym leczonych diuretykami) lub z zaburzeniami czynności nerek, jednoczesne podawanie NLPZ, w tym selektywnych inhibitorów COX-2, z antagonistami receptora angiotensyny II (w tym irbesartanem) może spowodować pogorszenie czynności nerek , w tym możliwej ostrej niewydolności nerek. Efekty te są zwykle odwracalne. Okresowo monitorować czynność nerek u pacjentów otrzymujących irbesartan i NLPZ.
Działanie przeciwnadciśnieniowe antagonistów receptora angiotensyny II, w tym irbesartanu, może być osłabiane przez NLPZ, w tym selektywne inhibitory COX-2.
Podwójna blokada układu renina-angiotensyna (RAS)
Podwójna blokada RAS za pomocą antagonistów receptora angiotensyny, inhibitorów ACE lub aliskirenu wiąże się ze zwiększonym ryzykiem niedociśnienia, hiperkaliemii i zmian w czynności nerek (w tym ostrej niewydolności nerek) w porównaniu z monoterapią. Większość pacjentów otrzymujących kombinację dwóch inhibitorów RAS nie uzyskuje żadnych dodatkowych korzyści w porównaniu z monoterapią. Ogólnie należy unikać łącznego stosowania inhibitorów RAS. U pacjentów przyjmujących AVAPRO 150 mg i inne leki wpływające na układ RAS należy ściśle monitorować ciśnienie krwi, czynność nerek i elektrolity.
Nie należy podawać aliskirenu jednocześnie z preparatem AVAPRO u pacjentów z cukrzycą. Należy unikać stosowania aliskirenu z preparatem AVAPRO u pacjentów z zaburzeniami czynności nerek (GFR
OSTRZEŻENIA
Zawarte jako część ŚRODKI OSTROŻNOŚCI Sekcja.
ŚRODKI OSTROŻNOŚCI
Toksyczność płodu
AVAPRO 150 mg może spowodować uszkodzenie płodu, jeśli zostanie podany kobiecie w ciąży. Stosowanie leków działających na układ reninangiotensynowy w drugim i trzecim trymestrze ciąży zmniejsza czynność nerek płodu oraz zwiększa śmiertelność i śmiertelność płodu i noworodka. Powstałe małowodzie może być związane z hipoplazją płuc płodu i deformacjami szkieletu. Potencjalne działania niepożądane u noworodków obejmują hipoplazję czaszki, bezmocz, niedociśnienie, niewydolność nerek i zgon. W przypadku wykrycia ciąży należy jak najszybciej przerwać stosowanie preparatu AVAPRO [patrz Używaj w określonych populacjach ].
Niedociśnienie u pacjentów objętościowych lub ubogich w sól
U pacjentów z aktywowanym układem renina-angiotensyna, takich jak pacjenci odwodnieni lub z niedoborem soli (np. leczeni dużymi dawkami leków moczopędnych), po rozpoczęciu leczenia preparatem AVAPRO może wystąpić objawowe niedociśnienie. Prawidłowa objętość lub niedobór soli przed podaniem produktu AVAPRO 300 mg lub zastosuj niższą dawkę początkową [patrz DAWKOWANIE I SPOSÓB PODAWANIA ].
Upośledzona funkcja nerek
Zmiany w czynności nerek, w tym ostra niewydolność nerek, mogą być spowodowane lekami hamującymi układ renina-angiotensyna. Pacjenci, których czynność nerek może częściowo zależeć od aktywności układu renina-angiotensyna (np. pacjenci ze zwężeniem tętnicy nerkowej, przewlekłą chorobą nerek, ciężką niewydolnością serca lub niedoborem objętości), mogą być szczególnie narażeni na wystąpienie ostrej niewydolności nerek lub zgonu. na AVAPRO. U tych pacjentów należy okresowo monitorować czynność nerek. Rozważyć wstrzymanie lub przerwanie leczenia u pacjentów, u których podczas stosowania preparatu AVAPRO wystąpiło istotne klinicznie pogorszenie czynności nerek [patrz INTERAKCJE Z LEKAMI ].
Toksykologia niekliniczna
rakotwórczość, mutageneza, upośledzenie płodności
Nie zaobserwowano dowodów na działanie rakotwórcze po podaniu irbesartanu w dawkach do 500/1000 mg/kg/dobę (odpowiednio samce/samice) u szczurów i 1000 mg/kg/dobę u myszy przez okres do 2 lat. W przypadku samców i samic szczurów dawka 500 mg/kg/dobę zapewniała średnią ogólnoustrojową ekspozycję na irbesartan (AUC 0–24 godziny, związany plus niezwiązany) odpowiednio około 3 i 11 razy od średniej ogólnoustrojowej ekspozycji u ludzi otrzymujących maksymalne zalecane (MRHD) 300 mg irbesartanu/dobę, podczas gdy 1000 mg/kg/dobę (podawane wyłącznie kobietom) zapewniło średnią ogólnoustrojową ekspozycję około 21 razy większą niż zgłaszana u ludzi przy MRHD. W przypadku myszy płci męskiej i żeńskiej dawka 1000 mg/kg/dobę zapewniała ekspozycję na irbesartan odpowiednio około 3 i 5 razy większą niż ekspozycja u ludzi przy dawce 300 mg/dobę.
Irbesartan nie wykazywał działania mutagennego w szeregu testów in vitro (test mikrobiologiczny Amesa, test naprawy DNA hepatocytów szczura, test mutacji genów do przodu w komórkach ssaków V79). Irbesartan dał wynik ujemny w kilku testach na indukcję aberracji chromosomowych (in vitro – test na ludzkich limfocytach; in vivo – badanie mikrojądrowe myszy).
Irbesartan nie miał niekorzystnego wpływu na płodność ani kojarzenie się samców i samic szczurów przy dawkach doustnych ≤650 mg/kg/dobę, przy czym najwyższa dawka zapewnia ogólnoustrojową ekspozycję na irbesartan (AUC 0–24 godziny, związany plus niezwiązany) około 5 razy większy niż stwierdzono u ludzi otrzymujących MRHD 300 mg/dzień.
Używaj w określonych populacjach
Ciąża
Podsumowanie ryzyka
AVAPRO podawany kobiecie w ciąży może spowodować uszkodzenie płodu. Stosowanie leków działających na układ reninangiotensyny w drugim i trzecim trymestrze ciąży zmniejsza czynność nerek płodu oraz zwiększa zachorowalność i śmierć płodu i noworodka [patrz Rozważania kliniczne ]. W większości badań epidemiologicznych oceniających nieprawidłowości płodu po ekspozycji na leki hipotensyjne w pierwszym trymestrze nie odróżniano leków wpływających na układ renina-angiotensyna od innych leków hipotensyjnych. W przypadku wykrycia ciąży należy jak najszybciej odstawić AVAPRO 150 mg.
Wszystkie ciąże niosą ze sobą ryzyko wady wrodzonej, utraty lub innych niekorzystnych skutków, niezależnie od ekspozycji na lek. W ogólnej populacji Stanów Zjednoczonych szacowane podstawowe ryzyko poważnych wad wrodzonych i poronienia w klinicznie rozpoznanych ciążach wynosi odpowiednio 2% do 4% i 15% do 20%.
Rozważania kliniczne
Ryzyko związane z chorobą u matki i/lub zarodka i płodu
Nadciśnienie w ciąży zwiększa ryzyko wystąpienia u matki stanu przedrzucawkowego, cukrzycy ciążowej, przedwczesnego porodu i powikłań porodowych (np. konieczności cięcia cesarskiego i krwotoku poporodowego). Nadciśnienie zwiększa ryzyko zahamowania wzrostu płodu i zgonu wewnątrzmacicznego u płodu. Kobiety w ciąży z nadciśnieniem powinny być dokładnie monitorowane i odpowiednio leczone.
Działania niepożądane u płodu/noworodka
Małowodzio u kobiet w ciąży, które stosują leki wpływające na układ renina-angiotensyna w drugim i trzecim trymestrze ciąży, może powodować: zaburzenia czynności nerek płodu prowadzące do bezmoczu i niewydolności nerek, niedorozwój płuc płodu, deformacje szkieletu, w tym niedorozwój czaszki, niedociśnienie i śmierć.
W nietypowym przypadku, gdy nie ma odpowiedniej alternatywy dla terapii lekami wpływającymi na układ renina-angiotensyna dla konkretnego pacjenta, należy uprzedzić matkę o potencjalnym ryzyku dla płodu.
Wykonuj seryjne badania ultrasonograficzne w celu oceny środowiska wewnątrzowodniowego. Testy płodu mogą być odpowiednie w zależności od tygodnia ciąży. Pacjenci i lekarze powinni być jednak świadomi, że małowodzie może pojawić się dopiero po nieodwracalnym uszkodzeniu płodu. W przypadku zaobserwowania małowodzia należy rozważyć alternatywne leczenie. Uważnie obserwować niemowlęta, u których w przeszłości ekspozycja na preparat AVAPRO w okresie płodowym nie występowała pod kątem niedociśnienia, skąpomoczu i hiperkaliemii oraz innych objawów niewydolności nerek. U noworodków, u których w wywiadzie stwierdzono ekspozycję w okresie życia płodowego na AVAPRO 300 mg, jeśli wystąpi skąpomocz lub niedociśnienie, należy zwrócić uwagę na wspomaganie ciśnienia krwi i perfuzji nerek. Transfuzja wymienna lub dializa mogą być konieczne w celu odwrócenia niedociśnienia i/lub zastąpienia zaburzeń czynności nerek.
Dane
Dane zwierząt
Irbesartan przenika przez łożysko u szczurów i królików. U samic szczurów, którym podawano irbesartan przed kryciem w okresie ciąży i laktacji w dawkach doustnych 50, 180 lub 650 mg/kg/dobę (1,6 do 21,1-krotności maksymalnej zalecanej dawki u ludzi (MRHD) w oparciu o powierzchnię ciała), płody badano na W 20. dniu ciąży stwierdzono zwiększoną częstość występowania wodniaka moczowodu i kawitacji miedniczek nerkowych i/lub brak brodawek nerkowych we wszystkich grupach leczonych irbesartanem. Obrzęk podskórny wystąpił również u płodów przy dawkach matczynych ≥180 mg/kg/dobę (5,8-krotności MRHD). Te anomalie wystąpiły, gdy samice szczurów otrzymywały irbesartan przed kryciem do 20. dnia ciąży, ale nie były obserwowane u młodych po urodzeniu w tym samym badaniu, lub gdy irbesartan podawano ciężarnym szczurom tylko podczas organogenezy (od 6. dnia ciąży do 15. dnia ciąży) w dawki doustne od 50 do 450 mg/kg/dobę (do 14,6-krotności MRHD). Ponadto nie zaobserwowano niekorzystnego wpływu na rozwój nerek u młodych od matek, którym podawano irbesartan od 15. dnia ciąży do 24. dnia laktacji w dawkach 50, 180 lub 650 mg/kg/dobę (do 21,1 razy większej niż MRHD). Uważa się, że obserwowane efekty są późnymi efektami ciążowymi leku. Ciężarne króliki, którym podawano doustnie dawki irbesartanu 30 mg/kg/dobę (1,9-krotność MRHD w oparciu o powierzchnię ciała) charakteryzowały się wysokim wskaźnikiem śmiertelności matek i poronień. Przeżyły samice wykazywały niewielki wzrost wczesnych resorpcji i odpowiadający temu spadek żywych płodów.
Radioaktywność była obecna u płodów szczurów i królików w późnej ciąży po doustnych dawkach irbesartanu znakowanego radioizotopem.
Laktacja
Brak dostępnych danych dotyczących obecności irbesartanu w mleku kobiecym, wpływu na produkcję mleka lub u niemowląt karmionych piersią. Irbesartan lub jakiś metabolit irbesartanu jest wydzielany do mleka karmiących szczurów [patrz FARMAKOLOGIA KLINICZNA ]. Ze względu na możliwy niekorzystny wpływ na karmione niemowlę, nie zaleca się stosowania preparatu AVAPRO 150 mg u kobiet karmiących piersią.
Zastosowanie pediatryczne
Irbesartan w badaniu w dawce do 4,5 mg/kg/dobę raz na dobę nie wydawał się skutecznie obniżać ciśnienia krwi u dzieci w wieku od 6 do 16 lat.
AVAPRO nie był badany u dzieci w wieku poniżej 6 lat.
Zastosowanie geriatryczne
Spośród 4925 pacjentów otrzymujących AVAPRO w kontrolowanych badaniach klinicznych dotyczących nadciśnienia, 911 (18,5%) miało 65 lat i więcej, a 150 (3,0%) 75 lat i więcej. Nie zaobserwowano ogólnych różnic w skuteczności lub bezpieczeństwie między tymi osobami a młodszymi osobami, ale nie można wykluczyć większej wrażliwości niektórych osób starszych. [Widzieć FARMAKOLOGIA KLINICZNA oraz Studia kliniczne ]
PRZEDAWKOWAĆ
Brak danych dotyczących przedawkowania u ludzi. Jednak dzienne dawki 900 mg przez 8 tygodni były dobrze tolerowane. Oczekuje się, że najbardziej prawdopodobnymi objawami przedawkowania będą niedociśnienie i tachykardia; bradykardia może również wystąpić w wyniku przedawkowania. Irbesartan nie jest usuwany przez hemodializę.
Badania ostrej toksyczności doustnej irbesartanu u myszy i szczurów wykazały, że ostre śmiertelne dawki przekraczały 2000 mg/kg, odpowiednio około 25-krotnie i 50-krotnie MRHD (300 mg) w oparciu o powierzchnię ciała.
PRZECIWWSKAZANIA
AVAPRO 150mg jest przeciwwskazany u pacjentów z nadwrażliwością na którykolwiek składnik tego produktu.
Nie należy podawać aliskirenu jednocześnie z preparatem AVAPRO 300 mg pacjentom z cukrzycą.
FARMAKOLOGIA KLINICZNA
Mechanizm akcji
Angiotensyna II jest silnym środkiem zwężającym naczynia powstający z angiotensyny I w reakcji katalizowanej przez enzym konwertujący angiotensynę (ACE, kininaza II). Angiotensyna II jest głównym wazoaktywnym hormonem układu reninangiotensyny i ważnym składnikiem patofizjologii nadciśnienia. Stymuluje również wydzielanie aldosteronu przez korę nadnerczy. Irbesartan blokuje działanie angiotensyny II powodujące zwężenie naczyń i wydzielanie aldosteronu poprzez selektywne wiązanie się z receptorem AT1 angiotensyny II występującym w wielu tkankach (np. mięśniach gładkich naczyń, nadnerczach). W wielu tkankach znajduje się również receptor AT2, ale nie jest on zaangażowany w homeostazę układu sercowo-naczyniowego.
Irbesartan jest specyficznym kompetycyjnym antagonistą receptorów AT1 o znacznie większym powinowactwie (ponad 8500 razy) do receptora AT1 niż do receptora AT2 i nie wykazuje aktywności agonistycznej.
Blokada receptora AT1 usuwa ujemne sprzężenie zwrotne angiotensyny II na wydzielanie reniny, ale wynikająca z tego zwiększona aktywność reninowa osocza i krążąca angiotensyna II nie przezwyciężają wpływu irbesartanu na ciśnienie krwi.
Irbesartan nie hamuje aktywności konwertazy angiotensyny ani reniny, ani nie wpływa na inne receptory hormonalne lub kanały jonowe, o których wiadomo, że biorą udział w sercowo-naczyniowej regulacji ciśnienia krwi i homeostazy sodu.
Farmakodynamika
U zdrowych osób pojedyncze doustne dawki irbesartanu do 300 mg powodowały zależne od dawki hamowanie działania presyjnego infuzji angiotensyny II. Hamowanie było całkowite (100%) 4 godziny po doustnych dawkach 150 mg lub 300 mg, a częściowe hamowanie utrzymywało się przez 24 godziny (60% i 40% odpowiednio przy 300 mg i 150 mg).
pacjentów z nadciśnieniem hamowanie receptora angiotensyny II po długotrwałym podawaniu irbesartanu powoduje 1,5- do 2-krotny wzrost stężenia angiotensyny II w osoczu i 2-krotny do 3-krotny wzrost stężenia reniny w osoczu. Stężenie aldosteronu w osoczu na ogół spada po podaniu irbesartanu, ale zalecane dawki nie wpływają znacząco na stężenie potasu w surowicy.
U pacjentów z nadciśnieniem długotrwałe doustne dawki irbesartanu (do 300 mg) nie miały wpływu na szybkość filtracji kłębuszkowej, nerkowy przepływ osocza ani frakcję filtracyjną. W badaniach dawek wielokrotnych u pacjentów z nadciśnieniem tętniczym nie stwierdzono klinicznie istotnego wpływu na stężenie trójglicerydów na czczo, cholesterolu całkowitego ani cholesterolu HDL. Nie zaobserwowano wpływu na stężenie kwasu moczowego w surowicy podczas przewlekłego podawania doustnego ani efektu wydalania kwasu moczowego.
Farmakokinetyka
Wchłanianie
Wchłanianie doustne irbesartanu jest szybkie i całkowite, a średnia bezwzględna biodostępność wynosi od 60% do 80%. Po podaniu doustnym produktu AVAPRO maksymalne stężenie irbesartanu w osoczu jest osiągane po 1,5 do 2 godzin po podaniu. Pokarm nie wpływa na biodostępność irbesartanu.
Irbesartan wykazuje liniową farmakokinetykę w zakresie dawek terapeutycznych.
Dystrybucja
Irbesartan wiąże się w 90% z białkami surowicy (głównie albuminą i kwaśną glikoproteiną α) przy nieznacznym wiązaniu ze składnikami komórkowymi krwi. Średnia objętość dystrybucji wynosi od 53 do 93 litrów.
Badania na zwierzętach wskazują, że znakowany radioaktywnie irbesartan słabo przenika przez barierę krew-mózg i łożysko. Irbesartan przenika do mleka karmiących szczurów.
Eliminacja
Całkowity klirens osoczowy i nerkowy mieści się odpowiednio w zakresie od 157 do 176 ml/min i 3,0 do 3,5 ml/min. Okres półtrwania w końcowej fazie eliminacji irbesartanu wynosi średnio 11 do 15 godzin. Stężenia w stanie stacjonarnym są osiągane w ciągu 3 dni. Po wielokrotnym podawaniu raz na dobę obserwuje się ograniczoną kumulację irbesartanu (
Metabolizm
Irbesartan jest substancją czynną po podaniu doustnym, która nie wymaga biotransformacji do postaci aktywnej. Irbesartan jest metabolizowany poprzez sprzęganie i utlenianie glukuronidów. Po podaniu doustnym lub dożylnym irbesartanu znakowanego węglem C, ponad 80% radioaktywności krążącego osocza jest przypisywane niezmienionemu irbesartanowi. Głównym krążącym metabolitem jest nieaktywny koniugat glukuronidu irbesartanu (około 6%). Pozostałe metabolity oksydacyjne nie zwiększają znacząco aktywności farmakologicznej irbesartanu.
Badania in vitro wskazują, że irbesartan jest utleniany głównie przez CYP2C9; metabolizm przez CYP3A4 jest znikomy.
Wydalanie
Irbesartan i jego metabolity są wydalane zarówno z żółcią, jak i przez nerki. Po podaniu doustnym lub dożylnym irbesartanu znakowanego węglem 14C około 20% radioaktywności jest wykrywane w moczu, a pozostała część w kale w postaci irbesartanu lub glukuronidu irbesartanu.
Określone populacje
Seks
Nie obserwuje się różnic farmakokinetycznych związanych z płcią u zdrowych osób w podeszłym wieku (w wieku 65–80 lat) lub u zdrowych młodych osób (w wieku 18–40 lat). W badaniach pacjentów z nadciśnieniem tętniczym nie stwierdzono różnic między płciami w okresie półtrwania ani kumulacji, ale nieco wyższe stężenia irbesartanu w osoczu obserwuje się u kobiet (11%–44%). Nie jest konieczne dostosowanie dawki w zależności od płci.
Geriatria
osób w podeszłym wieku (wiek 65–80 lat) okres półtrwania irbesartanu w fazie eliminacji nie jest znacząco zmieniony, ale wartości AUC i Cmax są o około 20% do 50% większe niż u osób młodych (wiek 18–40 lat). Nie ma konieczności dostosowania dawkowania u osób w podeszłym wieku.
Rasa/etniczność
U zdrowych osób rasy czarnej wartości AUC irbesartanu są o około 25% większe niż u osób rasy białej; nie ma różnicy w wartościach Cmax.
Zaburzenia czynności nerek
Farmakokinetyka irbesartanu nie zmienia się u pacjentów z zaburzeniami czynności nerek lub u pacjentów poddawanych hemodializie. Irbesartan nie jest usuwany przez hemodializę. Nie ma konieczności dostosowania dawki u pacjentów z łagodnymi lub ciężkimi zaburzeniami czynności nerek, chyba że pacjent z zaburzeniami czynności nerek jest również odwodniony [patrz OSTRZEŻENIA I ŚRODKI oraz DAWKOWANIE I SPOSÓB PODAWANIA ].
Niewydolność wątroby
Farmakokinetyka irbesartanu po wielokrotnym podaniu doustnym nie zmienia się znacząco u pacjentów z lekką do umiarkowanej marskością wątroby. Nie ma konieczności dostosowania dawki u pacjentów z niewydolnością wątroby.
Interakcje między lekami
Badania in vitro wykazują znaczące hamowanie tworzenia się utlenionych metabolitów irbesartanu ze znanymi substratami/inhibitorami cytochromu CYP2C9 sulfenazolem, tolbutamidem i nifedypiną. Jednak w badaniach klinicznych wpływ jednoczesnego stosowania irbesartanu na farmakodynamikę warfaryny był znikomy. Na podstawie danych in vitro nie należy oczekiwać interakcji z lekami, których metabolizm jest zależny od izoenzymów 1A1, 1A2, 2A6, 2B6, 2D6, 2E1 lub 3A4 cytochromu P450.
W oddzielnych badaniach pacjentów otrzymujących podtrzymujące dawki warfaryny, hydrochlorotiazydu lub digoksyny, podawanie irbesartanu przez 7 dni nie miało wpływu na farmakodynamikę warfaryny (czas protrombinowy) ani farmakokinetykę digoksyny. Jednoczesne podawanie nifedypiny lub hydrochlorotiazydu nie wpływa na farmakokinetykę irbesartanu.
Studia kliniczne
Nadciśnienie
Działanie przeciwnadciśnieniowe preparatu AVAPRO badano w 7 8-12-tygodniowych badaniach kontrolowanych placebo z udziałem pacjentów z początkowym rozkurczowym ciśnieniem krwi od 95 do 110 mmHg. W badaniach tych uwzględniono dawki od 1 do 900 mg w celu pełnego zbadania zakresu dawek irbesartanu. Badania te umożliwiły porównanie schematów dawkowania raz lub dwa razy dziennie w dawce 150 mg/dobę, porównanie efektów szczytowych i minimalnych oraz porównanie odpowiedzi według płci, wieku i rasy. W dwóch z siedmiu zidentyfikowanych powyżej badań kontrolowanych placebo zbadano przeciwnadciśnieniowe działanie irbesartanu i hydrochlorotiazydu w połączeniu.
badań nad monoterapią irbesartanem obejmowało łącznie 1915 pacjentów przydzielonych losowo do grupy irbesartanu (1–900 mg) i 611 pacjentów przydzielonych losowo do grupy placebo. Dawki 150 mg i 300 mg raz na dobę zapewniały statystycznie i klinicznie istotne zmniejszenie skurczowego i rozkurczowego ciśnienia krwi z minimalnymi (24 godziny po podaniu) skutkami po 6 do 12 tygodniach leczenia w porównaniu z placebo, o około 8-10/ Odpowiednio 5–6 mmHg i 8–12/5–8 mmHg. Nie zaobserwowano dalszego wzrostu działania przy dawkach większych niż 300 mg. Zależności dawka-odpowiedź dla wpływu na ciśnienie skurczowe i rozkurczowe przedstawiono na rycinach 1 i 2.
Rycina 1: zmniejszenie SeSBP po odjęciu placebo; zintegrowana analiza
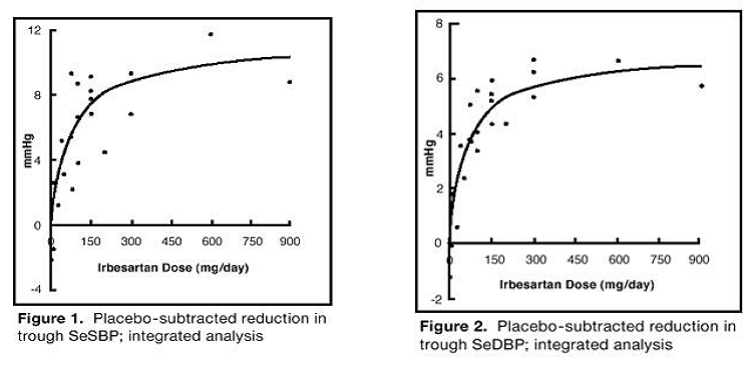
Figura 2: zmniejszenie SeSBP po odjęciu placebo; zintegrowana analiza
Podawanie raz na dobę dawek terapeutycznych irbesartanu dawało szczytowe działanie po około 3 do 6 godzinach, a w jednym badaniu ambulatoryjnego monitorowania ciśnienia krwi ponownie po około 14 godzinach. Zaobserwowano to zarówno przy dawkowaniu raz dziennie, jak i dwa razy dziennie. Stosunek wartości minimalnej do szczytowej odpowiedzi skurczowej i rozkurczowej wynosił na ogół od 60% do 70%. W ciągłym ambulatoryjnym badaniu monitorującym ciśnienie krwi, dawkowanie raz na dobę 150 mg dało minimalne i średnie odpowiedzi dobowe podobne do obserwowanych u pacjentów otrzymujących dwa razy na dobę taką samą całkowitą dawkę dobową.
W kontrolowanych badaniach dodanie irbesartanu do hydrochlorotiazydu w dawkach 6,25 mg, 12,5 mg lub 25 mg powodowało dalsze zależne od dawki obniżenie ciśnienia krwi, podobne do uzyskiwanego przy tej samej monoterapii dawką irbesartanu. HCTZ miał również w przybliżeniu addytywny efekt.
Analiza podgrup pacjentów pod względem wieku, płci i rasy wykazała, że mężczyźni i kobiety oraz pacjenci w wieku powyżej i poniżej 65 lat mieli zasadniczo podobne odpowiedzi. Irbesartan był skuteczny w obniżaniu ciśnienia krwi niezależnie od rasy, chociaż efekt był nieco mniejszy u osób rasy czarnej (zwykle w populacji o niskiej zawartości reniny).
Działanie irbesartanu jest widoczne już po pierwszej dawce i jest bliskie pełnego działania obserwowanego po 2 tygodniach. Pod koniec 8-tygodniowej ekspozycji około 2/3 działania przeciwnadciśnieniowego było nadal obecne tydzień po ostatniej dawce. Nie obserwowano nadciśnienia z odbicia. W kontrolowanych badaniach klinicznych nie zaobserwowano zasadniczo zmiany średniej częstości akcji serca u pacjentów leczonych irbesartanem.
Nefropatia u pacjentów z cukrzycą typu 2
Irbesartan Diabetic Nephroopathy Trial (IDNT) było randomizowanym, podwójnie ślepym, wieloośrodkowym badaniem kontrolowanym placebo i aktywną kontrolą, przeprowadzonym na całym świecie u 1715 pacjentów z cukrzycą typu 2, nadciśnieniem (SeSBP > 135 mm Hg lub SeDBP > 85 mm Hg) i nefropatią (surowica kreatynina 1,0 do 3,0 mg/dl u kobiet lub 1,2 do 3,0 mg/dl u mężczyzn i białkomocz ≥900 mg/dobę). Pacjenci zostali losowo przydzieleni do grupy otrzymującej AVAPRO 75 mg, amlodypinę 2,5 mg lub odpowiadające placebo raz na dobę. Pacjenci byli dostosowywani do dawki podtrzymującej AVAPRO 300 mg lub amlodypiny 10 mg, w zależności od tolerancji. Dodatkowe leki przeciwnadciśnieniowe (z wyjątkiem inhibitorów ACE, antagonistów receptora angiotensyny II i blokerów kanału wapniowego) były dodawane w razie potrzeby, aby osiągnąć docelowe ciśnienie krwi (≤135/85 lub 10 mmHg obniżenie skurczowego ciśnienia krwi, jeśli jest wyższe niż 160 mmHg) u pacjentów we wszystkich grupach .
Badana populacja składała się z 66,5% mężczyzn, 72,9% w wieku poniżej 65 lat i 72% rasy białej (5,0% mieszkańców wysp Azji/Pacyfiku, rasy czarnej 13,3%, 4,8% latynoskich). Średnie wyjściowe ciśnienie skurczowe i rozkurczowe w pozycji siedzącej wynosiło odpowiednio 159 mmHg i 87 mmHg. Pacjenci przystępowali do badania ze średnim stężeniem kreatyniny w surowicy 1,7 mg/dl i średnią białkomoczem 4144 mg/dobę.
Średnie osiągnięte ciśnienie krwi wynosiło 142/77 mmHg dla AVAPRO, 142/76 mmHg dla amlodypiny i 145/79 mmHg dla placebo. Ogólnie 83,0% pacjentów otrzymywało docelową dawkę irbesartanu w ponad 50% przypadków. Pacjenci byli obserwowani przez średni okres 2,6 roku.
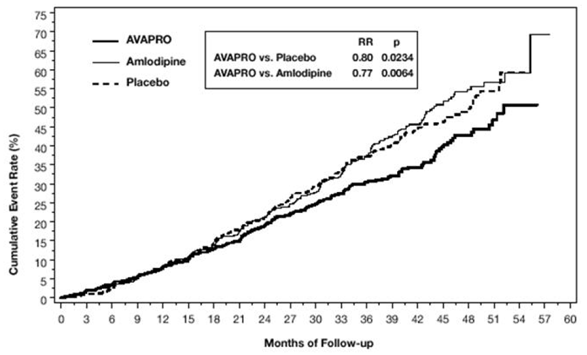
Pierwszorzędowym złożonym punktem końcowym był czas do wystąpienia któregokolwiek z następujących zdarzeń: podwojenie wyjściowego stężenia kreatyniny w surowicy, schyłkowa niewydolność nerek (ESRD; zdefiniowana jako stężenie kreatyniny w surowicy ≥6 mg/dl, dializa lub przeszczep nerki) lub zgon . Leczenie preparatem AVAPRO 150 mg skutkowało 20% zmniejszeniem ryzyka w porównaniu z placebo (p=0,0234) (patrz Rysunek 3 i Tabela 1). Leczenie preparatem AVAPRO 150 mg zmniejszyło również występowanie utrzymującego się podwojenia stężenia kreatyniny w surowicy jako oddzielny punkt końcowy (33%), ale nie miało znaczącego wpływu na samą ESRD i nie miało wpływu na całkowitą śmiertelność (patrz Tabela 1).
Rycina 3: IDNT: Oszacowania Kaplana-Meiera pierwszorzędowego punktu końcowego (podwojenie stężenia kreatyniny w surowicy, schyłkowa choroba nerek lub śmiertelność z jakiejkolwiek przyczyny)
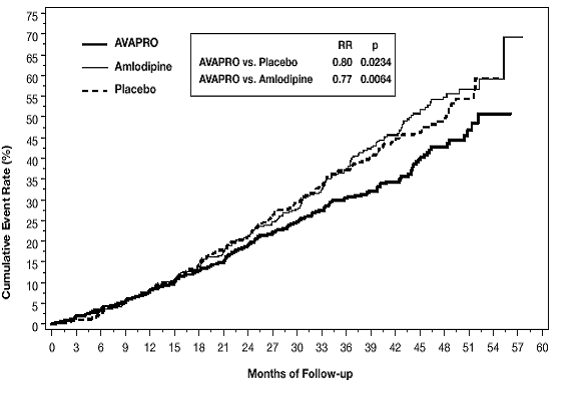
Odsetki pacjentów doświadczających zdarzenia w trakcie badania można zobaczyć w Tabeli 1 poniżej:
Drugim punktem końcowym badania była śmiertelność i chorobowość z przyczyn sercowo-naczyniowych (zawał mięśnia sercowego, hospitalizacja z powodu niewydolności serca, udar z trwałym deficytem neurologicznym, amputacja). Nie było statystycznie istotnych różnic między grupami leczenia w tych punktach końcowych. W porównaniu z placebo, AVAPRO 150 mg znacząco zmniejszył białkomocz o około 27%, co było widoczne w ciągu 3 miesięcy od rozpoczęcia terapii. AVAPRO znacznie zmniejszył szybkość utraty czynności nerek (wskaźnik przesączania kłębuszkowego), mierzoną odwrotnością stężenia kreatyniny w surowicy, o 18,2%.
Tabela 2 przedstawia wyniki dla podgrup demograficznych. Analizy podgrup są trudne do interpretacji i nie wiadomo, czy te obserwacje reprezentują prawdziwe różnice, czy też przypadkowe efekty. W przypadku pierwszorzędowego punktu końcowego korzystne działanie preparatu AVAPRO obserwowano u pacjentów przyjmujących również inne leki przeciwnadciśnieniowe (nie zezwalano na antagonistów receptora angiotensyny II, inhibitory konwertazy angiotensyny i blokery kanału wapniowego), doustne leki hipoglikemizujące oraz środki obniżające.
INFORMACJA O PACJENCIE
Ciąża
Poinformuj pacjentki w wieku rozrodczym o konsekwencjach narażenia na AVAPRO w czasie ciąży. Omów możliwości leczenia z kobietami planującymi ciążę. Pacjentki należy poprosić o jak najszybsze zgłoszenie ciąży swoim lekarzom.
Suplementy potasu
Poradź pacjentom otrzymującym AVAPRO, aby nie stosowali suplementów potasu lub substytutów soli zawierających potas bez konsultacji z lekarzem [patrz INTERAKCJE Z LEKAMI ].
